Keywords
Microcapsules, Biochemical compositions, Protein, Lipid
Giris
Deniz baliklari kuluçkahanelerinde larvalarin beslenmesinde Artemia ve rotifer gibi canli yemler yogun olarak kullanilmaktadir. Rotifer üretiminin yüksek maliyeti ve Artemia’nin kay-naklarinin gün geçtikçe azaliyor olmasi, su ürün-leri sektörünün sürdürülebilirligini saglamak için arastiricilari mevcut canli yemleri ikame edebile-cek alternatif yem kaynaklari arayisina yönlen-dirmistir. Bu baglamda, son zamanlarda çalis-malar çesitli metotlarla üretilen mikrokapsül yemler ve bu yemlerin canli yemleri ikameleri üzerine yogunlasmistir (Walford ve ark., 1991; Lazo ve ark., 2000; Yufera, 1996; Gamsiz, 2002). Simdiye kadar üretilen mikrokapsül yemler tatli su baliklarinin gelisiminde basari saglarken, de-niz baliklari larvalarinda kullanildiklari zaman sinirli bir basari göstermistir. Buna karsilik, mik-rokapsül yemler canli yemlerle birlikte kullanil-diklari zaman basari oraninin arttigi gözlenmistir. (Appelbaum ve Van Damme, 1988; Tandler ve Kolkovski, 1991; Gamsiz, 2002). Arastiricilar bu sinirli basariyi, yemlerin büyüklügüne, yapisina, sindirebilirliklerine, besin elementlerin suya sali-nimlarinin yüksekligine ve larvanin sindirim sis-teminin yetersizligine baglamislardir (Munilla-Moran ve ark., 1990; Walford ve Lam, 1993; Lo-pez Alvarado ve Kanazawa, 1994; Yufera, 1995).
Günümüzde, mikrokapsül yemler çok farkli üretim teknikleriyle üretilebilmektedir (Kana-zawa ve Teshima, 1988; Langdon, 2000, Yufera, 2005). Bu üretim tekniklerin zenginligi, balik larvalarinin sindirimini etkilemeyecek kapsül du-var malzemesinin seçiminde arastiricilara büyük bir avantaj saglamaktadir. Mikrokapsüllerin, iste-nilen boyutlarda üretimlerinin mümkün olmasi, larvalarin beslenmesi açisindan düsünüldügünde diger bir avantaj olarak dikkat çekmektedir. Dik-kat edilmesi gereken; farkli boyutlarda üretim yapildigi zaman, boyutlar arasinda biyokimyasal açidan farkliligin olup olmadigidir. Bu konuda simdiye kadar yapilmis bir çalisma mevcut degil-dir. Bu çalismanin amaci, farkli boyutlarda üre-tilen Na-alginat mikrokapsüllerin biyokimyasal kompozisyonlarindaki degisimleri ortaya koy-maktir.
Materyal ve Metot
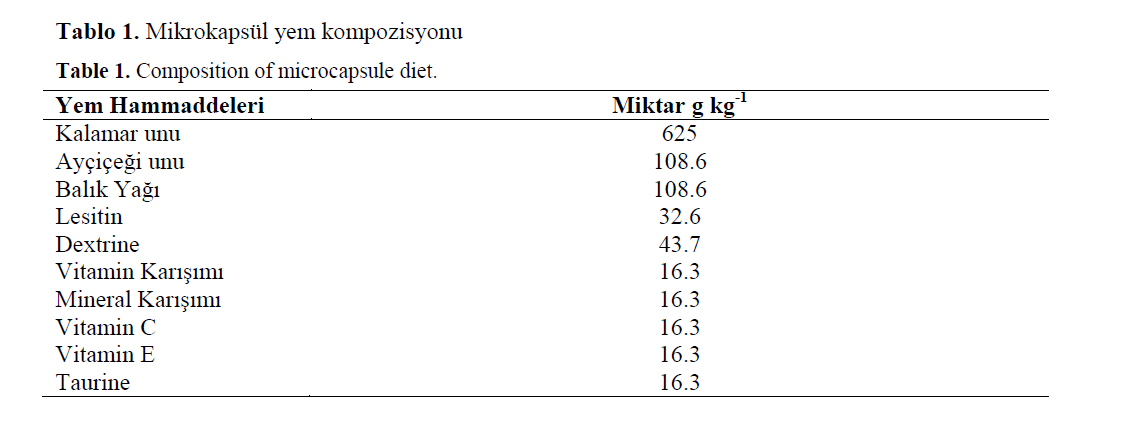
Bu çalismada kullanilan mikrokapsül yemler Yufera (2005) tarafindan tanimlanan Na-alginat metoduna göre Instituto de Ciencias Marinas de Andalucia(CSIC-Ispanya) laboratuarlarinda üre-tildi. Yem içerigi Tablo 1’de verilir. Üretilen mikrokapsül yemler öncelikle liyofilize edildi ve daha sonra farkli göz açikliklarina sahip elekler-den geçirildi. Eleme islemi sonrasin da 6 farkli boyutta (80-200μ; 200-250μ; 250-355μ; 355-500μ; 500-900μ; >900μ) mikrokapsül yem elde edilmistir. Mikrokapsül yemlerin biyokimyasal analizleri ise Mustafa Kemal Üniversitesi Su Ürünleri Fakültesi laboratuarlarinda yapilmistir. Mikrokapsül yemlerin kuru madde, kül ve pro-tein analizleri AOAC (2000)’a göre, lipid analiz-leri Bligh and Dyer (1959) tarafindan tanimlanan kloroform/methanol ekstraksiyonuyla yapildi.
Tablo 1. Mikrokapsül yem kompozisyonu
Table 1. Composition of microcapsule diet.
Elde edilen veriler SPSS 9.0 for Windows pa-ket programi kullanilarak tek yönlü Anova ile degerlendirilmis ve sonuçlar ortalama±standart hata olarak verilmistir. Ortalamalar arasindaki istatistiksel farkliliklari belirlemek için Duncan çoklu karsilastirma testinden faydalanilmistir (SPSS, 1993)
Bulgular ve Tartisma
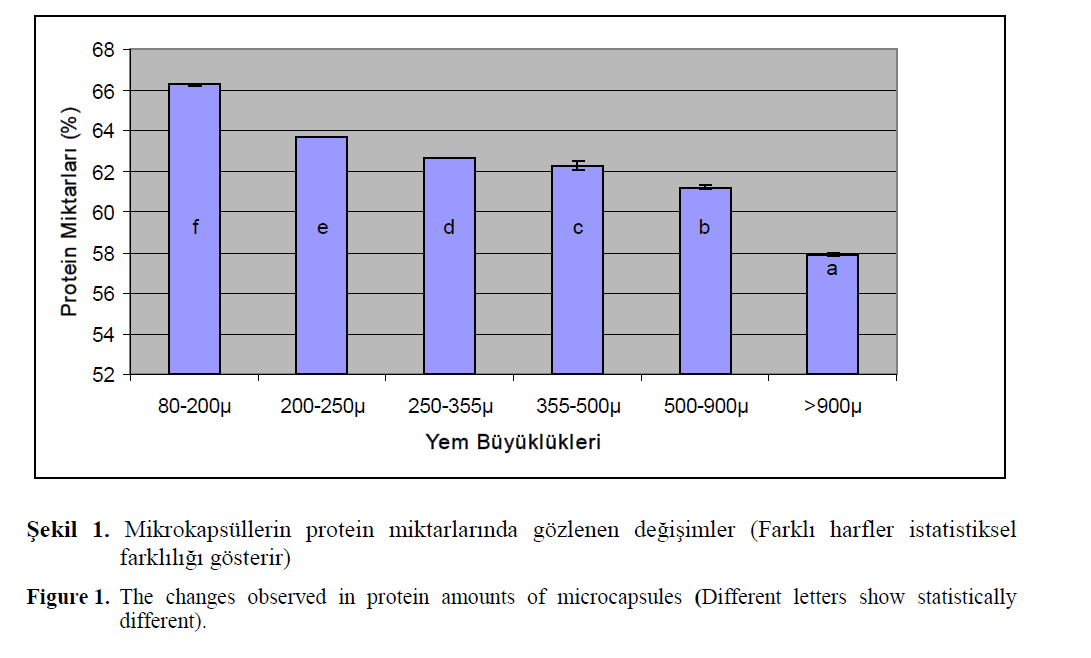
Bu çalismanin amaci, Na-alginat metoduyla üretilen farkli büyüklüklere sahip mikrokapsül yemlerin biyokimyasal kompozisyonlarindaki degisimleri ortaya koymaktir. Mikrokapsüllerin kuru madde, kül ve lipit kompozisyonlarindaki degisimler Tablo 2 de verilmistir. Farkli boyut-lardaki mikrokapsüllerin kuru madde, kül ve lipit kompozisyonlarinda gözlenen farkliliklarin ista-tistiksel olarak önemli oldugu bulunmustur (P<0.05). En yüksek kuru madde 80-200μ’luk yemlerde gözlenirken, en yüksek kül miktari >900μ’luk grupta gözlendi(P<0,05). En yüksek lipit içerigi ise 355-500μ’luk grupta tespit edildi(P<0.05). Mikrokapsül gruplarina ait pro-tein miktarlari ise Sekil 1 de verilmistir. Protein miktarlari arasinda istatistiksel olarak farkliliklar gözlenmis olup, en yüksek protein miktari 80-200μ’luk grupta bulunmustur (P<0.05). Protein sonuçlarina göre, yem büyüklügü arttikça protein miktarlarinda düsme egilimi oldugu tespit edil-mistir. Cahu ve Zambonino Infante (1994), deniz baliklari larvalarinin yalnizca mikroyemlerle beslendikleri zaman düsük bir yasama ve büyüme gösterdiklerini, buna karsilik besleme esnasinda larvalara mikroyemlerle beraber canli yemler ve-rildigi zaman daha iyi bir büyüme ve yasama elde ettiklerini bildirmislerdir. Arastiricilar bu basa-riyi, dissal gidanin sindirimi için larvalarin yeterli bir enzim kapasitesine sahip olmamasina ve canli yemlerin enzim katkisina baglamislardir (Mu-nilla-Moran ve ark., 1990; Kolkovski ve ark., 1997). Enzim katkilari üzerine yapilan çalisma-lar, canli gidadan gelen enzim katkisinin çok kü-çük miktarlarda oldugunu ortaya koymustur (Ku-rokawa ve ark., 1998; Garcia-Ortega ve ark., 2000). Önceki çalismalarin sonuçlarindan hareket ederek, mikrodiyetlerin basarisizliginin sadece larvalarin enzim yetersizliginden olmadigini, bu faktörün yaninda mevcut çalismanin sonuçlari, larvalara verilen mikroyemlerin gerçekten üretim esnasinda hedeflenen biyokimyasal kompozis-yona sahip olup olmadiklarinin test edilmesinin önemli oldugunu ortaya koymaktadir.
Tablo 2. Mikrokapsüllerin kuru madde, kül ve lipit kompozisyonlarinda gözlenen degisimler.
Table 2.The changes observed in dry matter, ash and lipid compositions of microcapsules (%)
Sekil 1. Mikrokapsüllerin protein miktarlarinda gözlenen degisimler (Farkli harfler istatistiksel farkliligi gösterir)
Figure 1. The changes observed in protein amounts of microcapsules (Different letters show statistically different).
Sonuç
Bu çalisma, Na-alginat üretim metoduyla üre-tilen farkli büyüklüklere sahip mikrokapsüllerin biyokimyasal kompozisyonlari arasindaki farkli-liklari ortaya koymustur. Farkli büyüklüklerdeki mikrokapsüllerin biyokimyasal kompozisyonlari arasinda istatistiksel farkliliklar gözlenmis olup, deniz baliklari larvalarina sunulan mikroyemler de bir homojenlik saglanamadigi tespit edilmistir. Çalismanin sonuçlari, mikroyemlerin canli yem-lerle ikamesinde yasanan olumsuzluklarin biyo-kimyasal kompozisyonlarda gözlenen dalgalan-malardan kaynaklanabilecegine dikkat çekmistir. Gelecekte su ürünleri sektörünün sürdürülebilir-ligi için, canli yemlerin ikamesi çalismalarinda simdiye kadar kullanilan mikroyem üretim me-totlarinin test edilmesi ve üretilen mikroyemlerin farkli büyüklük siniflari arasinda en yüksek ho-mojeniteye sahip mikroyem üretim metodunun ortaya çikarilmasi üzerine çalismalar yapilmali-dir.
Kaynaklar
AOAC., (2000). Official methods of analysis of Association of Analytical Chemist. 15th Edn. Washington DC.
Appelbaum, S., Van Damme, P., (1988). The fea-sibility of using exclusively artificial dry feed for rearing of Israeli Clarias gariepinus (Burchell, 1882) larvae and fry, Journal of Applied Ichthyology, 4:105-110. doi:10.1111/j.1439-0426.1988.tb00549.x
Bligh, E.G., Dyer, W.J., (1959). A rapid method of total lipid extraction and purification, Ca-nadian Journal of Biochemistry and Physi-ology, 37: 911–917. doi: 10.1139/o59-099
Cahu, C.L., Zambonino Infante, J.L., (1994). Early weaning of sea bass (Dicentrarchus labrax) larvae with a compound diet:effect on digestive enzymes, Comparative Bio- chemistry and Physiology, 109A(2):213-222. doi: 10.1016/0300-9629(94)90123-6
Gamsiz, K., (2002). Çipura baligi (Sparus aurata l.) larvalarinin beslenmesinde zooplankton yerine mikrokapsül yem kullanimi üzerine arastirmalar. Doktora Tezi103s,Izmir.
Garcia-Ortega, A., Verreth, J., Segner, H., (2000). Post-prandial protease activity in the digestive tract of African catfish Clarias ga-riepinus larvae fed decapsulated cysts of Artemia, Fish Physiology and Biochemistry, 22: 237-244. doi: 10.1023/A:1007893223006
Kanazawa, A., Teshima, S., (1988). Microparti-culate diets for fish larvae. NOAA Technical Report NMFS 70.
Kolkovski, S., Kowen, W., Tandler, A., (1997). The mode of action of Artemia in enhancing utilisation of microdiet by gilthead seabream Sparus aurata larvae, Aquaculture, 155: 193-205. doi: 10.1016/S0044-8486(97)00117-8
Kurokawa, T., Shiraishi, M., Suzuki, T., (1998). Quantification of exogenous protease deri-ved from zooplankton in the intestine of Ja-panese sardine Sardinops melanotictus lar-vae, Aquaculture, 161: 491–499 doi: 10.1016/S0044-8486(97)00296-2
Langdon, C.J., (2000). Artificial microparticles for delivery of nutrients to marine suspen-sion- feeders, Global Aquaculture Advocate, 3: 40-41.
Lazo, J.P., Dinish,M.T., Holt, G.J., Faulk, C., Arnold, C.R., (2000). Co-feeding micropar-ticulate diets with algae: towards eliminating the need of zooplankton at first feding in larval red drum (Sciaenops ocellatus), Aqu-aculture, 188: 339-351. doi: 10.1016/S0044-8486(00)00339-2
Lopez-Alvarado, J., Kanazawa, A., (1994). Effect od dietary arginine levels on growth of red sea bream larvae fed diets supplemented with crystalline amino acids, Fisheries Sci-ence, 60(4): 435-439. Munilla-Moran, R., Starch, J.R., Barbout, A., (1990). The role of exogenous enzymes in digestion in cultured turbot larvae (Scopht-halmus maximus), Aquaculture, 88: 337–350. doi: 10.1016/0044-8486(90)90159-K
SPSS., (1993). SPSS for Windows Base System User’s Guide,release 8.0.2, Chicago, USA.
Tandler, A., Kolkovski, S., (1991). Rates of in-gestion and digestibility as limiting factors in the successful use of microdiets in Sparus aurata larval rearing. Larvi 91 Ghent, Bel-gium. EAS Special Publication, 15: 169-171.
Walford, J., Lim,T.M., Lam, T.J., (1991). Repla-cing live foods with microencapsulated diets in the rearing of seabass (Lates calcarifer) larvae: Do the larvae ingest and digest pro-tein membran microcapsules, Aquaculture, 92:225-235. doi: 10.1016/0044-8486(91)90024-2
Walford, J., Lam, T.J., (1993). Development of digestive tract and proteolytic enzyme acti-vity in seabass Lates calcarifer larvae and juveniles, Aquaculture, 109: 187-205. doi: 10.1016/0044-8486(93)90215-K
Yufera, M., Fernandez-Diaz, C., Pascual, E., (1995). Feeding rates of Gilthead seabream Sparus aurata larvae on microcapsules. Aquaculture, 134: 257-268. doi: 10.1016/0044-8486(95)00035-Z
Yufera, M., Sarasquete, M.C., Fernandez-Diaz, C., (1996). Testing protein-walled microcap-sules fort he rearing of first feeding gilthead seabream (Sparus aurata L.) larvae, Marine Freshwater Resource, 47: 211-216. doi: 10.1071/MF9960211
Yufera, M., Fernández-Díaz, C., Pascual, E., (2005). Food microparticles for larval fish prepared by internal gelation, Aquaculture, 245: 253-262. doi: 10.1016/j.aquaculture.2005.04.026
650