Key Words
Hepatitis virus, Immunization, HIV, Sexual Transmitted disease.
Las infecciones de transmisión sexual (ITS), antiguamente conocidas como Morbus Incidens, a finales del siglo XVI fueron llamadas por Jacques de Bitencourt enfermedades venéreas (de Veneris, genitivo latino del nombre Venus, la diosa romana del amor), Siboulei las califica como "Efectos colaterales del amor", y posteriormente se conocen como "Enfermedad social" y/o" Enfermedades de transmisión sexual " : Son un conjunto de infecciones agrupadas por tener en común la misma vía de transmisión: de persona a persona, a través de las relaciones sexuales por vía vaginal, oral, o anal, independientemente de que la etiología responde a diferentes agentes microbiológicos con diversidad de signos y síntomas clínicos y que muchos de estos gérmenes compartan otras vías de transmisión. Constituyen [1] un problema social que resulta entre otras condiciones de la explosión demográfica y cambios en la conducta sexual, lo cual afecta a todos los niveles socioeconómicos.
De la historia antigua nace, el mito de la diosa nacida de la espuma del mar: Venus. Mujer enamorada, que ha inspirado la creatividad del hombre durante miles de años. La mitología romana llamó Venus a su diosa del amor y la belleza, rebautizando a la Afrodita griega. La hizo hija de Júpiter (Zeus) y novia de Marte, dios de la guerra. Por ello, los escritores y poetas han encontrado en Venus la inspiración creadora para celebrar el amor. Venus, fue personificada signo de amor «impuro» y era la diosa patrona de las Prostitutas, motivo posible para que se le relacionara con las Infecciones de transmisión sexual, porque estaban relacionadas con el acto del amor y además por esa época estas infecciones prácticamente solo se veían en prostitutas (hoy trabajadoras del sexo). Sobre los años 1960, llamada época del amor libre, comienzan una serie de cambios en los patrones de conductas social y sexual, que condicionadas por, factores de riesgo reproductivos, económicos, políticos, culturales, biológicos y genéticos favorecen su desarrollo .En nuestros días se maneja el término de Infecciones de transmisión sexual, teniendo en cuenta que todas las infecciones no traducen obligatoriamente el estado corporal adverso de una enfermedad. Así tenemos que las ITS son aquellas que se transmiten a través de una relación sexual no protegida con una persona infectada.
Las Infecciones de Transmisión Sexual (ITS), desde su aparición y hasta la fecha se encuentran entre las causas más frecuentes de morbilidad a nivel mundial, incluso con notorio crecimiento en las últimas décadas y de forma alarmante en la adolescencia quienes son cada vez más sexualmente activos y con características biológicas y psicosociales más favorables para estas infecciones. La información recibida de diferentes países indica que la mayor proporción de casos de ITS ocurre en personas entre 15 y 49 años y que existe una mayor vulnerabilidad biológica y social en la mujer para contraer una ITS [1]. Estas infecciones constituyen una epidemia en la mayor parte de los países del mundo y en los últimos años se han descrito más de 50 síndromes clínicos diferentes relacionado con éstas. Las repercusiones a las que dan lugar no solo se limitan al hecho de que aumentan la morbimortalidad, la transmisión horizontal a la pareja ó la vertical a su descendencia, la disminución de la productividad y aumento de los costos, sino que además provocan daño en la salud reproductiva que se traduce en una infertilidad, oncogénesis y repercusiones adversas perineonatales [2].

Aún cuando de ellas se conocen lo necesario para no infectarse, no hemos logrado ni con mucho disminuir su incidencia y soñamos con el advenimiento de una droga que cure el SIDA o una vacuna con fines de inmunidad contra el VIH , pero nuestros sueños deben ser mucho más sólidos si tenemos en cuenta, que por ejemplo la Sífilis y la Blenorragia datan de las primeras infecciones de transmisión sexual que se conocieron en todo su esplendor ¨Clásicas¨ y de las que gozan conocerse su vía de transmisión ,etiología, cuadro clínico, diagnóstico y tratamiento, y aún no hemos sido capaces de disminuir su incidencia ,lejos de todo ello siguen estando dentro de las ITS más frecuentes en todo el mundo.
Nosotros queremos abordar las ITS por virus, un tema en el que la humanidad no ha encontrado mejor suerte, con un tono más dramático por su impacto social, económico y de salud, que generan complicaciones desbastadoras , en el que involucra ya no solo la enfermedad propiamente dicha , sino que tienen papel protagónico oncogénico conocido en procesos oncoproliferativo como: Neoplasia intraepitelial y Carcinoma cervical, Sarcoma de Kaposi, Carcinoma hepatocelular, Carcinoma escamoso del ano, vulva, vagina y pene, Leucemias , Linfomas y Carcinomas de la nasofaringe entre otros y además algunos de estos virus podrían ser utilizado como arma biológica. Tampoco podemos menospreciar que las infecciones por estos agentes son agudas [3], autolimitadas, recidivantes, persistentes, de progresión lenta, con clínica poco demostrativa e infecciones de tipo mixtas, su diagnóstico y tratamiento se dificulta, no responden a las generaciones de antibióticos con alto costo de los antivirales. Algunas son incurables y la prevención es el arma terapéutica más efectiva. [4-6].
En fechas recientes se han publicado como las ITS más frecuentes, las producidas por el virus del papiloma humano, el virus del herpes simple y los virus de la hepatitis A y B [6],así vemos que los virus llegaron prácticamente de postreros (tercera generación) y han terminado siendo los primeros, como dice el viejo refrán.
Características generales de los Virus [7,8]
Los virus son entidades propias ultramicroscópicas que portan un solo tipo de ácido nucléico (ADN o ARN), rodeado por una envoltura proteica que lo protege.
Son insensibles a los antibióticos que conocemos hasta nuestros días.
Son parásitos obligados intracelulares y la mayor parte de ellos pierden su infectividad a temperaturas de más de 50 °c por un período de 30 minutos.
Los virus pueden agruparse [7] según el tipo de ácido nucléico y atendiendo al tamaño, forma, y subestructura de la partícula vírica.
Sobre la base de sus propiedades físico química:
Virus con ADN
Parvovirus, papovavirus, adenovirus, herpesvirus y poxvirus.
Virus con ARN
Ornavirus, retrovirus, togavirus, reovirus, paramixovirus, ortomixuvirus, cornavirus.
Infecciones de transmisión sexual causadas por la familia Herpesviridae
Dentro de los Herpesviridae al menos tres se reconocen se transmiten a través de las relaciones sexuales: Virus del Herpes Simplex (Tipo 1 que puede encontrarse en el 10-50% de los casos de herpes genital y el tipo 2 responsable del 98% de los casos), Virus del Epstein Barr y Citomegalovirus y de ellos, el Herpes Simplex y el Citomegalovirus tienen consecuencias bien consistentes sobre el embarazo y el recién nacido, pues están incluidos dentro de los virus que causan el Síndrome de Infecciones TORCH. Los Herpesviridae no son Hepatotropos. De esta familia quedarían los virus del herpes 3, 6,7 y 8, que hasta la fecha su transmisión no es sexual, por lo que de ellos no hablaremos en esta revisión. [9]
Atendiendo a la familia y tipo de virus que se transmiten sexualmente, las entidades que producen son:
Virus del Herpes
Los herpes virus se caracterizan por tener una envoltura polihédrica y DNA lineal de doble cadena, atacan a los receptores de células del hospedero, entran a la célula por fusión de su envoltura con la membrana celular, son los virus de DNA de mayor prevalencia y son a menudos latentes, permaneciendo inactivos dentro de la células infectadas o reactivándose causando recurrencias de las manifestaciones de la enfermedad.
Hasta la fecha se han descubierto 8 miembros de la familia del virus del herpes humano: Virus herpes tipo alfa: VHS-1, VHS-2, Varicela – zóster (VHS-3); Virus herpes tipo gamma: VEB (VH-4); Virus herpes tipo beta: CMV (VH-5), VH-6, VH-7; VH-8.
VHS 1: responsable herpes Labial y presente en más del 10 % de los casos de Herpes Genital.
VHS 2: responsable del Herpes Genital.
VHS 3: Virus de la varicela-Zóster responsable de la Varicela y del Herpes Zóster, Culebrilla ó Cinturón de San Andrés.
VH-4:(virus del herpes tipo gamma VEB) responsable de la Mononucleosis Infecciosa y relacionado con Carcinoma nasofaríngeo, Linfoma de Burkitt y Síndrome de fatiga crónica.
VH-5: (CMV) responsable de la infección por Citomegalovirus y relacionado con el Síndrome de Mononucleosis Infecciosa.
VH-6: relacionado con el Exantema súbito habiéndose detectado en LCR de pacientes con meningitis o hepatitis (posibles complicaciones del exantema súbito) en pacientes sin exantema; aplasia medular; Neumonitis, y encefalopatía en pacientes con transplante de médula ósea; encefalopatía y retinitis en pacientes con SIDA. Asociado a Mononucleosis Infecciosa.
VH-7: relacionado al Exantema súbito, aunque con una probable menor transmisibilidad o potencial patogénico que el anterior.
VH-8: Asociado al sarcoma de Kaposi, tanto esporádico como asociado a infección por el VIH. También se ha asociado a linfomas en pacientes con SIDA.
Virus del Herpes Simplex Hominis
El nombre trepes deriva de una palabra griega que significa serpentear. Las "calenturas" ó "Fuego" (herpes febril) fueron descritas en la antigüedad. El hombre es el único huésped natural y su distribución es universal. El virus del herpes simplex fue el primer herpes Virus humano reconocido [9]. Se conocen dos tipos, el VHS tipo 1 o herpes Labial y el VHS tipo 2 herpes Genital, el que nos ocupa en el tema en revisión.
Hipócrates (460 ane): Describe lesiones genitales que pudieron estar en relación con el herpes simplex genital. (Desde 1700 se reconoce su transmisión sexual y hasta 1940 no se describe su origen viral, mientras que en 1960 se describen los dos tipos).
VHS
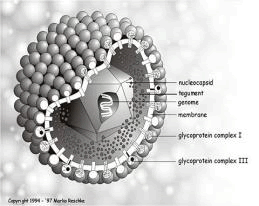
Desde el punto de vista clínico [7,9,10] es una afección aguda de una o más grupos de vesículas sobre una base eritematosa ubicada preferentemente en región genital o perigenital, se puede encontrar en sacro, glúteos y miembros inferiores, precedida o acompañada de sensación de quemazón o parestesias .En pacientes inmunodeprimida puede dar lugar a cuadros muchos más graves llegando a afectar vía hematógena pulmón, esófago e hígado. La alta incidencia de herpes virus y carcinoma de cérvix y la mayor frecuencia de anticuerpos para VHS II en pacientes con cáncer de cérvix ha sugerido el posible poder oncogénico del virus. Se ha descrito que la infección puede cursar asintomática en el 80% de los casos infectados. Dentro de la gama de síntomas [5] se describen fiebre, cefalea, malestar general, mialgias, ardor, dolor, presencia de vesículas cutaneomucosas, uretritis, cervicitis, faringitis y linfadenopatías
Clínicamente [7,9] es una afección aguda posterior a una relación sexual, de uno ó más grupos de vesículas sobre una base eritematosa, pudiendo llegar a ulcerarse ubicada preferentemente, en el hombre, en glande, prepucio y cuerpo del pene, en los homosexuales en ano y recto, mientras que en las mujeres se visualizan en genitales externo, mucosa de vulva, vagina y cérvix, vesículas, erosiones, ulceraciones, edemas de la vulva, labios y piel circundante.
A diferencia de la infección primaria las recurrencias presentan un cuadro clínico menos intenso, no conociéndose las causas de las reinfecciones, se invocan algunos factores desencadenantes como relaciones sexuales, infecciones, stress, uso de esteroides, menstruación(Herpes menstrual indiscreto de Fournier descrito en síndrome premenstrual. aparecía en el premenstruo , persistía hasta que terminaba la menstruación y desaparecía sin dejar huellas), cambios en la luz solar y cambios de estaciones. A partir de la inoculación epitelial [9], se extiende por los nervios sensitivos hacia los ganglios neuronales, donde permanece en una forma latente y entre el 60 y el 90% de los casos después de una infección primaria por el HSV ya sea del tipo 1 ó 2 desarrollan en los primeros 12 meses nuevos episodios por reactivación del virus, de ahí que se plantea que es una infección cíclica. Las lesiones de la reactivación están constituida por vesículas múltiples sobre piel o un área con ligero halo erimatoso claro, que después son oscuras, purulentas, posteriormente costrosas curando en un término de 10 días, la adenopatía regional casi siempre está presente. Desaparece espontáneamente entre 1-2 semanas. Suele recurrir (HVS 2 principalmente) con una frecuencia entre 3-8 veces al año y cuando la respuesta inmune celular está alterada las lesiones pueden ser prolongadas y atípicas. Puede presentarse como gingivoestomatitis herpética fundamentalmente en los menores de 5 años, también como queratitis herpética, panadizo herpético o comprometer cualquier zona de la piel con las características vesículas.
La infección perinatal [9,11] lo hace por vía trasplacentaria (5%) a lo que se le ha llamado infección congénita o en el momento del parto vaginal (90-95%) por vía ascendente con rotura de membranas o por el paso del niño por el canal del parto lo que se conoce como infección perinatal y generalmente es por VHS 2, motivo por el cual se preconiza el parto por cesárea. La infección perinatal se presenta entre los 7 y 20 días de vida con un cuadro clínico que puede ser variable como una enfermedad diseminada similar a la congénita ( 30 %), como encefalitis (35%) o como una infección localizada en piel, ojos o faringe (35%), que en general son de buen pronóstico. El compromiso ocular localizado puede conducir a cataratas y corioretinitis. Estas presentaciones se pueden superponer unas a otras en un mismo paciente.
Las mujeres embarazadas [9] presentan un 20-30 % de seropositividad para herpes 2 y un 0,5 a 4 % de las embarazadas presentan infección en el transcurso de la gestación, y de éstas la mayoría son reactivaciones y asintomáticas. Del total de mujeres durante la labor de parto, un 0,3 a 0,5 % excretan virus en la secreción cervical en forma asintomática. Durante el embarazo se puede presentar: aborto, parto pretérmino, retardo del crecimiento intrauterino. En el parto: Infección Neonatal (existen lesiones genitales activas por primoinfeccion o episodio de recurrencia).Las complicación Neonatal: Encefalitis Herpética que se presenta alrededor de las 3 semanas post nacimiento y se manifiesta con fiebre, vesículas cutáneas, neumonía, irritabilidad, hepatitis y cuagulopatías, alta frecuencia de secuelas neurológicas y produce mortalidad en el 50 % de los neonatos que la padecen.
El curso de la primoinfección se puede complicar con encefalitis, lo que es poco frecuente y de alta letalidad y se puede presentar en cualquier etapa de la vida. En pacientes inmunodeprimidos, la infección cobra importancia, dado que puede ser diseminada, grave y con riesgo de muerte.Se describen complicaciones como meningitis aséptica, meningitis de mollaret, radiculopatía sacra, mielitis transversa, además se ha relacionados con enfermedades como alzhéimer, esclerosis múltiples, neuralgias, y se relaciona con eczema herpético (Kaposi's varicellum eruption), Herpes ocular (perdida de la visión en el 6%) y enfermedad coronaria. Neumonías, hepatitis, esofagitis, encefalitis, insuficiencia suprarrenal, Ulceras graves en estomago, recto y colitis. Se reporta relación entre HSV 1 e infertilidad.
Las frecuentes lesiones genitales por episodios de recurrencia o primoinfeccion constituyen una puerta de entrada a otras infecciones sobre todo otras ITS como infecciones por virus inmunodeficiencia humana y virus de la hepatitis C.
Diagnóstico [2,11,12]
Se hace por los antecedentes, el cuadro clínico, y exámenes de laboratorio donde la detección del AG viral, serología, reacción en cadena de polimerasa, citodiagnóstico de Tzank (células gigantes multinucleadas con cuerpos de inclusión nucleares).
Citología: Células gigantes poli nucleadas (fusión de células epiteliales infectadas), degeneración en balón del núcleo, células con inclusiones nucleares aisladas, cromatina marginada.
Histologia: Vesículas dérmicas, Células gigantes, Inflamación de la dermis, Cuerpos de inclusión.
Colposcopia: Exploración de la piel, otras infecciones del tracto genital concomitantes.
ELISA-Western Blot detección y caracterización viral: Confirmación serológica de la presencia de anticuerpos (8-12 semanas).
Diagnóstico diferencial habría que planteárselo dentro de un compendio de infecciones que clínicamente se comportan con similitudes como Chancro por Sífilis, Chancro por Haemophilus Ducrey, Síndrome de Behcet, Síndrome de Reiter, Enfermedad de Crohn, Dermatitis de contacto, Eritema Multiforme, Liquen plano entre otras.
Tratamiento [2,8,10]
No tiene cura. Relaciones sexuales protegidas Fomentos de manzanilla, subacetato de aluminio, talcos secantes como oxido de zinc.
Analgésicos, vitamina C.
Aciclovir se recomiendan diferentes esquemas según la etapa de la infección.
200mg oral 5 veces al día por 7 a 10 días en la primo infección, mientras que en la recurrencias 200mg 5 veces al día por 5 días o 800mg orales dos veces al día por 5 días.
Algunos autores recomiendan para los pacientes que además tienen infección por VIH 400mg 5 veces al día por 10 días. Luego 3-4 veces al día por tiempo prolongado. El Aciclovir en crema tópico al 5 % también puede utilizarse.
Vanciclovir. Primo infección: 1000mg 2 veces al día por 5 días y durante las recurrencias 500mg dos veces al día por 5 días.
Fanciclovir 200mg oral tres veces al día por 7 a 10 días. En la recurrencia igual dosis por solo 5 días.
Alternativas de tratamiento. Se han descrito otros medicamentos para el tratamiento del herpes simple dentro de ellos se encuentran Vidarabina, interferon alfa, factor de transferencia, panciclovir crema, Crema de Yodoxuridina 2% y 10%, vacuna de la Poliomielitis y Terapia con láser entre otros.
Los interferones se han usado Vía sistémicas / IM: 10 MUI semanales Por 8 semanas y vía Vía tópica (gel): Una vez por día, mientras exista la lesión clínica (4 d) Por 8 semanas y en iguales dosis por esta vía se ha utilizado el imiquimot.
El Levamisol tabletas de 150mg vía oral se ha usado por 8 semanas en días alternos ó dos veces a la semana.
Las Vacunas Terapéuticas y Profilácticas aún no están a disposición para su uso, bajo estudio en diferentes fases.
Profilaxis [9]. Evitar el contacto directo con las lesiones herpéticas y las secreciones infectadas, los pacientes con lesiones extensas deben ser aislados. En gestantes con lesiones vesiculares por herpes genital 2 en trabajo de partos se debe concluir el parto con una operación cesárea. Así, también, en aquellas que tengan excreción del virus por secreción vaginal, aún siendo asintomáticas. Si han pasado más de 4 horas de membranas rotas, no se asegura que la cesárea evite la infección del neonato. El recién nacido infectado debe aislarse durante toda su enfermedad y así, también, el sospechoso de infección. No está indicada la separación del niño de su madre. El personal de salud con lesiones en mucosa bucal tiene bajo riesgo de transmisión a los pacientes y basta con cubrirlas y evitar el contacto directo.
Virus de Epstein-Barr (EBV)
Pertenece a la familia Herpesviridae. Fue el cuarto herpes virus descrito. Da lugar a la Mononucleosis Infecciosa ó Enfermedad del beso, es uno de los virus más frecuentes y ha sido asociado a varios tipos de tumores incluyendo el Carcinoma de Nasofaringe Indiferenciado (CNI), el Linfoma de Burkitt, enfermedad de Hodgkin y Linfomas de células B en pacientes con inmunodeficiencias. En los últimos años, se ha propuesto el virus de Epstein-Barr como el causante del Síndrome de Fatiga Crónica.
VEB

Son 2 virus íntimamente relacionados (EBV-1 y -2) no pueden ser distinguidos serológicamente, altamente distribuidos, B-Linfotrópicos, su transmisión es más frecuente vía salival, los viriones infectan inicialmente las células epiteliares de la faringe y las parótidas y vía sanguínea los linfocitos T. El virus, consiste en una cadena helicoidal de DNA doble encapsulada rodeada de una cápside icosaédrica de 164 cápsomeros, envuelto por una cubierta glicoproteica [12-14].
Agentes Asociados al Síndrome de Mononucleosis Infecciosa [10].
Virus del Epstein Barr (VEB)….80 – 90 % de los casos. Citomegalovirus (CMV)
Primoinfeccion VIH
Toxoplasma Gondii
Virus del Herpes Humano 6.
La Mononucleosis Infecciosa es un síndrome causado en el 90% de los casos por el Virus de Epstein– Barr, que se caracteriza por la tríada clásica: presencia de fiebre, faringitis y adenopatías linfáticas asociado a la presencia de linfocitosis atípica. La mononucleosis infecciosa es, por regla general, una enfermedad de jóvenes.
El virus es transmitido mediante saliva infectada [15], a menudo a partir de adultos asintomáticos y suele ocurrir cuando se besan. Con contactos menos íntimos, el contagio es menor. En algún caso se ha producido la transmisión del virus por transfusiones y transplantes de médula. Los estudios epidemiológicos indican que más del 90% de individuos asintomáticos seropositivos son portadores del virus en sus secreciones orales. Una característica particular del VEB es su asociación con procesos neoplásicos. Los principales focos de infección son las mucosas de boca, ojos, vías respiratorias, genitales y ano. El contagio se produce sobre todo por contacto sexual, también se dan caso de transmisión materno-fetal, la transfusión sanguínea y contacto con semen.El periodo de incubación (sin síntomas) suele durar entre 7 y 14 días.
Cuadro Clínico.
La tríada clásica [7,10,13]:
Fiebre (93%), que puede ser persistente: 10-14 días.
Faringitis (82%), faringe eritematosa con exudado puntáceo, gris y muy dolorosa, es el síntoma más frecuente de consulta.
Adenopatías [14-16] (95%) cervicales posteriores, occipitales (más frecuentes), retroauriculares de características inflamatorias dolorosas a la presión y no adheridas.Fatiga, pérdida del apetito, astenia, dolores musculares, y la hepatoesplenomegalia.De forma variable en cada persona aparecen náuseas, vómitos, dolor abdominal, exantema, color amarillo en la piel, dolor de cabeza, ojos llorosos, dificultad para respirar, edema periorbitario, enantema palatino, palpitaciones y, a veces, un exantema en la piel, generalmente en brazos y tórax, especialmente si el cuadro se trata con penicilina (aunque el exantema no está relacionado generalmente con alergia a penicilina). El 10% de las Mononucleosis infecciosa son VEB negativas, producidas por Citomegalovirus, VIH, toxoplasmosis, herpes virus tipo 6 principalmente. La rotura esplénica se sospechará frente a dolor en hipocondrio izquierdo, masa palpable en hipocondrio izquierdo, omalgia izquierda que aumenta en la inspiración (signo de kher), elevación leve de las transaminasas.
Complicaciones [10,13,14]: Por lo general la enfermedad tiene un curso benigno pero en algunos casos pueden presentarse complicaciones como anemia hemolítica, trombocitopenia, granulocitopenia, rotura esplénica, hepatitis, síndrome de Reye, necrosis hepática, encefalitis, meningitis, neuritis, mielitis transversa, síndrome de Guillain Barré, parálisis de nervios periféricos, neuritis óptica, psicosis, pericarditis, miocarditis, obstrucción de vías respiratoria, neumonía, derrame pleural, glomerulonefritis, nefritis intersticial,rash inducido por penicilinas, eritema nudoso, eritema multiforme, Vasculitis, nefritis intersticial, síndrome de Astenia crónico.[17]
Diagnóstico [13,14]
En la mayoría de los casos de Mononucleosis infecciosa, el diagnóstico es clínico puede hacerse de la tríada característica de fiebre, faringitis, linfadenopatías de 1 a 4 semanas de duración [7,8].Leucocitosis importante (12.000-18.000 leucocitos por mm3) entre las 2-4 semanas de infección. Del 30 al 90% de los linfocitos son "atípicos" [7] (≥10% criterios de Hoagland). Estos linfocitos son mayores de lo normal, con características propias grandes con citoplasma abundante. No son específicos de la Mononucleosis infecciosa (pueden aparecer en hepatitis, primoinfeccion VIH, toxoplasmosis) [15,18,19]. La función hepática es anormal en el 90% de los casos sobre todo la transaminasa y la fosfatasa alcalina, la bilirrubina en un 40 % de los casos puede estar elevada.
Detección de Anticuerpos heterófilos (Prueba de Paul Bunnel), es la prueba serológica más específica y sensible para el diagnóstico de la infección por virus del Epstein Barr. Los anticuerpos heterófilos son anticuerpos IgM que no se unen a las proteínas del virus Epstein-Barr y aparecen a las dos semanas de la infección y persisten hasta 8-12 semanas, o incluso un año.
Hay varios Antígenos del VEB que se pueden detectar:
Anticuerpos frente antígenos de la cápside viral (VCA). Sugestivos de infección aguda. Anticuerpos frente a Antígenos precoces. Aparecen sólo durante el periodo de enfermedad. EBNA (Epstein-Barr nuclear antigens). Son anticuerpos que persistirán de por vida.
Entidades Asociadas al Virus de Epstein Barr :Esclerosis múltiple, Síndrome de Stevens Johnson, Hepatitis, Herpes ,Mononucleosis Infecciosa, Síndrome de Alicia en el País de las Maravillas o Micropsia, Linfoma NO-Hodgkin, Enfermedad de Hodgkin, Alteraciones linfoproliferativas Post trasplante. El diagnóstico diferencial debe realizarse con Toxoplasmosis, Herpes virus humanos, Citomegalovirus, primoinfección por VIH, adenovirus, rubéola, virus de la hepatitis, brucelosis, virus de la parotiditis, fármacos (Carbamazepina y Fenitoína).
Tratamiento [10,15,17]
Relaciones Sexuales protegidas
No existe un tratamiento específico para la Mononucleosis infecciosa, que no sea el tratamiento de los síntomas, No existe fármacos antivirales o vacunas disponibles.
Reposo en cama al principio y luego mantenerse en casa relajado por lo menos 2 ó 3 semanas.
Aumento de la ingestión de líquidos, que es primordial por la fiebre. Se recomienda también ibuprofeno, aspirina o paracetamol para la fiebre y gárgaras con agua salada para las molestias de garganta. Cuando se compruebe una amigdalitis por estreptococo asociada, se añade antibiótico. Si aparece dolor agudo intenso en la parte superior izquierda del abdomen, debe descartarse una posible rotura de bazo. Si esto se confirma, el paciente debe realizarse esplenectomía. Están en fase experimental vacunas frente al VEB. Para el tratamiento de las formas graves se ha utilizado el Ganciclovir con resultados variables. Algunos autores señalan el uso de Corticoesteroides indicados en caso de complicaciones: obstrucción de vías aéreas, anemia hemolítica, trombocitopenia severa o afectación miocárdica o neurológica.
Virus de Inclusión Citomegálica (VIC)
Es una forma de Herpes Virus, en humanos es conocido como Human herpesvirus 5 (HHV-5). Pertenece a la subfamilia Betaherpesviridae de la familia Herpesviridae. Su nombre significa "virus muy grande". Es parásito exclusivo del humano y produce la infección por Citomegalovirus.
VIC
Conjuntamente con el virus de Epstein Barr [4] es la principal causa de la Mononucleosis Infecciosa. Se conoce un solo serotipo, pero varía en el ADN de cepa a cepa. La infección celular produce un efecto citopatológico [9], [16] caracterizado por inclusión basófila rodeada por un halo claro en el interior del núcleo celular lo que se ha denominado "ojo de lechuza ó búho" y se observa una inclusión eosinofílica citoplasmática que generalmente se ubica en la región paranuclear. Su material genético es el ADN, el que incorpora al genoma de de la célula huésped, lo que determina la posibilidad de latencia del virus.
Vías de Transmisión. [9,18,19]
Sexual. Por relaciones sexuales.
Vertical: Puede presentarse infección intrauterina por vía trasplacentaria, en el momento del parto (connatal) por vía genital, ya que un 15 – 30 % de las mujeres embarazadas excretan CMV por orina o por secreción cervicouterina. En el período de recién nacido (neonatal) puede transmitirse el virus por lactancia materna. Del total de mujeres seronegativas que se embarazan, un 3 - 5% adquieren la infección durante éste. En las mujeres seropositivas a CMV, la infección se reactiva en un 10% durante el embarazo. Si la mujer adquiere la primoinfección durante el embarazo, el riesgo de infectar al feto es de un 50%, lo que disminuye bastante (1-10%) si se trata de una reinfección o reactivación viral y se cree que la protección fetal, en estos casos, estaría dada por la existencia previa de anticuerpos maternos los que serían transmitidos al feto durante la gestación.
Post natal: Dado por el contacto con saliva, orina, transfusiones de sangre y hemoderivados, por diálisis, circulación extracorpórea, trasplantes de órganos, leche humana.
El CMV infeccioso puede aparecer en los fluidos de una persona infectada, y puede ser encontrado en la orina, saliva, sangre, lágrimas, semen , secreciones cervicales y leche materna. Puede transmitirse a receptores de transplantes de órganos o médula ósea y a pacientes que reciben transfusiones sanguíneas de un donador con antecendentes de infección por CMV o con una infección activa [9].
En personas con un sistema inmune débil, como pacientes infectados por el VIH, receptores de transplantes de órganos o médula ósea, pacientes recibiendo quimioterapia o radiación, y personas en tratamiento con esteroides, los signos y síntomas de la infección por CMV pueden ser serios. Signos y síntomas pueden ocurrir cuando una infección anterior se reactiva o cuando la persona adquiere el virus por primera vez [9]. La infección por CMV en personas con un sistema inmune debilitado puede causar neumonía, retinitis, hepatitis, esofagitis y colitis, meningoencefalitis, e incluso la muerte. Signos y síntomas que se observan al nacimiento incluyen: cabeza de tamaño pequeño (microcefalia), cuerpo pequeño, pequeñas manchas rojas en la piel (petequias), hígado agrandado (hepatomegalia), agrandamiento del bazo (esplenomegalia), coloración amarilla de la piel y los ojos (ictericia), cuenta sanguínea baja (anemia y/o tromobcitopenia), neumonía, convulsiones, tono muscular anormal, depósitos de calcio en el cerebro (calcificaciones intracraniales), pérdida de la visión, y pérdida auditiva. Aunque algunas de estas anormalidades pueden resolverse, muchos niños tendrán incapacidades de diversos grados por el resto de su vida. Incapacidades que pueden asociarse con la enfermedad congénita por el CMV incluyen sordera, ceguera, deficiencias físicas y motoras, convulsiones, anormalidades del desarrollo y retraso del aprendizaje.
El estado inmunitario y la edad del paciente determinan la severidad del cuadro clínico y sus complicaciones [9]. Primo infección en el niño mayor o adulto: Solo un 5% de los casos son sintomáticos. Se presenta como un síndrome de mononucleosis, pero se diferencia del producido por el virus Ebstein- Barr por presentar un cuadro febril más prolongado de 3 a 6 semanas, faringitis no exudativa y un hemograma no característico. Tanto los pacientes asintomáticos como los sintomáticos pueden excretar el virus por secreciones corporales u orina por meses siendo infectantes y diseminando la enfermedad ampliamente. La presentación sintomática es más frecuente y severa en los pacientes con inmunodepresión primaria o secundaria, neoplasias, transplantes de órganos, desnutridos, operados con circulación extracorpórea y receptores de transfusiones masivas o frecuentes.
Infección intrauterina: Es la infección viral fetal más frecuente (1-2% de los recién nacidos vivos). Se produce una viremia materna que infecta la placenta y al feto. Este cuadro se caracteriza por RCIU, hepatoesplenomegalia, hepatitis, ictericia de predominio directo, síndrome purpúreo, anemia hemolítica, microcefalia, calcificaciones cerebrales periventriculares, coriorretinitis. Un 10 % de los niños infectados pueden ser asintomáticos en el período neonatal y manifestar sólo las secuelas neurológicas en forma tardía como retardo mental, ceguera y sordera. Infección connatal y neonatal: La infección del recién nacido se produce por contacto con secreción vaginal en el momento del parto o después de él, al alimentarse con leche materna contaminada o tomar contacto con orina con CMV de otro neonato.
En líneas generales se puede decir que el síndrome Torch se puede expresar de las siguientes formas [9]
1. Reabsorción embrionaria
2. Aborto
3. Infección placentaria con infección fetal
4. Retardo del crecimiento intrauterino con infección fetal
5. Parto prematuro con infección fetal
6. Mortinato
7. Recién nacido infectado sintomático
8. Recién nacido infectado asintomático
Diagnóstico [15,16,19],
El diagnóstico se basa en la clínica, el aislamiento del virus y en las pruebas serológicas que orientan a su presencia.
El diagnóstico virológico se realiza por aislamiento del CMV en cultivo celular de orina, saliva, secreción nasofaríngea, leucocitos etc. Estas pruebas son positivas en el paciente con primoinfección tanto congénita como adquirida, en la reactivación y no diferencia entre infección y enfermedad.
En la primoinfección adquirida, el diagnóstico por serología se realiza por detección de la IgM específica, la que se mantiene positiva por 2 a 3 meses. La IgG específica vira de negativa a positiva y ésta va aumentando sus títulos en el tiempo, sin embargo esto no es diferente para primoinfección o reactivación. En el embarazo una muestra de líquido amniótico y realizando aislamiento viral en cultivo celular con una sensibilidad del 80%, el procedimiento por los riesgos que provoca es cuestionado. Otro examen que se puede realizar es la detección del ADN viral en líquido amniótico o sangre fetal con técnica de reacción en cadena de la polimerasa (PCR), pero para la obtención de la muestra se necesita métodos invasivos con riesgo fetal.
La ecografía seriada que demuestren retardo del crecimiento intrauterino, microcefalia, ventriculomegalia, hidrocefalia, calcificaciones cerebrales, oligoamnios, polihidroamnios, hidrops fetal no inmune, ascitis fetal, derrame pleural o pericárdico, calcificaciones intrahepaticas o íleo pseudomeconial. En la infección transplacentaria, el virus se replica en la placenta y permanece en ella, de tal manera que una biopsia placentaria después del alumbramiento, permitirá confirmar el diagnóstico.
El CMV tiene un período de incubación de 3 - 12 semanas y por este motivo en el neonato con infección congénita los cultivos en orina son positivos durante las primeras dos semanas de vida y en sangre el CMV se puede aislar por largo tiempo. Debe tomarse muestra de líquido cefalorraquídeo para hacer aislamiento viral y detección de ADN del virus por PCR. Se debe estudiar, además, los cambios del líquido cefalorraquídeo con relación al contenido de proteínas y leucocitos. Todo esto nos llevará al diagnóstico de severidad del compromiso del SNC lo que estará en directa relación con el pronóstico. La técnica de cultivo viral tradicional demora 10 días, sin embargo, existe la técnica de shell vial (centrifugación y tinción de cuerpos monoclonales) con resultados en un día con sensibilidad y especificidad cercana al 100%.
La biopsia hepática o pulmonar positiva para CMV es diagnostico de certeza de enfermedad, pero es un método muy invasivo y en la práctica sólo se realiza si debe hacerse alguna intervención quirúrgica o en la autopsia. El diagnóstico serológico se realiza por la IgM específica en sangre. En el recién nacido si es positiva en la primera semana de vida es indicativa de infección congénita, esta IgM se mantiene positiva por 3 a 6 meses. La IgG se mantiene positiva durante toda la vida, pero no confiere inmunidad.
Marcadores Virales
Test de laboratorio (Perfil de Torch para IgG e IgM) para detectar los anticuerpos del CMV y además, el virus puede ser cultivado a partir de la orina, muestras de tejido, etc. para detectar las infecciones activas. Se pueden hacer test cualitativos y cuantitativos, permitiendo a los médicos monitorizar la carga viral de los pacientes infectados por CMV. Se debe sospechar una infección por CMV si el paciente: Tiene síntomas de mononucleosis pero da negativo en los virus de mononucleosis y Epstein Barr .Muestra signos de hepatitis, pero da negativo en los virus de hepatitis A, B y C.
Tratamiento [2,6,13]
Relaciones Sexuales protegidas.
No hay ninguna vacuna disponible contra el CMV. Se están realizando investigaciones evaluando la seguridad y efectividad de diferentes vacunas experimentales contra el CMV.Actualmente tratamiento con Ganciclovir IV (Cymevene) es usado en pacientes inmunodeprimidos. Tras este pasarán a la toma vía oral de Valganciclovir (Valcyte). El Velaciclovir (Valtrex) es otro antiviral administrado por vía oral que también es efectivo. Foscarnet puede ser administrado a pacientes con CMV resistente al Ganciclovir. Existe otro fármaco utilizado en el tratamiento contra el Citomegalovirus, sobre todo cuando el número de copias es muy alto y la afectación del hígado también, que es el cidofovir resultando bastante nefrotóxico (por ello previamente habrá que valorar el estado renal y suministrarlo siempre acompañado de probenecib).
El pronóstico va a depender de la edad del paciente y de su inmunocompetencia. En los pacientes infectados intrauterinamente el pronóstico dependerá del grado de compromiso neurológico. Constituyen la primera causa de retardo mental de origen prenatal y puede asociarse a ceguera, sordera, epilepsia y alteraciones neuromusculares que ensombrecen el pronóstico. En los pacientes inmucomprometidos esta infección puede ser fatal o producir secuelas pulmonares invariantes.
Prevención
En las unidades neonatales debe evitarse el uso de transfusiones de hemoderivados de dadores seropositivos. En poblaciones donde la prevalencia de la infección es alta debe preservarse la sangre en glicerol que elimina las células infectadas y luego desglicerolizarla o usar sangre sin leucocitos o congelarla previamente con lo que se logra la lisis de los leucocitos infectados e inactivación del virus. El recién nacido infectado con CMV debe hospitalizarse con técnicas de aislamiento universales, sólo requiriendo un buen manejo de secreciones y lavado de manos para evitar la diseminación de la infección.
Virus de la Hepatitis A- B- C- D.
Ahora entraremos a la revisión de un tema escalabroso, pues éstos agentes no solo se limitan al hecho de una simple infección, sino que se ha comprobado pueden evolucionar hacia una forma fulminante ó hacia un proceso oncoproliferativo hepático. Pero además a nuestro criterio propio el personal médico debía concientizar que las mayorías de las hepatitis son ITS y pensar más en las hepatopatías secundarias a virus de transmisión sexual ya sean estos virus Hepatotropos ó no. Las hepatitis son varias enfermedades clínicamente similares, pero de etiología y epidemiologia diferentes.
Hepatitis
Se han descrito varios tipos de virus de la hepatitis: A; B; C; D; E; G; GB Y F [20].De ellos los virus A, B, C y D son de transmisión sexual y los 3 primeros son Hepatotropos. Los más importantes son los virus A, B, C y, en menor medida, el D y el E, siendo los virus, G, GB, F los últimos descritos y los menos estudiados. El virus de la hepatitis E, no parece causar la enfermedad seria. Un informe publicado en 2001 sugiere que la infección por HGV pueda retrasar la progresión de la enfermedad de VIH.
Varios conceptos al respecto tratan de unificar característica de hepatitis secundaria a Virus de transmisión sexual, nos gustó esta definición para el tema en revisión: Proceso inflamatorio agudo hepático, carácterizado por necrosis de los hepatocitos, causado por virus Hepatotropos. Puede dar manifestaciones clínicas, como también alteraciones bioquímicas e inmunológicas. Evoluciona habitualmente a la mejoría, pudiendo en algunas circunstancias pasar a la cronicidad, hepatitis fulminante o Hepatoma. También pueden producir hepatitis otros virus no Hepatotropos de transmisión sexual como Epstein- Barr y Citomegalovirus.
Vías de Transmisión. [20-22]
Vía Fecal-oral: Los virus A y E se trasmiten vía fecal-oral, siendo el principal vehículo de trasmisión el agua y los alimentos contaminados. Ésta forma de trasmisión explica su mayor prevalencia e incidencia en individuos residentes en zonas con deficientes sistemas sanitarios.
Vía Parenteral: Esta vía incluye sangre y sus derivados transfusiones), hemodiálisis, transplantes. Incluye además jeringas (drogadicción) y/o instrumentos punzantes (tatuajes, piercings).Esta es la forma de trasmisión para los virus B y C.
Sexual: Trasmisión por secreciones biológicas, principalmente genitales y semen, motivo por el cual se considera una infección de trasmisión sexual (heterosexual y Homosexualidad en los casos que se practica el sexo oral - anal y anal-digital).
Transmisión vertical in útero: Ocurre durante el parto por shunt de la sangre Materna fetal, o directa a las secreciones vaginales. En el Post Parto, por la lactancia materna a través de lesiones sangrantes en las mamas. Trasmitida de la madre al recién nacido vía trasplacentaria. Corresponde al virus B. Discutible para el virus C. [23]
Algunas características de los virus de la hepatitis de transmisión sexual. [23-26]
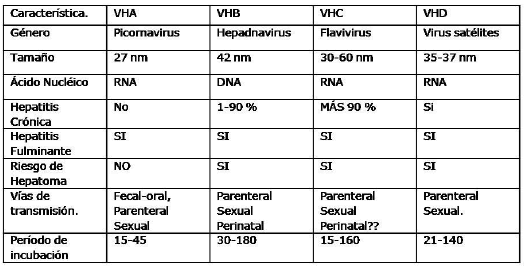
Virus de la hepatitis A (VHA).
Virus de la hepatitis A: causada por el virus de la hepatitis A, antiguamente conocida como Hepatitis Infecciosa. La hepatitis A, es una de las infecciones más ampliamente difundidas en el mundo. Genera alrededor de 10 millones de casos anualmente, con implicación económica, social con incapacidad laboral prolongada.
VHA

Conocida como hepatitis epidémica .Mc Donald [15] fue el primero en sospechar su etiología viral, en 1947 Mac Callun propone el término de hepatitis A, y no hasta 1973 Feinstone y Colaboradores logran aislar las partículas virales del virus de la hepatitis A en heces.
HAV: Virus RNA, es esférico, pequeño, con un diámetro de 27 nm, de la familia picorna virus, género hepatovirus. El VHA es estable en medio ácido, resistente a diferentes sustancias químicas y al calor debido a que es estable a 60 grados Celsius. Su replicación sólo ocurre en el citoplasma de los hepatocitos. Durante mucho tiempo no se consideraba una enfermedad de trasmisión sexual, hoy existen pruebas inequívocas de que se transmite a través de las relaciones sexuales, aunque no sea ésta, la principal vía de trasmisión, variados estudios reportan una mayor incidencia en personas que practican sexo no seguro, no protegido con múltiples parejas sexuales y homosexuales.[25]
Grupos de riesgo: Familiares o contactos sexuales de personas infectadas, empleados y niños en centros de cuidados, particularmente niños lactantes, viajeros hacia áreas endémicas, residentes y trabajadores de prisiones o instituciones de incapacitados cuando hayan ocurrido brotes, manipuladores de alimentos infectados, drogadictos intravenosos, personas que hayan ingerido alimentos o agua contaminados con el virus de la Hepatitis A.
Desde el punto de vista epidemiológico Gust en 1993 reportó en su trabajo los patrones epidemiológicos de la hepatitis por virus A en diferentes partes del mundo [27]. Así lo divide en tres tipos diferentes de comportamiento:
1. Aquel característico de regiones endémicas donde aproximadamente el 90% de la población mayor de diez años es inmune.
2. Países en vías de desarrollo, generalmente toda la población adolescente y adulta joven son inmunes entre un 80% a 85%.
3. Típica de países desarrollados, los anticuerpos protectores predominan en la población adulta en más del 70%.
Susceptibilidad: los anticuerpos adquiridos por la exposición al virus confieren inmunidad de por vida.
Virus de la hepatitis B (VHB)
La hepatitis B, enfermedad grave causada por el virus de hepatitis B (VHB), antiguamente conocida como Hepatitis Serosa ó sérica, puede causar una infección para toda la vida, cirrosis hepática, cáncer del hígado, falla hepática y muerte. Mundialmente, la Hepatitis B es la principal causa de Hepatitis aguda y crónica, cirrosis hepática y carcinoma primario Hepatocelular. Las consecuencias más serias ocurren en personas con infección crónica. Después del tabaco, el virus de la Hepatitis B es el carcinógeno humano más importante a nivel mundial.
Virus B [4,21]. Virus DNA, de 42 nm de la familia hepadnavirus, manifiestan un marcado tropismo hepático. Conformado por Ag HBs (cubierta externa), Ag HBc (nucleocapside central) y Ag Hbe (marcador de replicación e infectividad). Son los únicos virus, aparte de los retrovirus, que incluyen en su ciclo de replicación la actividad de una enzima transcriptasa inversa, capaz de sintetizar una molécula de ADN a partir de un templado de ARN. La polimerasa codificada por el gene P de los hepadnavirus, es una enzima que manifiesta cuatro actividades diferentes: ADN polimerasa dependiente de ADN; ADN polimerasa dependiente de ARN (transcriptasa inversa); Ribonucleasa H, capaz de degradar el ARN presente en moléculas híbridas ADN-ARN; actividad como molécula anda para la iniciación de la síntesis de ADN. No son virus directamente citopático, el daño hepático, que se manifiesta como inflamación hepática y destrucción de los hepatocitos, es causado por la propia respuesta inmune dirigida contra las células infectadas por el HBV; en particular, los linfocitos T citotóxicos anti-HBV parecen ser los principales responsables de la destrucción de los hepatocitos que expresan antígenos (proteínas) de HBV en sus membranas.
Sus partículas víricas son [4,21,24].
HBsAg o Antígeno de Superficie del HBV, que es una proteína de envoltura que se expresa en la superficie del virión. Es producto del gen S, que puede tener varios genotipos.
HBcAg o Antígeno Central del HBV. Se expresa en la superficie de la nucleocápside y es codificado por el gen C en su región central. No lo encontramos en suero porque carece de péptido señalizador para hacerse soluble.
HBaAg o Antígeno E del HBV, que es una proteína soluble de la nucleocápside. Es también producto del gen C, pero esta vez es codificado desde su región pre central. El gen es el mismo que en el HBcAg pero la región en la que se inicia la transcripción es distinta, ya que el gen posee dos codones de iniciación. Dependiendo de por cual se empiece se producirá una u otra proteína. El HBeAg puede encontrarse en suero porque tras su síntesis se asocia a un péptido señalizador que lo fija al retículo endoplásmico liso. E primer marcador que se encuentra en suero es el HBsAg, elevándose antes de que la infección tenga expresión clínica y disminuye y desaparece al cabo de 2 meses de la aparición de la ictericia, al tiempo que aumenta el anticuerpo contra el antígeno S (anti-HBs), que persiste indefinidamente y protege frente a la reinfección por el HBV.
Durante el intervalo en el que HBsAg está disminuyendo y el anti-HBs está aumentando, puede que las serologías den negativas por no alcanzar los umbrales necesarios para la detección, lo que conocemos como “ventana ciega”, los falsos negativos se descartarán con la detección en suero del anticuerpo contra el HBcAg (anti-HBc), que se eleva tras 1 o 2 semanas desde la aparición de HBsAg. Para determinar si la infección es reciente o antigua se debe determinar el tipo de Ig del anticuerpo, siendo una infección antigua la que los presenta de tipo IgG y reciente si se trata de IgM. La capacidad del paciente de dar una respuesta a la infección es la que produce el daño sobre el hígado. Hay personas que no se defienden bien del virus, no producen niveles efectivos de anticuerpos y mantienen los antígenos S como positivos durante mucho tiempo con transaminasas normales y casi sin sintomatología. Si albergan virus completos y no sólo HBsAg, estos individuos son portadores asintomáticos capaces de contagiar la infección a otra persona.
La hepatitis B representa uno de los mayores problemas de salud a nivel mundial, tanto por su magnitud (más de 300 millones de infectados), como por su trascendencia. Aproximadamente el 90% de las hepatitis B agudas son clínicamente silentes, particularmente cuando la infección es adquirida en etapas tempranas de la vida. La probabilidad de progresión a la cronicidad depende de la edad del paciente, del sexo y del estado inmunológico del individuo infectado, menos de un 5% de las Hepatitis Agudas por virus B llegan a hepatitis crónicas.
Grupos de riesgo para Hepatitis B: Drogadictos intravenosos, homosexuales activos masculinos, trabajadores de la salud, heterosexuales activos, niños nacidos de madres HBsAg positivas, poblaciones especiales de áreas con altas tasas de infección.
El Síndrome [26] Gianotti-Crosti, también denominado acrodermatitis popular de la infancia es un exantema asociado a la infección por virus hepatitis B (HBV). Este virus tiene la capacidad de persistir en forma crónica en el 10% de los adultos infectados y en el 90% de los recién nacidos infectados vía vertical. Puede originar hepatitis aguda, crónica, cirrosis y carcinoma hepatocelular primario. Las manifestaciones extra hepáticas de la infección aguda de HBV serían el resultado del depósito de complejos inmunes Ag-Ac. Este síndrome se caracteriza por un eritema maculopapular de 3 a 5 mm de diámetro, de distribución simétrica en cara, glúteos y extremidades, en asociación con una hepatitis anictéria y linfadenopatías generalizada y su duración es de 15 a 25 días. Se piensa que las manifestaciones cutáneas serían mediadas por la formación de inmunocomplejos. También se ha asociado con infecciones por virus hepatitis A, EBV, CMV, Coxsackie A16 y otros. El VHB puede ser la causa del 80% de los casos de carcinoma hepatocelular [28] en todo el mundo, y ocupa el segundo lugar, después del tabaco, entre los carcinógenos humanos identificados. La infección perinatal tiene gran posibilidad de producir antigenemia crónica, que culmine en hepatitis crónica, cirrosis o carcinoma hepatocelular primario. Infecciones virales y exantemas no tradicionales [26]
En el tratamiento de la infección crónica en niños se puede utilizar interferón alfa. Existen vacunas recombinantes muy seguras y eficaces que se utilizan en la prevención de la infección crónica congénita. La inmunoglobulina hiperinmune (HBIG) se administra en los contactos expuestos a la infección por HBV. En las manifestaciones extra hepáticas graves se utilizan Corticoesteroides.
Tratamiento específico; Ninguno. No están indicados en la hepatitis B aguda o crónica los antiflamatorios como los esteroides. Están en marcha estudios de diversos agentes antivíricos, y las investigaciones con casos y testigos han señalado que el arabinosido de adenina no es útil. Solamente el interferón alfa, producido por técnicas de ingeniería genética, ha demostrado tener un efecto positivo, aunque no es curativo. Las vacunas aprobadas en diversas zonas del mundo, pueden tener dosis y esquemas de administración variables
En Cuba la Vacunación (1992) se redujo la enfermedad aguda en él:
50 % adultos
96,7% niños menores de 15 años
92,6% de los hijos de madres seropositivas
Virus de la hepatitis C (HCV)
Hepatitis aguda curación espontánea en un 10 – 15%, o infección persistente 85-90% de los casos. Infección sin afectación histológica o leve y sin progresión (25%) ó Cirrosis (20-30% en20 a 30 años) y esta última puede evolucionar a Carcinoma hepatocelular (15%) incidencia anual de 1-5%. [29]
La hepatitis C es una infección viral del hígado ocasionada por el virus de la hepatitis C (HCV). Es una enfermedad del hígado lentamente progresiva, usualmente sin síntomas, que puede tardar de 20 a 30 años en ocasionar daño serio al hígado. Más o menos tres cuartos de las personas infectadas con este virus desarrollan hepatitis crónica. El HCV se ha convertido en la causa principal de enfermedad hepática que ocasiona cirrosis y cáncer hepático, y es ahora la indicación más frecuente para transplante de hígado. Existen 6 tipos (cepas) principales de hepatitis C, a los cuales se les llama genotipos (basándose en las secuencias de ADN)
Patrones de Transmisión [29]
Drogas VP 70-90%
Sangre, hemoderivados 82%
Tatuajes, piercings 41%
Hemodiálisis 10%
Ocupacional 0.7-1.7%
Vertical 5%
Sexual 1- 7 %
Desde hace más de una década se han descrito que las poliartralgias y poliartritis son frecuentes en los pacientes infectados con virus de hepatitis C. Las poliartralgias pueden ocurrir durante el estado agudo de la infección y resolverse a pesar de la persistencia del RNA del HVC circulante. La Artritis Reumatoide clásica ha sido reportada en asociación con HVC. La alta frecuencia de factor reumatoideo positivo en pacientes infectados con HVC, puede hacer difícil la distinción entre AR y poliartritis de pacientes con HVC. Además, la artropatía de los pacientes con HVC puede ser o no erosiva [30-32].
Grupos de riesgo para hepatitis C: Drogadictos intravenosos, personas con exposición ocupacional a la sangre, pacientes hemodializados, pacientes transfundidos, promiscuidad sexual antecedentes de ITS.
El comienzo suele ser insidioso, con anorexia, molestias abdominales vagas, náuseas y vómito, que evolucionan a la ictericia con menor frecuencia que la hepatitis B. La gravedad oscila desde casos no manifiestos clínicamente hasta casos fulminantes y mortales. Por lo regular es menos grave en la etapa aguda, aunque la cronicidad es común y es mucho más frecuente que en la Hepatitis B en los adultos. La infección crónica puede ser sintomática o asintomática.
Virus de la hepatitis D (HDV) ó Agente Delta
Es un virus defectuoso que necesita el virus de Hepatitis B para existir. Descubierto por Rizzeto en 1977, pero su caracterización fue posible hasta 1986 gracias a la biología molecular, se encuentra en la sangre de las personas infectadas con el virus. El agente productor de este proceso requiere de la membrana fabricada por el VHB, por lo que se asocia a esta. El genoma del agente delta consta de 1678 nucleótidos que forman una cadena de ARN circular. Se presenta principalmente entre los adictos a drogas intravenosas. Es un virus de RNA de polaridad negativa con cápside icosaedrica, y envoltura que corresponde a la envoltura del Virus de la Hepatitis B por lo necesita de la presencia del HBV para multiplicarse y expresarse. Si HBV es negativo, HDV será también negativo. Por el contrario, si HBV resulta positivo, puede o no haber infección por HDV. Al depender por completo del HBV la duración de la infección por el virus D está completamente determinada por la del virus B, no pudiendo sobrepasarla. Generan un modelo de Superinfeccion del HVB, ya que aumentan la severidad del cuadro y el porcentaje de evolución a la cronicidad. [20,23].
Pueden darse dos tipos de infección junto al HBV:
-Coinfección: si tanto los marcadores del HBV como los anticuerpos anti-HDV son positivos y de fase aguda, es decir, anticuerpos de tipo IgM para cada uno de los virus.
-Sobre infección: si los marcadores del HBV son positivos pero con anticuerpos de tipo IgG y los anticuerpos contra el HDV son positivos y de tipo IgM.
El comienzo suele ser repentino, con signos y síntomas que se asemejan a los de la hepatitis La hepatitis delta puede ser de curso limitado o evolucionar hasta volverse crónica. Los virus de la hepatitis delta (VHD) y de la hepatitis B (VHB) pueden producir infección coexistente [28], o la infección por el virus delta puede sobreañadirse a un estado de portador del VHB. En este último caso, la hepatitis delta a veces se diagnostica erróneamente como exacerbación de la hepatitis B crónica.
El virus de la hepatitis delta es una partícula similar a virus, de 35 a 37 nm, que consiste en una capa de AgsHB y de un antígeno interno único, el antígeno delta. Con el antígeno delta está encapsulado el genoma, ARN de un solo cordón que puede tener una conformación lineal o circular. El ARN no muestra hibridación con el ADN del virus de la hepatitis B. El VHD no puede infectar una célula por sí mismo, y necesita coinfección con el VHB para llevar a cabo un ciclo completo de réplica.
Cuadro Clínico
Las manifestaciones clínicas del cuadro agudo son similares, cualquiera que sea el virus responsable (A, B, C, D). Pueden orientar a la etiología antecedentes epidemiológicos o factores de riesgo específicos.
Tiene un amplio espectro de manifestaciones clínicas de igual forma puede pasar asintomático. La severidad de la enfermedad depende de la edad, en los niños por lo general es asintomático o inaparente mientras que en los adultos se presenta con mayor frecuencia de forma sintomática con o sin ictericia [33-35].
Se han visto diferentes formas clínicas de presentación de la enfermedad [26,29]:
Inaparente: para aquellos pacientes que no presentan síntomas y que solo se reconoce la enfermedad a través de la detección de diferentes anormalidades por haber estado expuestos a la enfermedad y sometidos a vigilancia. En estos casos pueden verse las transaminasas elevadas.
Clásica: suele verse en más del 90% de todos los casos, y cuenta con por diferentes períodos: [26,29]
- Periodo prodrómico: caracterizado por astenia, malestar general, fatigas, laxitud, febrícula, anorexia, nauseas, vómitos , dolor abdominal y diarreas, también suele encontrarse enrojecimiento de la orofaringe, artromialgias, cefaleas y escalofríos, dura aproximadamente unos 3 a 4 días excepcionalmente 14 días.
- Periodo de estado: aparece el íctero en un tercio de los casos en adultos, coluria, prurito, hipocolia, en este periodo la anorexia que puede persistir pero el resto de los síntomas prodrómicos mejoran o desaparecen, puede encontrarse hepatomegalia dolorosa y esplenomegalia en el 15%, linfadenopatías cervicales, puede acompañarse de manifestaciones extra hepáticas como rash transitorio y artritis, la duración de este periodo es variable. En este periodo los anticuerpos que indican infección aguda alcanza su nivel máximo comienza progresivamente a disminuir para desaparecer alrededor de las doce semanas de evolución de la enfermedad.
- Periodo de convalecencia: Se extiende desde la desaparición de los síntomas hasta la total recuperación clínica, bioquímica y serológica, donde ocurre la disminución progresiva de las transaminasas, y la aparición de anticuerpos protectores del enfermo, habitualmente antes de los 4 a 5 meses de evolución todo el proceso termina y raramente se extiende a seis meses o más.
La forma clínica anictéria: Cursa como indica su nombre sin íctero, pero con todo el cortejo sintomático una hepatitis aguda.
Se han descrito formas atípicas de la enfermedad .Dentro de ellas se describen:
Colestásica: Caracterizada por íctero de tipo obstructo, severo, acompañado de prurito, coluria y acolia que puede extenderse desde las a 12 semanas hasta las 29 semanas en casos prolongados , con un patrón bioquímico caracterizado por elevación marcada de la bilirrubina, fosfatasa alcalina, GGT, usualmente las transaminasas luego de una elevación inicial marcada, suelen estar por debajo de 500 UI/l, los hallazgos patológicos se caracterizan por marcada colestasis centrolobulillar e inflamación portal.
Recidivante: Las formas bifásicas ocurren en el 6 a 10% de los casos, pueden ser polifásicas, después de un periodo inicial de hepatitis aguda (3 a 5 semanas) le sigue una remisión, que a menudo se caracteriza por una normalización de las transaminasas, en la recaída los síntomas pueden ser más o menos severos que el cuadro inicial, se elevan bruscamente las aminotransferasa hasta alcanzar niveles por encima de 1000UI/l.La completa duración de la enfermedad puede ir de 16 a 40 semanas. El pronóstico es bueno.
Con componente autoinmune [36-40]: Se dan como consecuencia de la formación de inmunocomplejos, son más frecuentes en la hepatitis por virus B, en la A son muy raras incluye urticaria y otras erupciones cutáneas, rash evanescente artralgias, artritis, erupción maculopapular eritematosa, vasculitis. Puede manifestarse como un síndrome nefrótico o una glomerulonefritis membranoproliferativa, por depósito de inmunocomplejos.
La hepatitis vírica prolongada se considera una secuela benigna de la enfermedad, casos atípicamente prolongados, donde las anormalidades del laboratorio, síntomas y manifestaciones físicas perduran, se considera prolongado cuando se extiende el curso clínico más de cuatro meses, se han invocado diferentes mecanismos relacionados con la edad del paciente y la cepa del virus. Este evento solo constituye un aumento en la duración de la fase aguda de la enfermedad y no una entidad aparte.
Si avanza la enfermedad, las sustancias químicas secretadas habitualmente por el hígado comienzan a concentrarse en la sangre. Esto provoca ictericia, mal aliento y un sabor amargo en la boca. La orina se vuelve oscura o "del color del té" y las heces se vuelven blancas, claras o "del color de la arcilla". Puede haber también dolor abdominal, concentrado debajo las costillas del lado derecho o del lado izquierdo por la hepatoesplenomegalia.
Complicaciones:
Pueden ser hepáticas y extra hepáticas
Hepatitis fulminante [21,22], La hepatitis fulminante se define por la aparición de encefalopatía hepática y trastornos de la coagulación en un paciente con disfunción hepática grave sin historia previa de enfermedad hepática, esta es una complicación afortunadamente infrecuente que se desarrolla en un 0.01 a 0.3% de los casos. La encefalopatía puede progresar rápidamente ó una buena supervivencia (hasta un 67%) comparado con otras etiologías; si no se asocia a otras complicaciones como son edema cerebral, fallo renal o respiratorio y alteraciones metabólicas.
Hepatitis autoinmune: Suele encontrarse en individuos genéticamente predispuestos en los que la infección desencadena el desorden inmunológico que dispara la enfermedad. Se considera una complicación Síndrome poshepatitis [31]: Cuadro que se presenta en adultos que han tenido previamente un episodio de hepatitis aguda, puede durar pocas semanas o extenderse a meses, se caracteriza por ansiedad, fatigas, no recuperan el peso, anorexia e intolerancia al alcohol, dolor en hipocondrio derecho, el hígado puede ser palpable y doloroso, las transaminasas pueden elevarse hasta tres veces su valor normal y los hallazgos histológicos no difieren de aquellos encontrados en pacientes que se recuperan normalmente y que son asintomáticos.
Extra hepáticas [32,33], El depósito vascular de inmunocomplejos, es la patogenia que se invoca en la explicación de las manifestaciones extra hepáticas, así tenemos dentro de las neurológicas el síndrome de Guillain Barré, meningitis aséptica, meningoencefalitis, mielitis; Hematológicas: anemia aplasica y hemolítica, y también pueden verse pancreatitis, miocarditis, pericarditis, entre otras [23]. La severidad de las manifestaciones [35,40,41]. clínicas de la enfermedad se ha asociado a diversos factores que tienen que ver con el virus (como la carga viral y el genotipo) y con el huésped, ya que por orden de frecuencia no suele debutar de igual forma la enfermedad en niños que en adultos, así como tampoco en individuos inmunocomprometidos como los VIH- SIDA.
Debemos estar alertas a los signos de alarma que pueden aparecer en el transcurso de las hepatitis: Empeoramiento o reaparición de los síntomas, anorexia persistente, atrofia hepática, prolongación del tiempo de protrombina, hipoalbuminemia, hipoglicemia, caída brusca ó elevación de las transaminasas, ascitis, entre otros, y ante la presencia de estos el enfermo debe estar hospitalizado e individualizar tratamiento según el tipo de complicación.
Diagnóstico [20,21,23,25]
El diagnóstico clínico lo complementa el análisis bioquímico y serológico del enfermo.
Pruebas bioquímicas: Las aminotransferasas aumentan por encima de diez veces su valor normal y paulatinamente van disminuyendo, pudiendo permanecer elevados por 6 meses hasta la recuperación definitiva.
La bilirrubina se eleva considerablemente, sobre todo en los casos de colestasis, la fracción conjugada aumenta tempranamente. La fosfatasa alcalina suele estar elevada hasta 3 veces por encima de su valor normal.
Los cambios hematológicos incluyen anemia hemolítica o aplasica, prolongación del tiempo de protrombina en los casos más severos que no retornan a la normalidad completamente con la administración de vitamina K; los niveles séricos de hierro y ferritina también pueden elevarse.
Marcadores virales:
Directo: ARN en heces, suero e hígado, por técnicas especiales, difícil por sus concentraciones mínimas.
Indirecto: IgM hasta 6 meses.
IgG confiere inmunidad a largo plazo.
El diagnóstico definitivo lo establece la determinación serológica de anticuerpos neutralizantes de la infección viral.
Anti-HAV IgM Infección aguda por virus A
Anti-HAV IgG Infección anterior -Inmunidad al virus A
Anti-HBc IgM Infección aguda por virus B
Anti-HBc IgG Infección anterior por virus B
HBs Ag Portador “asintomático” de virus B o infección por virus B
Anti-HBs Infección anterior -Inmunidad al virus B
(HBe Ag Infección por virus B en replicación)
(Anti-HBe Resolución de replicación activa)
Anti-HCV Infección aguda o anterior por virus C (debe efectuarse PCR para virus C)
Virus D: Anti-HDV IgM
Cuando se sospecha la presencia de algún proceso oncológico, una biopsia hepática diagnóstica, ecografía hepática, tomografía computarizada, determinación de alfa-fetoproteína en plasma puede orientar o confirmar el diagnóstico [36].
Criterios de curación
Desaparición de los síntomas
Normalización de las transaminasas
Serológico: Aparición de IgG anti VHA total que confiere inmunidad
Tratamiento:
Relaciones Sexuales protegidas
Aplicación de medidas generales y la inmunoprofilaxis activa y pasiva. Relaciones sexuales protegidas. Control higiénico dietético:
1. Control y tratamiento del agua y alimentos para consumo humano. Se deben adoptar las medidas epidemiológicas de control de foco, así como la educación sanitaria a todos los individuos de la comunidad.
2. Dieta: Ningún régimen dietético mejora la enfermedad la disminución en la ingestión de grasas si existen náuseas. La dieta será normal, según lo que le apetezca al paciente.
3. Reposo: Se indicará reposo en cama mientras el enfermo este sintomático, volviendo a la actividad normal cuando desaparezcan los síntomas. En la fase asintomática no hay que limitar la actividad.
4. Alcohol: Su ingestión se debe prohibir en la enfermedad aguda así como en la convalecencia hasta la normalización total de la bioquímica, debido a la hepatotoxicidad que produce y que puede sobreañadirse al daño que produce el virus. La prohibición total pasados los primeros meses es innecesaria, se recomiendan períodos de abstinencia entre 30 a 180 días.
5. Medicamentos: Las drogas hepatotóxicas deben suprimirse y la utilización de otros medicamentos. Pueden ser utilizados los analgésicos, de preferencia, el paracetamol a dosis generosas evitar los AINES. La dosis de los medicamentos que se metabolizan en el hígado se reducirá y los anticonceptivos orales deben suspenderse. En caso que se requiera la utilización de antibióticos por alguna sepsis se prefieren aquellos que tienen excreción renal, siempre que su función sea buena [32].
6. El uso de los esteroides ha sido discutido, sin embargo su uso se justifica en las colestasis prolongadas. [33] Inmunoprofilaxis La inmunoprofilaxis puede ser pasiva con la administración de gammaglobulina o activa mediante vacunas. La vacunación ha demostrado una eficacia de protección reportada entre 94 a 100%, su impacto en el descenso de la incidencia de la enfermedad ha sido dramático, fundamentalmente en áreas endémicas y grupos de riesgo [36,37].
En los últimos años se ha ensayado el uso de vacunas bivalentes (unión de la vacuna del VHA a la del virus de la hepatitis B) con buenos resultados en la respuesta serológica de los pacientes lo que unido a su impacto económico, contribuye probablemente en el futuro, a ampliar su uso [38].No se ha demostrado beneficio con el uso de vitaminas, drogas hepatoprotectoras, regeneradoras, antivirales e inmunomoduladores. El trasplante hepático se reserva para la Insuficiencia Hepática.
Algunos autores proponen la selección de pacientes con hepatitis C [38] para recibir tratamiento se basa en pruebas del virus (pruebas de ácido nucléico), pruebas de función hepática, estudios de imagenología (tomografía, resonancia magnética o ultrasonido) y biopsia hepática. El peginterferón combinado con ribavirina son los 2 medicamentos antivirales que se usan actualmente. Para la enfermedad hepática en etapa final, el transplante de hígado puede ser la única opción de tratamiento.
Virus Nuevos
Introduzcámonos pues, en aquellos virus, que son altamente mortales y los que pudieran ser utilizados con fines de arma biológica por su rápida diseminación y letalidad. Desde hace unos años aparece en la literatura el término de "Virus nuevos” y se utiliza para aquellos virus que causan enfermedades agrupadas bajo la expresión de "fiebres hemorrágicas”. Constituyen los más peligrosos para el hombre y en los que las alteraciones del medio ambiente favorecen su propagación. Los nuevos virus aparecidos en el curso de los últimos años pertenecen a otras tres familias: los Arenaviridae, los Bunyaviridae y los Filoviridae [42,43].Los nuevos virus pertenecen a diferentes familias, pero los signos clínicos que producen, las causas de su aparición, su constitución y su modo de acción presentan puntos comunes. El virus Marburg y el virus Ébola, reagrupados en la familia de los Filoviridae, comparten idéntica peligrosidad y son de origen desconocido. Aunque Marburg sólo ha infectado a algunas personas, Ébola ha sido, el causante de una nueva epidemia en Zaire.
Los Bunyaviridae, los Arenaviridae y los Filoviridae son todos virus ARN monocatenarios negativos: el mensaje contenido en su genoma está constituido por ribonucleótidos, en tanto que el genoma de los seres vivos lo forma ADN, una concatenación de desoxirribonucleótidos. El ADN se transcribe primero en ARN mensajero (ARN positivo), antes de traducirse en proteínas. En los virus de ARN, éste o es positivo, como ocurre en el de la poliomielitis, y se traduce directamente en proteínas víricas por la maquinaria celular, o bien el ARN es negativo, y debe trascribirse primero en otro ARN de polaridad positiva. Inversión de la polaridad de la que se encargan enzimas específicas de estos virus, las ARN polimerasas. Las ARN polimerasas, que garantizan la traducción de los ARN, cometen más errores que las ADN polimerasas; y puesto que estos errores no se corrigen, una célula infectada da origen a una población heterogénea de virus. La existencia de estas explican la rápida adaptación de los virus a los cambios ambientales: algunos se adaptan a los huéspedes invertebrados, otros a los vertebrados, y desbaratan el sistema inmunitario de su huésped; por último, pueden aparecer variantes patógenas [42].
Virus Ébola descubierto en enero de 1995 por el autor y su equipo. Pertenece a la familia de los Filoviridae, o virus filamentosos, los más largos que se conocen. A menudo mortal para el ser humano y el mono, el Ébola desencadena fuertes fiebres y hemorragias internas [43].
Los Arenaviridae son esféricos. Se ven aquí tres partículas víricas que han salido de la célula inferior. Al abandonar la célula, las partículas víricas arrastran con ellas una parte de la membrana celular. Adem´s, se llevan diversos ribosomas (los puntos negros) de la célula; este aspecto granuloso les ha valido su nombre [44,45].
Las contaminaciones accidentales [42,46,47]
Los Filoviridae son los virus más largos que se conocen: de estructura filiforme, miden unos 1500 nanómetros (una partícula vírica esférica, por ejemplo de Arenavirus, tiene un diámetro de 300 nanómetros). En 1967, enfermaron en Marburgo 25 personas que preparaban cultivos celulares a, partir de riñones de un mono Cercopithecus aethiops; siete de ellas fallecieron. Se notificó a la vez otro caso en Frankfurt y otro en Yugoslavia, en laboratorios donde se habían recibido monos procedentes de Uganda. Los monos murieron igualmente de la enfermedad, pero las investigaciones llevadas a cabo en el este africano no han permitido descubrir el reservorio del virus. En Sudáfrica, Zimbabwe y Kenia se han notificado cuatro casos de infección natural. Aunque se desconoce la vía de contagio, se han indicado contaminaciones secundarias entre el personal hospitalario.
Se sabe de dos virus de las fiebres hemorrágicas que han intervenido en epidemias hospitalarias: el de Lassa y el Ébola.
Los Arenaviridae tienen un ARN de una sola hebra, el ARN de los Arenaviridae está dividido en dos segmentos; el largo cifra la ARN polimerasa y el corto la núcleo cápside, cuando se lee en un sentido, y las proteínas de la cubierta, cuando se lee en el opuesto. Cuando una misma célula se infecta por dos virus del mismo género, éstos pueden combinarse, asociándose los segmentos de uno con los de otro para originar nuevas cepas, las recombinantes.
En el plano biológico, estos virus presentan, asimismo, rasgos comunes: se observa siempre una disminución del número de plaquetas, las principales células del sistema de coagulación sanguínea. Sin embargo, esta disminución del número de plaquetas, o trombocitopenia, no basta para explicar los signos hemorrágicos. Aún conocemos mal el modo de acción de estos virus, por dos razones. En primer lugar, la mayoría de los episodios irrumpen en países tropicales y, a menudo, en zonas rurales. Los hospitales disponen de pocos medios de investigación que les permitan explorar las perturbaciones biológicas responsables de las manifestaciones clínicas. La segunda razón es que algunos de esos virus son muy peligrosos y sólo pueden manipularse en laboratorios que cumplan normas de seguridad muy rigurosas. Existen muy pocos de ellos en el mundo y no todos disponen del equipo necesario: si no acarrea graves riesgos la manipulación de tales virus en las placas de cultivo, el peligro se agrava ante monos infectados, porque quienes tratan con ellos se hallan expuestos a arañazos y mordeduras de animales enfermos, y, por ende, al contagio. Finalmente, esos virus, a veces mortales para el hombre, no pueden estudiarse en los animales de laboratorio habituales, es decir los roedores, pues estos últimos son reservorios naturales de los Arenavirus y los hantavirus.
Se pueden emitir hipótesis, sin embargo, sobre su modo de acción, distinguiendo dos grupos de virus, los que destruyen las células y los que perturban el sistema inmunitario de las células infectadas. Entre los primeros, los virus citolíticos, se clasifican los virus de la fiebre de Crimea-Congo, el virus de la fiebre del valle del Rift, los dos Filovirus Marburg y Ébola y el antepasado del virus causante de las fiebres hemorrágicas, el Amaril, responsable de la fiebre amarilla.
El virus Ébola no presenta reacciones serológicas cruzadas con el virus de Marburgo. Esto permite su identificación serológica. Tanto el virus Ébola como el virus de Marburgo son virus pleomórficos (de morfología variable), cuyos viriones suelen presentar formas filamentosas que pueden alcanzar grandes longitudes (hasta 14.000 nm); sin embargo, presentan un diámetro bastante uniforme (aproximadamente 80 nm).
Las infecciones por virus de Marburg son sumamente raras.
Parecen ser similares a la fiebre hemorrágica del Ébola y las recomendaciones para ambas infecciones víricas son las mismas [44].
Virus Lassa
La fiebre de Lassa se describió por primera vez en la década de los cincuenta, aunque el virus no se aisló hasta 1969. [45] Se trata del virus de Lassa un Arenavirus serológicamente relacionado con los virus de la Coriomeningitis Linfocítica, Machupo y Junín, Guaranito y Sabiá. Los Arenavirus son virus con RNA monocatenario semejantes en cuanto a morfología. Su nombre se debe al aspecto densamente granular que presenta el interior del virión al microscopio electrónico.
Es una infección viral sistémica diseminada primaria, endémica en varios países de África Occidental, los más afectados son los de la Unión del Río Mano (Guinea, Liberia y Sierra Leona), además de Nigeria. También hay riesgo en Costa de Marfil y Ghana.
Puede ser letal por el deterioro de la inmunidad celular, que produce viremia fulminante. Hubo casos esporádicos en viajeros de Inglaterra, Holanda y Alemania [47]. Se observa en muchos países de África Occidental y la incidencia de seropositividad ha alcanzado a zonas de África Central. Se estima que la población seronegativa en riesgo es de 59 millones, con una incidencia anual de la enfermedad de 3 millones, y mortalidad de hasta 67 000, con hasta 3 millones de reinfecciones. los viajeros procedentes de zonas donde la fiebre es endémica exportan la enfermedad a otros países, y si tenemos presentes las posibilidades que otros están haciendo énfasis de la posibilidad de utilizar el virus como arma biológica aumentan el potencial de daño más allá del nivel local y es capaz de producir miles de muertes una vez presentada. La máxima incidencia ocurre en la estación de seca, afectando a personas de todas las edades y de ambos sexos, además hay contagio durante todo el año, apareciendo brotes que afectan a todos los grupos de población, en su forma grave parece tener una incidencia mayor en las mujeres embarazadas.
El reservorio natural del virus es la rata Mastomys natalensis, probablemente los roedores más comunes en África tropical en las áreas rurales. Los roedores se infectan y eliminan el virus en sus excreciones. Los seres humanos se infectan por aerosoles a través del contacto directo con las excretas de roedores infectados ó a través del contacto con las ratas o de su ingestión, habitual en ciertas regiones. Los anticuerpos aparecen luego de una enfermedad febril; la frecuencia es doble entre personas que comen ratas respecto de las que no las comen, y la sordera es 4 veces más frecuente. La infección puede producirse en el laboratorio o por contagio de persona a persona, especialmente en los hospitales, a través del contacto directo con sangre u otros líquidos corporales de los pacientes por contacto directo con sangre, secreciones faríngeas u orinas de un paciente y también por contacto sexual. El período de incubación es de 6-21 días. El virus se elimina en orina por 3-9 semanas, y en semen por 3 meses [46,47].Son susceptibles personas de todas las edades; en 80% de los casos la enfermedad es leve y pasa inadvertida, pero en 20% presenta una forma grave con compromiso multisistémico.
Cuadro Clínico [45,46,48]
Se presenta con signos y síntomas indistinguibles de otras enfermedades febriles como la malaria o de otras fiebres hemorrágicas como el Ébola. Los predictores clínicos diagnósticos más importantes son fiebre que no responden en forma adecuada a antimaláricos o antibióticos, faringitis con exudados membranosos llegando en ocasiones a la disfagia, dolor retroesternal, mialgias en espalda y miembros y proteinuria, mientras que los predictores de resultado son fiebre, dolor de garganta y vómitos.
Es común observar inflamación y exudado de las conjuntivas. Entre las complicaciones se encuentran las hemorragias de las mucosas (17%), déficit auditivo neurosensorial (4%), derrame pleural (3%) y derrame pericárdico (2%). El resultado se relaciona con el grado de viremia y no con la respuesta de anticuerpos, y es peor cuando hay altos niveles de aspartato aminotransferasa. La duración de la enfermedad puede variar mucho. El intervalo entre el inicio de los síntomas y el alta es de unos 17 días, y entre el inicio de la enfermedad y el fallecimiento de unos 5 días.
En los casos graves [46] con frecuencia existe hipotensión arterial o shock derrame pleural y hemorragias, convulsiones, encefalopatías, edemas de la cara y el cuello, y al examen físico la presencia de adenopatías no dolorosas, presencia de estertores húmedos e inyección conjuntival una afección grave, progresiva y mortal. La recuperación comienza hacia la segunda semana y se completa en la tercera en los casos leves y moderados. Asociada a alto grado de mortalidad, la enfermedad progresa hasta que aparece alteración del nivel de conciencia, edema pulmonar, derrame pleural y ascitis, hipovolemia y shock debido posiblemente a rotura capilar difusa Es más grave la enfermedad durante el embarazo y en más del 80 de los casos hay perdida fetal, siendo la tasa de muerte fetal de un 42 % en el primer trimestre y la mortalidad materna alcanza un 30 % sugiriéndose la interrupción del embarazo en las mujeres infectadas.
En las regiones endémicas la enfermedad suele ser leve en los niños y se caracteriza sobre todo por fiebre, hepatoesplenomegalia, malestar general, tos y síntomas abdominales. La aparición de sordera coincide con la mejoría en alrededor del 20 % de los casos, siendo permanente y bilateral en algunos. Puede haber reinfección pero no se ha asociado a una gravedad especial de la enfermedad. La sordera es por ataque del VIII par craneal [46], la mitad recupera parte de la función auditiva después de 1 a 3 meses. En la convalecencia ocasionalmente aparecen crisis oculógiras y alopecia. Una característica de la enfermedad es la sordera neurosensorial, que se presenta en 29% de los casos. En la población general, 81% de las personas que presentan sordera repentina tienen anticuerpos contra el virus de Lassa, en comparación con 19% en los controles. No se vio relación aparente entre la gravedad de la enfermedad, pérdida inicial de la audición y recuperación. La tasa de letalidad fue del 12%-23% en Kenema, entre 1997 y 2002. Produce altas tasas de mortalidad materna (29%) y abortos o muertes neonatales (87%). Se estima que la población seronegativa en riesgo es de 59 millones, con una incidencia anual de la enfermedad de 3 millones, y mortalidad de hasta 67 000, con hasta 3 millones de reinfecciones.
Diagnóstico [46,48]
Sospecha ante la presencia de estar en zonas endémicas o con presencia de epidemias en ocasiones, viajeros procedentes de esas zonas, cuadro clínico y exámenes.
Al momento de la internación, inmunofluorescencia indirecta específica para la IgM y la IgG la mayoría de los pacientes presentaba anticuerpos contra el virus (53% eran IgG y 67% IgM). La prueba de ELISA para IgM tiene 88% de sensibilidad y 90% de especificidad durante la infección aguda. Aislamiento del virus en sangre, exudado faríngeo, orina o líquido pleural o ascítico hasta 15 días después del inicio de la enfermedad clínica. Otros efectos de la enfermedad son la linfocitopenia y leve trombocitopenia, máximas a los 10-11 días de la presentación de los síntomas. La trombocitopenia se asocia con un inhibidor sérico y con la ocurrencia de hemorragia, disminución de la agregación plaquetaria y gravedad de la enfermedad. Con la reacción en cadena de polimerasa de transcripción reversa es posible diagnosticar todos los casos al tercer día de infección, pero con inmunofluorescencia se identifican sólo 52% de los pacientes. LDH-CPK-Transaminasas-aumentan, Rx Tórax-infiltrados focales y derrame pleural. Proteinuria. La presencia de Viremia intensa notable y AST >150UI/ml (AST-aspartato aminotransferasa) constituyen signos de mal pronóstico.
Necrosis eosinófila de los hepatocitos sin respuesta inflamatoria y presencia de viriones en el interior de las células hepáticas. Se observa una necrosis similar alrededor de los folículos linfoides del Bazo y en las glándulas suprarrenales. La afectación de otros órganos se manifiesta por edemas y con una frecuencia variable hemorragia e inflamación parenquimatosa y formación de infiltración peri vascular por células redondas.
Manejo clínico. [45,46,48,49]
Se recomienda todos los casos sospechosos deben ser internados y aislados. Hay transmisión intrahospitalaria si no se realizan medidas de control adecuadas.Realciones sexuales protegidas.
Tratamiento. Se requieren ri`bavirina (virazole) tiene gran eficacia en los primeros 6 días de la enfermedad: por vía endovenosa 30mg/Kg. inicialmente, continuar con 15 mg/kg cada 6 horas por 4 días y con 8mg/Kg. cada 8 horas por 6 días más. Los pacientes con AST >150UI/ml deben ser tratados con Ribavirina endovenosa y medidas de soporte general.
La ribavirina es casi el doble de efectiva si se la administra por vía intravenosa que por vía oral, si se la ingiere dentro de los 6 días del inicio de la enfermedad puede reducir los Fallecimientos en hasta 90%. Son habituales la deshidratación, edema, hipotensión y mala función renal. Hay que proceder con cuidado con el tratamiento de rehidratación y con las transfusiones.
Vigilancia y control de la enfermedad. Se deben identificar todos los contactos durante las 3 semanas posteriores al inicio de la enfermedad, y buscar los casos no informados y no diagnosticados. Dos áreas de preocupación son el tratamiento de casos no diagnosticados en hospitales donde el hacinamiento y las malas condiciones de higiene pueden producir la diseminación de la enfermedad a otros pacientes, al personal o a los visitantes, y las ceremonias de cremación de cadáveres de personas que tuvieron la infección, con posibilidad de diseminarla a muchas personas.
Vacuna. Los costos de la vacunación serían enormes, y se la podría utilizar para las personas que viajan a la región, si bien esta es la estrategia de control más costosa.
Medidas preventivas: control de los roedores específicos. Control del paciente, de los contactos y del ambiente inmediato. Notificación a la autoridad local de salud.
Aislamiento: Medidas de protección de tipo respiratoria los hombres abstenerse de tener actividad sexual sin protección, mientras no se haya demostrado que el semen está exento del virus o por tres meses. Mantener estricto aislamiento de líquidos corporales y de excretas. Exámenes de laboratorio deben realizarse en instalaciones en las que se puedan tomar medidas de seguridad biológicas de alto grado. Establecer vigilancia detenida de los contactos de la forma siguiente: Medir temperatura corporal dos veces al día por dos semanas como mínimo después de la última exposición, si temperatura mayor de 38,3°c se hospitalizara determinar lugar de residencia del paciente en las tres semanas anteriores al comienzo de la enfermedad y se procederá a la búsqueda de casos no notificados o no diagnosticados.
Medidas en caso de epidemia: Puede haber gran proliferación de los roedores Mastomys en casa, habitaciones y zonas de almacén de alimentos, lo cual aumenta el peligro de su contacto con humanos. Medidas internacionales: Notificación del país de origen de los casos, a los países receptores de la posible exposición por parte de viajeros infectados.
Virus Marburg
El virus toma su nombre de la ciudad alemana de Marburgo, donde fue aislado en 1967 tras una epidemia de fiebre hemorrágica que cundió en el personal de laboratorio encargado de cultivos celulares que había trabajado con riñones de simios verdes ugandeses (Cercopithecus aethiops) importados hacía poco, que luego resultaron estar infectados. Se observaron episodios similares en las ciudades de Fráncfort y de Belgrado.
El Marburgvirus o virus de Marburgo Filovirus responsable de una fiebre hemorrágica viral de elevada mortalidad: la fiebre hemorrágica de Marburgo. Hasta el momento todavía no se identifica el depósito del virus, pudiera ser una zoonosis y puede que el virus de Marburgo pueda ser endémico en muchas áreas de África Central.
El genoma del virus [51,52] es de alrededor de 19 Kb y parece contener el código de 7 productos; el genoma presenta una disposición lineal de los genes con una zona de superposición. La estructura del genoma es la siguiente: Región 3’ no traducida, nucleoproteínas (NP), VP35, VP40, Glicoproteína, VP30, VP24, Proteína L (una ARN polimerasa ARN dependiente), Región 5’ no traducida. El área de superposición se sitúa entre los genes VP30 y VP24 (en el genoma del virus Ébola hay 3 áreas de superposición). La glicoproteína media la adhesión con el receptor de la célula hospedadora y la sucesiva fusión entre las membranas lipídicas, permitiendo el fenómeno de la infección. Se cree que la proteína es una ARN polimerasa ARN dependiente y, en efecto, presenta áreas de homología con otras ARN polimerasas de virus de ARN, situadas sobre todo a la mitad de la N-terminal.
La función de las proteínas VP35 y VP30 todavía no está muy clara. Se cree que posiblemente formen parte de la envoltura nuclear. Las proteínas VP24 y VP40 son ricas en áreas hidrofóbicas y se cree que forman parte de la envoltura proteica. El ingreso del virus a la célula hospedante es mediado por la glicoproteína de superficie, pero no se conoce el receptor al que se pega. Hay quien sostiene incluso que los receptores a los que se pega la glicoproteína pueden ser de distintos tipos. Asimismo, se desconoce si el virus penetra a través de la fusión de la membrana o si a esto se agrega también un proceso de endocitosis.
El virus de Marburgo es capaz de infectar casi todos los órganos (de los linfoides hasta el encéfalo). La transcripción y replicación del virus ocurre en el citoplasma de la célula hospedadora.
Anatomía patológica [51,52] Es común la presencia de necrosis focales de hígado, nódulos linfáticos, testículos, ovarios, pulmones, riñones y linfoides. En el hígado se localizan cuerpos eosinófilos (similares a los cuerpos de Councilman) y en el pulmón se notan indicios de pulmonitis intersticial y de endoarteritis de las arterias pequeñas. La necrosis tubular renal ocurre sobre todo en las últimas fases de enfermedad, proliferación de células glía en el SN y se han localizado antígenos antivirales en varios órganos, sobre todo en el hígado, en los riñones, en el bazo y en las hipófisis. En los supervivientes, además, el virus ha sido aislado en la cámara anterior del ojo hasta 4-5 semanas después de la enfermedad y en el líquido seminal hasta la duodécima semana.
Modalidades de contagio [52]
Se transmite en particular a través de los líquidos del cuerpo: sangre, saliva, vómito, heces, orina y secreciones respiratorias. La transmisión por vía sexual es posible durante varias semanas después de la enfermedad. El pico de máxima infectividad ocurre durante las manifestaciones más graves de la enfermedad, junto con las manifestaciones hemorrágicas. El virus también puede inocularse a través de instrumentos contaminados.
Clínica [52]
El periodo de incubación de alrededor de 3 a 9 días.
Cefalea frontal y temporal acompañada de malestar general y mialgias. Es característica la fiebre alta (39-40 °C) que aparece ya desde el primer día de enfermedad, a la que sigue una fuerte y rápida debilitación. Cerca de la mitad de los enfermos pueden acusar conjuntivitis.
Hacia el tercer día aparece diarrea acuosa con dolor abdominal y calambres, náusea y vómito. La diarrea puede ser también grave y durar hasta una semana. En este periodo los enfermos presentan un rostro inexpresivo con ojos hundidos y también letargo y alteraciones mentales.
Hay presencia de linfadenopatías cervical en la primera semana de la infección y aparición de enantema de las amígdalas y del paladar. Signo característico es la aparición de un exantema máculo-papuloso no pruriginoso que aparece, en general desde el quinto día, en rostro y cuello y que sucesivamente se extiende a los miembros. Las manifestaciones hemorrágicas aparecen a partir del quinto día de enfermedad. A estos enfermos la muerte acaece por colapso cardiocirculatorio a causa de sangrados múltiples entre los días 8 y 16 de la enfermedad. Se puede encontrar sangre en el vómito y tener sangrados de nariz, de encías o de vagina. Un problema grave puede ser el sangrado abundante causado por la punción de agujas.
A partir del 7mo día la fiebre comienza a bajar para luego reaparecer dos semanas después de la enfermedad, y en esta etapa suele aparecer hepatoesplenomegalia, edema facial ó escrotal. Se han descrito como complicaciones de la enfermedad la orquitis que puede llegar a la atrofia, la miocarditis, mielitis transversa, uveítis y la pancreatitis .Los que sobreviven a la infección demoran al menos un mes con disturbios psicológicos, anorexia y caída del cabello.
Diagnóstico [49,50,53]
Lo sospechamos con el decurso clínico y en los datos epidemiológicos. Aislamiento del virus o bien en la evidencia de la respuesta inmunitaria y en la presencia de material genómico viral. Para evidenciar la presencia de anticuerpos (IgM y IgG) se recurre a un ensayo de inmunofluorescencia indirecta, al uso de la prueba Western Blot o de la prueba ELISA. Para distinguir el genoma o los antígenos virales se utiliza la reacción en cadena de la polimerasa (PCR), la inmunofluorescencia, la histoquímica o la prueba ELISA. Desde el primer día, está presente una leucopenia con linfocitos que llegan hasta los 1000/μl; hacia el cuarto día se agrega una neutropenia. Entre el sexto y duodécimo día aparece una plaquetopenia importante (hasta menos de 10000 plaquetas/μl). Presencia hipoproteinemia, aumento de las enzimas aminotransferasa, proteinuria y aumento de la azotemia. En los casos mortales se puede notar presencia de coagulación intravascular diseminada.
Tratamiento
No existe terapia específica. Relaciones sexuales protegidas.
Hay que recurrir a una terapia de apoyo para controlar el volumen hemático, el balance electrolítico y monitorear atentamente la presencia de infecciones secundarias. Sólo en caso de que se note un estado de coagulación intravascular diseminada se puede recurrir a la heparina. Se han propuesto terapias a base de suero obtenido de sujetos curados o con interferon, pero actualmente faltan pruebas de apoyo. La ribavirina, en experimentos in vitro, no ha podido reducir la replicación del virus de Marburgo [53].
Es importante el aislamiento del paciente y el uso de dispositivos de protección para el personal médico y paramédico. Actualmente se realizan estudios para poder crear una vacuna específica. [54]
Virus de Ébola
El virus Ébola pertenece a la familia de los Filoviridae es un virus RNA monocatenario , y debe su nombre a que fue identificado por primera vez, en 1976, cerca del río Ébola en el antiguo Zaire, hoy República Popular del Congo. La fiebre hemorrágica por virus Ébola (FHE) es una de las enfermedades virales más virulentas que haya conocido el ser humano [53].
Se han descrito 4 cepas conocidas hasta el momento [53]: Zaire, Sudán, Côte d’Ivoire y Reston. Tres de éstos, el Zaire, el Sudán y Côte d’Ivoire, han sido identificados como patógenos para el ser humano. De ellas la más virulenta es Zaire, identificada junto con la Sudan en 1976. La fiebre hemorrágica del Ébola es una enfermedad mortal, del 50%-90% de los casos son sintomáticas, aparece en forma de brotes esporádicos pero letales. La infección humana por el subtipo Reston, encontrado en la región del Pacífico Occidental, ha sido sólo asintomática, es decir que quienes la contrajeron no experimentaban síntomas clínicos de enfermedad. El reservorio natural de virus del Ébola parece residir en los bosques pluviales del continente africano y en algunas zonas de la región del Pacífico Occidental.
El reservorio natural [53,54] se desconoce, pero se cree es un virus de origen zoonótico, normalmente mantenido en la naturaleza por un animal huésped nativo del continente africano.
Se han planteado hipótesis que apuntan a primates no humanos, como monos, gorilas, chimpancés, pero actualmente se descartan dado que los monos son muy susceptibles a la infección y mueren rápidamente una vez infectados, por lo que es poco probable que constituyan fuente prolongada de contagio. También se ha pensado en los murciélagos. Se desconoce además cómo se produce el primer caso de un brote, aunque se piensa que esté en relacionado por contacto con un animal infectado. Después sí se establece la trasmisión de persona a persona por contacto directo con sangre o secreciones, (incluyendo semen), de una persona infectada o a través del contacto con objetos contaminados con secreciones del enfermo. Por tanto la mayoría de los casos se produce entre los familiares y el personal de salud que cuidan al enfermo, de ahí el riesgo de infección nosocomial si no se toman las medidas adecuadas. Posible transmisión vertical. Trasmisión sexual demostrada.
Ébola Bundibugyo
El 29 de noviembre de 2007, el ministro ugandés de Salud confirmó que la Fiebre que ha matado al menos a 35 personas y que ha infectado a 127 en Uganda, ha sido provocada por el virus del Ébola. Las muertes se registraron en la región de Bundibugyo, en la frontera con el Congo. Tras analizar las muestras el Laboratorio Nacional de Estados Unidos y el Centro para el Control de las Enfermedades, la Organización Mundial de la Salud ha confirmado que se trata de una nueva cepa del Virus Ébola.
Transmisión
El virus del Ébola se transmite [53-56] por contacto directo con sangre, secreciones u otros líquidos corporales u órganos de personas infectadas. Las ceremonias de inhumación en las cuales los integrantes del cortejo fúnebre tienen contacto directo con el cadáver pueden desempeñar una función significativa en la transmisión de virus del Ébola. Se han reportado infecciones en el caso de Côte d’Ivoire en el Congo y Gabán relacionadas con la manipulación de de chimpancés, gorilas y antílopes de los bosques infectados, así como la transmisión de la cepa Reston de virus del Ébola asociada a la manipulación de macacos cangrejeros. Los trabajadores de la salud en contacto con los enfermos que no adoptan las medidas de precauciones para el control de las infecciones ni los procedimientos a menudo resultan infectados [50]. La infección también puede transmitirse por contacto con prendas de vestir o ropa de cama sucias de un paciente infectado por virus del Ébola. Por consiguiente, es preciso esterilizar esos objetos antes de manipularlos. La transmisibilidad se mantiene mientras persista el virus en sangre y secreciones. Generalmente es de 8 a 10 semanas. Se ha demostrado trasmisión por semen 7 semanas después de la recuperación de un enfermo.
Período de incubación: 2 a 21 días.
Cuadro clínico
La enfermedad se suele manifestar con la aparición súbita de fiebre marcada [52-54], Cefalea intensa, debilidad intensa, dolor de músculos y articulaciones, erupción maculopapular en el tronco, faringitis, a menudo seguida de vómitos, diarreas con sangre conocida como ¨diarrea roja del Ébola¨ (denominada “diarrhée rouge” en los países de habla francesa de África) , dolor abdominal, petequias, insuficiencia renal y hepática con destrucción tisular debido a la velocidad de replicación viral, y en algunos casos hemorragia interna y externa llegando a sangrar por todos los orificios naturales (epistaxis, hemorragia gingival, hematemesis, melena y púrpura entre otras) Pueden aparecer síntomas del sistema nerviosos como convulsiones, coma, delirio, shock y fallo multiorgánico.Los resultados de laboratorio muestran recuentos bajos de leucocitos y plaquetas, y aumento de las transaminasas [50]. Evoluciona rápidamente hacia la postración.
El intervalo entre el comienzo y la mejoría o la muerte es de 7 a 10 días. La letalidad es del 50 al 90 %.En los pocos casos sobreviven la infección se recuperan lentamente, cinco o más semanas y en la primera fase puede haber pérdida de cabello, peso y amnesia [55].
Diagnóstico [54,56]
Las muestras de sangre analizadas revelan la presencia de antígenos específicos y/o genes del virus. Pueden detectarse anticuerpos contra el virus, y éste puede aislarse en cultivos de células [54,56]. La manipulación de las muestras durante las pruebas conlleva un peligro biológico extremo y sólo se realiza en condiciones de máxima contención biológica. Dentro de las nuevas técnicas de diagnóstico figuran métodos no invasores (muestras de saliva y orina) y análisis de muestras inactivadas para efectuar diagnósticos de laboratorio rápidos. El diagnóstico se hace con los elementos clínicos y epidemiológicos más las pruebas de laboratorio. En el leucograma, leucopenia y trombocitopenia en el conteo de plaquetas. Transaminasas hepáticas elevadas. El diagnóstico confirmativo serológico: Inmunofluorescencia indirecta, Elisa, Western Blot y PCR.Diagnóstico anatomopatológico: Visualización del virus en tejidos por técnicas de anticuerpos monoclonales, Inmunofluorescencia indirecta, o microscopía electrónica. Diagnóstico virológico: Aislamiento del virus en cultivos celulares e inoculación a cobayos
Tratamiento [52,54,56].
No se dispone todavía de ningún tratamiento ni vacuna específicos para la fiebre hemorrágica del Ébola. Aislamiento estricto del paciente, tanto por las necesidades de cuidados especiales del enfermo como para impedir o limitar la diseminación de la enfermedad, así como estricto medidas de bioseguridad para el personal médico y de laboratorio.
Se basa en medidas de sostén para la deshidratación con soluciones electrolíticas, el nivel de oxigeno y la presión arterial así como el suministro de plasma o sangre y el tratamiento de infecciones sobreañadidas y medidas antishock.
Se están poniendo a prueba varias vacunas experimentales, pero podrían pasar varios años antes de que alguna de ellas esté disponible. Hay una nueva farmacoterapia que inicialmente parece prometedora, según los estudios de laboratorio, y se está evaluando más detenidamente. Sin embargo, eso también llevará varios años. Se investiga además sobre el genoma del virus, para secuenciar y comparar el genoma de las distintas cepas lo cual facilitaría encontrar su origen, historia natural y posibles reservorios. Él riesgo de todo paciente que viaje al África por lo que la vigilancia debe ser estricta, sobre todo cuando este virus representa un arma biológica que puede ser usada con fines militares o terroristas por su rápida diseminación y su virulencia. Relaciones sexuales protegidas.
A continuación unos pocos ejemplos del uso del virus en la cultura popular [57]
El concepto de virus altamente infeccioso y causante de hemorragias se utilizó en la película 28 días, dirigida por Danny Boyle. Aunque el agente infeccioso utilizado en la película, era ficticio, son evidentes algunos paralelismos con el Ébola.
En la película Estallido Outbreak protagonizada por Dustin Hoffman en 1995, se relata la propagación de una enfermedad similar al Ébola, causante de fuertes hemorragias. Se expone que el grado de mortandad del virus es del 100%, al igual que el Ébola y se muestran las imágenes del virus Ébola.
En la publicación "Apocalipsis-zombie" el virus que transforma a las personas en zombies resulta de un experimento ruso con el Ébola.
En el videojuego Syphon Filter sale un virus que es una mezcla de Ébola y sida.
En la película Death Note: L Change The World aparece un arma biológica que es una mezcla del virus del Ébola con el de la gripe.
El antiguo biólogo soviético Ken Alibek, en su libro Biohazard, declaraba que la antigua Unión Soviética experimentó con el uso del Ébola como arma biológica, llegando a desarrollar una versión modificada genéticamente para incrementar el grado de contagio y letalidad.
En el libro Executive Orders de Tom Clancy, se describe un ataque bioterrorista a los Estados Unidos consistente en una nueva cepa del virus que se propaga por el aire.
Retrovirus
Los retrovirus son responsables de muchas enfermedades, incluyendo algunos cánceres y el SIDA. Los científicos pueden modificar genéticamente los retrovirus y usarlos en terapia genética como vectores. Constituyen hasta entonces la clave de la oncogénesis viral.
Los retrovirus humanos: Existen 4 retrovirus humanos identificados: el virus de la inmunodeficiencia humana de tipo 1 (VIH-1), el de tipo 2 (VIH-2) y los virus Linfotrópicos de Células T humanos de tipo I y II (HTLV-I y HTLV-II). Todos tienen como diana los linfocitos T (los glóbulos blancos). Los virus HTLV I/ II producen la inmortalización de los linfocitos infectados, generando una replicación descontrolada de los mismo, y por lo tanto una linfoproliferación.
Algunas propiedades de los retrovirus [58-60]

El descubrimiento de infección por retrovirus y su subsecuente asociación con ciertas enfermedades autoinmunes [58] ha aumentado el interés por la posibilidad de la etiología retroviral en ciertas enfermedades autoinmunes. Los mecanismos por los cuales los retrovirus pueden desencadenar una respuesta inmune son el mimetismo molecular, la codificación de superantígenos o estimulación directa del sistema inmune por proteínas virales.
La identificación del primer retrovirus fue a finales de la década de los 70 y principio de los 80 se descubre el primer retrovirus causante de leucemia linfoma T en el hombre de ahí toma su nombre Virus de la leucemia/linfoma T humana (HTLV-I). Posteriormente, se describieron otros retrovirus, esencialmente el HTLV-II que posee una homología en secuencia nucleótido de un 60% al compararse con el HTLV-I y finalmente, el virus de la inmunodeficiencia adquirida (VIH) [58-60].
Los retrovirus tienen envoltura que presentan un genoma de ARN monocatenario y se replican de manera inusual a través de una forma intermedia de ADN bicatenario. Proceso llevado a cabo mediante una enzima: la retrotranscriptasa o transcriptasa reversa, que dirige la síntesis de ADN a través de ARN y posee una importancia extraordinaria en la manipulación genética. Una vez se ha pasado de ARN monocatenario a ADN se inserta dentro del ADN propio de la célula infectada donde se comporta como un gen más .Por tanto, se incluyen en el Grupo VI de la Clasificación de Baltimore [58].
A pesar de la inmensa variabilidad entre los distintos tipos de retrovirus, podemos decir que la partícula viral se compone de:
Envoltura formada por una glicoproteína de superficie y una proteína de transmembrana (TM). Cápside viral e que incluye las proteínas de la matriz (MA), cápside (CA) y nucleocápside (NC). Enzimas como la Transcriptasa inversa (RT), proteasa (PR), Integrasa (IN), que son muy importantes para la replicación del virus.
Virus Linfotrópicos T 1 (HTLV-I) y 2 (VIH-2)
Existen dos Tipos [57] Virus Linfotrópicos T: HTLV I y HTLV II
HTLV I asociado a dos entidades:
-Leucemia de células T adultas (ATL)
-Paraparesia Espástica Tropical (PET)
El HTLV II no tiene una patología claramente definida aunque se lo ha asociado con diversos síndromes neurológicos, mielopatías subagudas y Leucemias atípica de células peludas.
HTLV-I
Los virus Linfotrópicos; T tipo I (HTLV-I) y tipo II (HTLV-II) fueron los primeros retrovirus identificados en seres humanos, en 1980 y 1982, respectivamente1, [58]. El HTLV-II se aisló en 1982 a partir de una línea celular de un bazo procedente de un paciente que había sido diagnosticado de tricoleucemia en una forma variante T. Debido a que tal proceso no se haya establecido ni reconocido como entidad, es muy probable que el paciente se hallara afecto de otro procesos linfoproliferativo T.
El virus Linfotrópico de células T humano es un retrovirus que pertenece a la familia Oncovirinae. El HTLV-I fue el primer retrovirus oncógeno humano conocido. Provoca una hemopatía maligna denominada Leucemia/Linfoma de células T del adulto (ATL) y desarrolla también una mielopatía subaguda denominada Paraparesia Espástica Tropical (TSP) ó mielopatía asociada al HTLV-I [59,60]. El HTLV-II es un virus en busca de enfermedad, no tiene una patología claramente definida aunque se lo ha asociado con diversos síndromes neurológicos y mielopatías subagudas.
Los principales mecanismos de transmisión de la infección por virus HTLV son por vía sexual, vía parenteral y vía vertical.[58-62]
-Transmisión Vertical: infección intrauterina, ocurre principalmente a través de la lactancia. Las tasas reportadas de transmisión de HTLV-1 a través de lactancia materna fluctúan hasta 37,5%, dependiendo de factores como la edad materna, la duración de la lactancia y la carga proviral materna.
-Transmisión parenteral: El riesgo de transmisión de HTLV-1 a través de transfusiones sanguíneas se ha estimado entre 50 y 60%. El riesgo disminuye cuando la sangre se mantiene almacenada más de una semana No se ha descrito la transmisión del virus a través de la transfusión de componentes acelulares.
-Transmisión sexual: La infección por HTLV-1 puede ser considerada como una enfermedad de transmisión sexual (ETS). El virus ha sido aislado en el semen y secreciones cervicales y la infección es más frecuente en grupos de riesgo para ITS.
Las Vías de Transmisión del HTLV-II son similares [62] a los del HTLV-I si bien, debido a que su distribución es muy diferente a la del HTLV-I, el uso de jeringuillas y transfusión son las principales vías para la transmisión del HTLV-II.
Epidemiológicamente [62] se ha encontrado Estudios serológicos iniciales demostraron que el HTLV-I es endémico en Japón, especialmente en la región Sudoeste y en poblaciones de 3ancestro africano de las islas del Caribe. Durante la década de los 80 y principios de los 90 se ha demostrado que este retrovirus se halla mucho más extendido, documentándose una seroprevalencia alta así como su patología asociada en: África Central y Oeste, Irán -, Sudamérica Brasil, Perú, Chile, Colombia y en menor proporción en Argentina y Venezuela, Melanesia. No existe un foco evidente en Europa aunque es probable que el virus se halle en algunos países tales como Rumania. En España, el HTLV-I y la LLTA se han observado, esencialmente, en unos pocos pacientes de origen latinoamericano.
Se calcula que en el mundo hay de 11 a 20 millones de personas infectadas con HTLV-I. El HTLV-II posee una distribución mundial muy diferente al del HTLV-I [60]. Es endémico en tribus amerindias de América del Sur y Central en donde la seroprevalencia puede alcanzar niveles de hasta un 30% así como en pigmeos africanos del Zaire y Camerún. En países desarrollados el HTLV-II se detecta casi exclusivamente en drogadictos, en su mayoría coinfectados con VIH.
Cuadro clínico.[60-63]
Por lo general el paciente permanece asintomático.
Aunque casi todos los individuos infectados permanecen asintomático, el impacto de la infección viral en áreas endémicas es significativo porque el HTLV-I es el agente etiológico de dos condiciones bien definidas:
Leucemia/linfoma de células t del adulto (ATLL) .La relación entre el HTLV-1 y ATLL fue identificada al aislarse el virus integrado en células neoplásicas. ATLL es clásicamente una forma de leucemia de curso agudo con pobre espuesta a quimioterapia que afecta principalmente a varones entre los 50 y 60 años, aunque en otras áreas el promedio de edad es menor. Se han descrito también formas menos agresivas cuyo comportamiento clínico semeja el de un linfoma, de curso más bien crónico y con compromiso dérmico extenso.
Paraparesia espástica tropical (PET): El término PET fue propuesto en 1969 para describir un cuadro neurológico de etiología entonces desconocida, observado inicialmente en áreas tropicales y caracterizadas por paraparesia crónica progresiva. En 1985, se reconoció la asociación entre dicha entidad clínica y la infección por HTLV-1, proponiéndose posteriormente como nueva denominación «mielopatía asociada a HTLV-1/paraparesia espástica tropical». No todos los cuadros de PET (definidos de acuerdo con los criterios diagnósticos propuestos por OMS) se asocian a HTLV-1. Se ha aceptado que la patogénesis de PET se basa en mecanismos inflamatorios. Donde múltiples citoquinas son liberadas en respuesta a la presencia de proteínas virales en la superficie de linfocitos infectados, lo cual genera inflamación crónica y daño tisular. Se afectaría así la parte dorsal de la medula espinal, con la aparición simétrica gradual y progresiva del cuadro de paraparesia simétrica con signos de compromiso piramidal. En una minoría de casos, los síntomas neurológicos progresan rápidamente por factores no del todo aclarados, entre los cuales se ha postulado la mayor edad al inicio de los síntomas, los títulos mayores de anticuerpos contra HTLV-1 y la carga proviral elevada.
Diagnóstico [61-64]
El diagnostico de confirmación se realiza en sangre y en LCR al detectar anticuerpos HTLV. ELISA
Westerblot: confirma los resultados reactivos de ELISA haciendo diferencia entre HTLV I y II, detectando los anticuerpos
Reacción en cadena de polimerasa para detectar genoma viral; muestras positivas: los resultados son Ac. tanto del gag (p24) como env (gp46) nativo o gp (61/67/68).
No se ha establecido de forma concluyente un vínculo entre el HTLV-II y un tipo de neoplasia humana. Tras su identificación en la línea celular, ha sido documentada mediante ELISA una serología positiva para el HTLV-II en una proporción de pacientes con leucemia de linfocitos granulares (LLG) así como, mediante PCR, se han detectado secuencias de HTLV-II en las células de unos pocos individuos con esta leucemia.
No existe protocolo establecido para el tratamiento de esta enfermedad, se ha informado que el uso prolongado de esteroides sistémicos ofrece un beneficioso. La combinación de antirretrovirales, como lamivudina y zidovudina ha tenido un éxito relativo. Rehabilitación.
Es oportuno mencionar que se han descrito la presencia de condiciones autoinmunes [65-66] en pacientes con HTLV-1 y en especial entre los pacientes coafectados con PET, entre ellas el síndrome de Sjögren, uveítis, artritis, enfermedad de Behçet y tiroiditis.
Hasta hace muy poco, el HTLV-II no se había asociado claramente con alguna enfermedad específica. Hoy, es posible que este virus sea también responsable de PET/MAH6 y de algunos cuadros neurodegenerativos crónicos. Relaciones sexuales protegidas.
Existe evidencia de que el Virus Linfotrófico Humano Tipo I (HTLV-1) puede ser disparador y perpetuador de enfermedades inflamatorias crónicas y específicamente en AR [64]. En estudios realizados para este fin los autores concluyen que sus hallazgos epidemiológicos soportan la idea de que la infección por HTLV-I es un factor de riesgo para la AR -I21.
Virus de Inmunodeficiencia Humana. (VIH)

Retroviridae [65] es una familia de virus que comprende los retrovirus. Son virus con envoltura que presentan un genoma de ARN monocatenario y se replican de manera inusual a través de una forma intermedia de ADN bicatenario. Este proceso se lleva a cabo mediante una enzima: la retrotranscriptasa transcriptasa inversa, que dirige la síntesis de ADN a través de ARN y posee una importancia extraordinaria en la manipulación genética. Una vez se ha pasado de ARN monocatenario a ADN se inserta dentro del ADN propio de la célula infectada donde se comporta como un gen más, se incluyen en Grupo IV de la clasificación de Baltimore.
Virus de Inmunodeficiencia Humana
La era del sida comienza el 5 de junio [65], en 1984, dos científicos, el Dr. Robert Gallo en los Estados Unidos y el profesor Luc Montaner en Francia, aislaron de manera independiente el virus que causaba el sida y en 1986 el virus fue denominado VIH (virus de inmunodeficiencia humana). Los dos investigadores compartieron el Premio Príncipe de Asturias por aquel hallazgo. Después de años y años de polémica y litigios acerca de la paternidad del virus del SIDA, el Nobel de Medicina premió el hallazgo del VIH otorgando el galardón al Dr. Luc Montagnier y a la Dra. Françoise Barré-Sinoussi, que en la primera mitad de la década de los ochenta trabajaban en el Instituto Pasteur de París, aún cuando en 1987 se pactó que se consideraba a ambos científicos "codescubridores" del virus. Robert Gallo felicitó a Luc Montagnier "Estoy agradecido al haber leído en la declaración de Montagnier esta mañana que yo también lo merecía" declaró.[66]
El Síndrome de inmunodeficiencia humana SIDA (acrónimo de síndrome de inmunodeficiencia adquirida, del inglés AIDS) es una enfermedad caracterizada por presentar deterioro grave del sistema inmunológico y daño a órganos y tejidos debido a la acción directa del virus [66]. El SIDA representa la etapa final de la infección, para llegar a ella la infección tiene que
El virus pertenece a la familia de los Retrovirus y a una subfamilia conocidos como Lentivirus, que almacena la información hereditaria de una forma especial de ARN no compatible con el sistema celular, por ello deben transcribir su información a ADN compatible con la celula.Debido a que habitualmente la información genética en la naturaleza viaja de ADN a ARN la enzima viral que convierte este flujo, se denomina reverso transcriptasa. Ningún otro virus ha recibido tanta atención por parte de los medios de comunicación y la opinión pública en general como el llamado virus de la inmunodeficiencia humana. Es un virus citopático.Los investigadores franceses bautizaron como LAV (virus asociado a linfadenopatía), mientras que el grupo estadounidense decidieron rebautizarlo como HTLV-III (virus Linfotrópico humano tipo III).
VIH
Existen dos virus diferenciados que causan sida en los seres humanos, el VIH-1 y el VIH-II [55,56].Ambos virus producen el SIDA, pero tiene diferencias desde el punto de vista antigénico en el genoma viral y en cuanto a la respuesta inmune de la infección.
VIH I se encuentra en todo el mundo, donde coexisten las dos infecciones, la prevalencia siempre es mayor en éste, una enfermedad no produce inmunidad contra la otra por lo ambos tipos de virus pueden coincidir en la misma persona. Ambos virus producen el mismo defecto inmune y están asociados a una enfermedad celular, sin embargo clínicamente la infección por VIH tipo I progresa más rápido y por lo tanto lleva más rápido al individuo a la muerte.
VIH tipo II se encuentra restringido a determinadas regiones y su evolución clínica es más lenta. Hasta la fecha, la infección por HIV-2 sigue limitada a los países del África Central y es muy raro encontrarlo en otras partes del mundo
Vías de transmisión. [60,67,68]
Sexual (homosexual y bisexual): Es la forma más importante de transmisión, más común de hombre a mujer, la transmisión homosexual de hombre a hombre es más común que la de mujeres. Una sola relación sexual no necesariamente transmite la infección.
Vertical: más frecuente cuando ambos padres son seropositivos, más frecuente durante el parto y menos frecuente en la casarea.Las infecciones transplacentarea alcanzan casi de un 30 a 50%. Factor de Riesgo Incrementado de la Transmisión Perinatal
La probabilidad de transmisión se relaciona directamente a la carga viral. Si la carga viral está por debajo de los valores estándar las probabilidades de transmisión son muy bajas.
El 75% de las Transmisiones Perinatales tienen lugar en las últimas semanas del embarazo. Solo un 10% se producen antes del tercer trimestre. La mayoría de las infecciones por transmisión vertical ocurren alrededor del momento del parto y el parto prematuro, el embarazo múltiple y la rotura prematura de las membranas son también factores de incremento del riesgo de transmisión perinatal .Se suprime la producción de leche, y con ello la lactancia, e incluso se da tratamiento antiviral al recién nacido.
Sanguínea: Se presentan en uso de drogas, receptores de sangre, receptores de órganos y personal de salud que no cumplen las normas internacionales establecidas para trabajar con líquidos o tejidos corporales.
Patogenia:
1) Contagio: Puede ser a través de un paciente con infección primaria, posiblemente silente o con Síndrome Mononucleósico, un paciente seropositivo, o un enfermo SIDA.
2) Transmisión: Por contacto sexual (80%), sangre y hemoderivados (18%), vía vertical (madre-hijo) (30 a 50 %).
3) Infección Primaria: Aparece entre 3-6 semanas posterior al contagio, puede cursar silente o tener evidencias clínicas que persisten entre 1 semana y 3 meses, no hay aún respuesta inmune (seronegativa), por tanto, escapan a los métodos todos de pesquizaje (ELISA-VIH Ac negativos), pueden transmitir la infección (“Ventana Epidemiológica) . Se detecta solo con Elisa para antígenos (Ag) y cultivo (Métodos poco prácticos y escasamente sensibles).
4) Ataque del VIH a las células diana: Representadas por linfocitos T , subpoblación auxiliar/ inductora, monocitos/macrófagos, linfocitos grandes y granulosos y células del SNC ( astrocitos y macroglia), todo mediado por el acople de la gp 120 viral con la molécula CD4 y en presencia de quimoquinas y sus receptores (CXCR4, para los linfocitos y CCRR3 para los macrófagos) o también mediante un galactocerebrósido como "receptor) alternativo, en presencia de Ag de la clase II del Complejo Mayor de Histocompatibilidad (CMH).
5) Seroconversión: Es la existencia demostrable de una respuesta inmune (RI); Elisa para Ac/VIH y el Western-Blot son positivos, aparece entre 6-12 semanas, es decir, 6-9 meses después de este.
6) Latencia clínica: Periodo de incubación, puede durar 2-10 años y más, las células están infectadas con respuesta inmune aceptable. La celular inducida por patrón T auxiliador Th1, mediada por interleuquinas (IL) – 12 y el interferón gamma (ITF gamma). La humoral inducida por patrón Th2 y mediada por IL-4-5-6-10, no protege al individuo del avance de la infección.
7) SIDA: El influjo de coofactores, tanto ambientales como reguladores del propio virus producen la transactivación, las células infectadas y estas se convierten en verdaderas “fábricas “del virus. El patrón de respuesta T auxiliar se desplaza de Th1 a Th2 con predominio de la inmunidad humoral, aumentan las IL-4-5-6 y 10, se activan mecanismos contra los LT CD4 activados como:
a) Efecto citopático directo mediado por el VIH.
b) Formación de sincitios.
c) Citotoxicidad dependiente de Ac contra el VIH.
d) Mecanismos autoinmunes.
e) Alergia a cualquier estimulo antigénico.
f) Disfunción de los LT CD4 por un súper antígeno. Todo esto conlleva a la depleción cualitativa y cuantitativa de los LT CD4
Clínicamente [67,68] la epidemiología del SIDA también demuestra que existe un largo periodo de latencia que ha sido estimado entre 8 y 15 años, entre la infección primaria por HIV y el desarrollo del SIDA. Indica una profunda alteración de los mecanismos de la inmunidad celular la enfermedad evoluciona con una infección aguda primaria o síndrome de seroconversión aguda, con manifestaciones generalizadas y una vez ocurrida la infección los síntomas pueden presentarse entre 3 y 10 meses fiebre, adenopatía, faringitis rash, mialgias, artralgias, diarreas, cefalea, náuseas, vómitos, hepatoesplenomegalia entre otras.
Las manifestaciones de meningitis, neuritis, parálisis facial, son menos frecuentes pero pueden aparecer y con frecuencia hay linfocitosis con depleción de células TCD4, aumento de CD 8 y linfocitos atípicos. La seroconversión llega en 3 a 12 semanas posterior a la transmisión, seguida de un período clínico latente con o sin adenopatía persistente generalizada.
El complejo relacionado SIDA (candidiasis oral, Leucoplasia pilosa oral, neuropatía periférica, displasia cervical, Guillain Barré, síntomas constitucionales, zóster recurrente, púrpura trombocitopenica idiopática y listeriosis, nocarditis, tuberculosis pulmonar.
SIDA propiamente dicho conteo de CD4 por debajo de 200 células /mm.
Infección avanzada conteo de CD4 menor de 50 células /mm de sangre .con promedio de vida de hasta 18 meses .Casi todos los pacientes fallecen con complicaciones relacionadas al VIH. Sarcoma de Kaposi, linfoma primario del SNC
Indicativo de sida:
Menos de 200 células /mm3.
Candidiasis esofágica, tráquea, bronquio, pulmones; cáncer cervicouterino; coccidoidomicosis y cryptococosis extra pulmonar, Citomegalovirus, herpes simple, histoplasmosis extra pulmonar, demencia asociada a VIH, pérdida de peso de más del 10% más diarreas crónica y fiebre por más de 30 días; sarcoma de Kaposi en pacientes por debajo de 60 años; linfoma de Hodgkin de células B o linfoma inmunoblástico; complejo Micobacterium avium ó kansasii diseminado; Micobacterium tuberculosis pulmonar diseminado;nocardiosis,neumonías por Pneumocystis carinii, neumonía bacteriana recurrente,leucoencefalopatía multifocal progresiva, septicemias por salmonella, Strongyloidosis intestinal, toxoplasmosis de órganos internos, síndrome de desgaste asociado al VIH, Síndrome de Wasting .En general se han descrito toda una constelación de síntomas y gérmenes asociados al SIDA
Diagnóstico.[67-69]
El diagnóstico se realiza a través de la clínica, y los exámenes de laboratorio. ELISA (enzyme linked inmuno sorbent assay)-HIV y Western Blot. Sn métodos serológicos que detectan anticuerpos contra el virus.
PCR del material genético del HIV, y cultivo viral. Western Blot (WB): separa las proteínas del HIV y se analizan con anticuerpos específicos para cada fracción proteica; es la prueba confirmatoria. La prueba del Western Blot permite demostrar la existencia de anticuerpos específicos contra todas y cada una de las proteínas estructurales del HIV. El Western Blot positivo confirma la infección por HIV. El primer examen que se hace positivo después del contagio es la cuantificación viral, luego antígenos virales específicamente p24 y, finalmente, en un período entre 4 a 12 semanas post infección, aparecen los anticuerpos específicos. Detecciónanticuerpos anti HIV (Enzyme linked immunosorbent assays: ELISA) fundamental para la pesquisa, detecta anticuerpos contra todas las proteínas virales, en especial p24, gp41, gp120 y gp160. El examen tiene una sensibilidad y especificidad de 99,9%.
Se han descrito que pueden existir falsos-positivos en presencia de algunas de estas situaciones hepatopatía alcohólica, trasplante renal, linfoma, factor reumatoideo, inmunidad pasiva, embarazo con sensibilización materna por antígenos fetales HLA-actina entre otros. También se han descrito falsos negativos cuando el paciente está en periodo de ventana, bajo tratamiento con inmunosupresores o presencia proceso maligno.
Tratamiento [68-73]
Preventivo:
1. Control y vigilancia epidemiológica: Serodetección, reporte de los casos sospechosos y confirmados.
2. Educación y divulgación: Usar preservativo y evitar la promiscuidad y el coito anal.
3. Educación y orientación a seropositivos.
4. Vacunación: No disponible hasta el momento. Todas las vacunas en fase de desarrollo.
5. Medidas de Bioseguridad.
Tratamiento Médico.
1. Uso de fármacos antiretrovirales.
1. Inmunomoduladores.
2. Manejo integral Psico-social.
Indicaciones para la terapia antirretroviral
Antirretrovirales.
Inhibición de la enzima reversotranscriptasa. Se usa cuando el CD4 es <500 cel. por mm3 en la población no gestante. Esta inhibición puede ser:
Competitiva: análogos de nucleósidos
Zidovudina, ZDV, AZT, Retrovir. 600mg/día.
Didanosina, DDI, Videx 400 mg/día si más de 60 kg de peso.
Zalcitabina, Hivid, DDC, o, 75mg/ 3 veces día.
Stavudina, D4T, Zerit 80mg /día si más de 60 kg de peso.
Lamivudina, Epivir 300 mg/día.
No competitiva: (no análogos de nucleósidos)
Nevirapine, Viramune 400mg/día.
Delavirdine, Rescriptor 400mg/3 veces al día.
Efavirenz 800 mg /3 veces al día.
Inhibidores de Proteasas. Inhiben la proteasa del virus, junto a las inhibidoras de la transcriptasa reversa, tienen alto porcentaje de éxito en la disminución de la carga viral, aumento de CD4, disminución de la progresión clínica y aparición de resistencia al virus. Ritonavir, Norvir 400mg/3 veces al día.
Indinavir, Crixivan 800mg/3 veces al día.
Saquinavir: Invirase 600mg/3 veces al día y Fortobase 1200mg/3 veces al día.
Se han utilizado también:
Inmunomoduladores.
a) Interferones: alfanatural, alfalinfoblastoide alfarecombinante, ganmainterferón.
b) Indometacina y cimetidina: Utiles en la supresión relativa de macrófagos y células T respectivamente.
c) Factor estimulante del crecimiento de los granulocitos (G-CSF).
d) Sales de litio.
e) Eritropoyetina humana recombinante (V-Hv EPD).
En la embarazada existe clara evidencia de que ZDV reduce la transmisión perinatal de 25% a 7%, por lo que se usa independientemente del nivel de CD4, aun cuando se ignora si es efectivo en pacientes con bajo nivel de CD4.
En las embarazadas el número de Linfocitos CD 4 disminuye en 10 - 20%, lo que incrementado de la transmisión perinatal. La probabilidad de transmisión se relaciona directamente a la carga viral. El 75% de las transmisiones perinatales tienen lugar en las últimas semanas del embarazo y solo un 10% se producen antes del tercer trimestre. La mayoría de las Infecciones por transmisión Vertical ocurren alrededor del momento del parto. Los neonatos de madres sin tratamiento Antirretroviral nacidos por cesárea electiva tienen un 50% menos de tasa de infección en comparación con los nacidos por la vía transpelviana. El parto pretérmino y la rotura de membranas constituyen también factores de riesgo para la transmisión perinatal. Los neonatos de madres sin tratamiento Antirretroviral nacidos por cesárea electiva tienen un 50% menos de tasa de Infección en comparación con los nacidos por la vía transpelviana.
Evitar en seropositivas: Monitorización Fetal con Electrodos, Ruptura Temprana de las Membranas, toma de muestras de sangre fetal, amniocentesis, episiotomía, parto vaginal.
Profilaxis: Iniciar tratamiento antirretroviral lo antes posible, realizar cesárea electiva, tratamiento antirretroviral en el recién nacido, no permitir lactancia materna.
Se han dado a conocer una serie de factores de riesgo para la transmisión perinatal dentro de los cuales se mencionan madre enferma sintomática de SIDA, parto vaginal, bajo conteo de Linfocitos CD4, elevada carga viral materna, trabajo de parto con evolución superior a 4 horas, rotura de membranas ovulares mayor de 4 horas, embarazo múltiple, recién nacido pretérmino y lactancia materna entre otros.
Se ha propuesto dentro de la profilaxis una captación temprana del embarazo identificar los factores de riesgo e iniciar tratamiento antirretroviral oportuno.la forma de concluir el embarazo debe ser por cesárea electiva, no se debe permitir la lactancia materna y se debe valorar la terapia antirretroviral al bebé.
Regímenes combinados deben ofrecerse a todas las gestantes seropositivas con independencia de la carga viral y están iindicados en presencia de una Carga viral > 10,000 copias/ml, desde las 32 semanas hasta inmediatamente después del parto Según CDC del 2005 la TAR en embarazadas asintomáticas se debe iniciar cuando el conteo de CD 4 esté por debajo de 200-350 células/mm3 y/o una Carga viral > 50,000 - 100,000 copias/ml de VIH RNA.
Realizar pruebas de resistencia viral previa terapia y tener en cuenta que AZT debe ser un componente de la terapia, mono o combinada, se contraindica solo si se comprueba resistencia viral. Debe evitarse Efavirisenz e Hidroxiurea durante el primer trimestre, posibles drogas teratogenicas. No usar la combinación DDI + D4T, produce severas mitocondriopatias.
AZT Monoterapia en 3 Fases
Prenatal (A partir de las 32 semanas), Periparto en infusión endovenosa.
Post Natal (Primeras 2 - 4 Semanas (Neonato)) Manejo de la Gestante Enferma de SIDA con TAR previa.
Captación después de las 12 semanas TAR continúa sin interrupción, añadir AZT a partir 32 semanas. Peligros para la madre y el feto.
Captación Precoz menos de 12 semanas Interrumpir TAR Hasta después de las 14 semanas Situación clínica, inmunológica y virológica. Supuestos efectos sobre el feto. Peligro de resistencia.
La gestante con sida enferma que llevo tratamiento con TAR que se capta después de las 12 semanas corre peligro la madre y el feto. TAR continúa sin interrupción, añadir AZT a partir 32 sem.
Protocolos Combinados: Protocolo PETRA
A- NRTIs + AZT + 3TC profilaxis poco efectiva.
Regímenes TARMA
Una opción dentro de estas drogas: Indinavir, Nelfinavir, Ritonavir + Saquinavir combinada con una de las siguientes AZT + 3 TC; AZT + Didanosine; Stavudine + 3 TC .Tiene como ventaja aumentar la concentración de los linfocitos CD4, previene transmisión vertical, disminuye la carga viral, no toxico para el feto, aunque no siempre ocurre así, los tratamientos incompletos desarrollan resistencia y no son infrecuentes las intolerancias a los antirretrovirales
Las mejores medidas para reducir el riesgo de infección por HIV son: verificar que la sangre y derivados de sangre utilizados con fines médicos (para transfusiones, etc.) se encuentren libres de contaminación por HIV; evitar el uso de drogas intravenosas y otros procedimientos que impliquen el intercambio de materiales e instrumentos potencialmente contaminados con sangre o células infectadas; evitar la promiscuidad sexual y utilizar condones durante el acto sexual. Hasta el momento no hay vacuna disponible con este fin.
Virus del Papiloma Humano (HPV)
Condilomatosis

Data en la literatura apuntes sobre su existencia desde la era helenística, hace más de 2.500 años, aunque la naturaleza infecciosa sólo fue sospechada por Ciuffo, a principios del siglo XX, en 1970 se da a conocer el primer genoma del papilomavirus clonado en bacteria, 1976 se identificó el primer tipo de HPV genital y más tarde en 1981 se reporta la detección de HPV en las neoplasias cervicales. En la década de los 90 se demuestra que el 100% de los carcinomas de células escamosas del cuello y más del 70% de los adenocarcinomas son asociados con la presencia de ADN de HPV. La lesión clásica que producen estos virus conocida como condilomas deriva del griego y significa Nudillo.
Papovavirus [61-65] es en pequeños virus de DNA. Talla de 52-55nm, epiteliotropo, con cápside isoeléctrica de 72 capsomeras, que contiene dos proteínas L1 y L2 con simple molécula de DNA circular de doble cadena, asociada a histonas. Las variaciones en la secuencia genética terminan el trofismo y el potencial de la enfermedad. En nuestros días se conocen más de 150 subtipos de PVH identificados hasta la actualidad, solo 45 de ellos infectan los genitales de ambos sexos; 6, 11,16, 18, 26,30, 31, 33, 34, 35, 39, 40, 42, 43, 44, 45, 51, 52, 53, 54, 55, 56, 57, 58, 59,66, 68, 73 y 82.
Teniendo alto poder oncogénico los subtipos: 16,18,31,33,35,39,40,45, 51, 52, 56,58, 59, 68, 73,82. Algunos como el 26- 53- 66 son muy raros.
Se han encontrado lesiones por HPV en vulva, uréter, tráquea, vagina, ano, bronquios, cérvix área perineal, cavidad nasal, uretra, periné, esófago, pene, lengua, escroto, cavidad bucal, piel, vejiga, laringe, conjuntiva entre otras.
La infección por HPV se ha convertido en la ITS de mayor incidencia y desde hace unos años, su prevalencia se ha desplazado cada vez más hacia la adolescencia. Las nuevas técnicas diagnósticas, basadas en biología molecular (mediante reacción en cadena de la polimerasa), ayudan a una mejor aproximación epidemiológica, una mejora en el diagnóstico viral, y un correcto enfoque terapéutico [61]
En un reporte de la OMS se reporta teniendo en cuenta edad de riesgo y tipo de HPV en Mujeres. [62]

Los subtipos 16, 18, 31, 35, 39, 45, 51, 52, 56 y 58 se encuentran con mayor incidencia en África América Latina, HPV 16 en América y los subtipos 33,39 y 59 Centroamérica y Suramérica [62].
Están dentro de las primeras 10 causas de dermatosis más frecuentes, afecta todas las razas, sexo y edad. Anualmente las cifras de Infecciones por HPV se incrementan a 500,000 – 700,000 casos en todo el mundo. Estudios epidemiológicos han mostrado que existe una fuerte asociación entre el HPV y el Cáncer cervical independientemente de los factores de riesgo [63,66,67],
Las NIC: células con múltiples grados de maduración y diferenciación en el epitelio cervical con morfología similares a las células cancerosas. Histológicamente se han descrito la displasia Leve, moderada y el Carcinoma in Situ y constituyen solo estepa previa a la enfermedad.
Richard en 1967 clasificó las displasias en:
NICI (Infección PVH. Displasia Leve)
NIC II (Displasia Moderada)
NIC III (Displasia severa) .Bethesda en 1990 simplificó la clasificación donde histológicamente NIC I es lesión de bajo riesgo y NIC II/III son LIE lesiones de alto riesgo.
Se han planteados factores de riesgo para la infección por HPV dentro de los más importantes se encuentran [74-78]
Conducta sexual: Se considera el principal factor de riesgo. El inicio precoz de relaciones (antes de los 20 años).
Múltiples parejas. El número de compañeros sexuales aumentan el riesgo de cáncer cervicouterino Se ha demostrado la presencia de VPH cervical o vulvar en un 17-21% de las mujeres con una pareja sexual y en 69-83% de las mujeres con 5 o más parejas sexuales Sistema Inmunológico Deprimido Varón de alto riesgo Factores genéticos moleculares: p53 Multiparidad Otras ITS Contraceptivos orales. Factores nutricionales Historia familiar de infección por HVP Tabaquismo Estopia y Cervicitis Crónica.
Se han asociado además los tipos de verrugas y con los sub tipos de HPV causante de la misma.

En el hombre se han descrito relación entre formas clínicas, poder oncogénico y genotipo [79-84].

Vías de Transmisión.
Sexual
A partir de verrugas comunes por autoinoculación Hospitalaria (guantes, pinzas, biopsias)
Desde el punto de vista clínico la evolución de todas las variedades clínicas es crónica e impredecible. Pueden durar meses o años. En pacientes inmunodeprimidos las lesiones son abundantes o generalizadas, exuberantes y resistentes al tratamiento.
Papilomas plantares: Las verrugas plantares suelen ser algo dolorosas se diferencian de los callos por pérdida de la superficie.
Verrugas comunes: se presentan en las manos ocurren con variedad de colores son pápulas hiperqueratóxicas que sobresalen de las manos.
Las verrugas planas se aprecian con mayor frecuencia en niños y ocurren en la cara, cuello, tórax y superficies flexoras de los brazos y las piernas. Las lesiones se presentan como neoformaciones únicas o múltiples, aisladas o confluentes, hemisféricas, de superficie verrugosa, áspera, del color de la piel o grisácea, bien limitadas de hasta 1 cm, en el borde de la uña ocasionan distrofia ungueal y suelen ser dolorosas, mientras que en el borde palpebral son filiformes y a menudo relacionadas con queratoconjuntivitis. Asintomáticas e involucionan a los dos años aproximadamente.
Reciben el nombre de Condilomas cuando se presentan en la cara interna de los labios, son vegetantes y pueden crecer con rapidez, en los genitales son mas queratófidos y menos vegetantes. También llamadas ojos de pescado cuando se localizan interdigital o en la región plantar con color blanco amarillento, pueden tener zonas oscuras, asociada a la hiperhidrosis ocasionan mal olor, generalmente son dolorosas a la presión, que ocasiona la deambulación e involucionan en un año.
Las verrugas planas o Juveniles son pequeñas de hasta 4 mm poligonales o redondas que tienden a confundir con pápulas, tiene ligero relieve sobre la piel y por lo general poco eritematosas se localizan en la cara y dorso de las manos y no son dolorosas. Los Condilomas Acuminados, son producidos por los virus 6 y 11 son neoformaciones húmedas, vegetantes del color de la mucosa, de consistencia blanda, generalmente mal olientes.
Por pruebas epidemiológicas e inmunológicas, se ha establecido una relación entre los Condilomas y el cáncer genital, en especial el cervical, donde en el 90% se ha encontrado virus DNA de papiloma humano tipo 16, 18 y 31 y se ha mencionado con menos frecuencia los tipos 35 y 39. El recién nacido puede presentar papilomatosis laríngea: complicación grave poco común En mujeres, las lesiones afectan labios mayores y menores, clítoris, meato uretral, periné, zona anal, vestíbulo, introito, vagina y ectocérvix. La localización anal se asocia en muchas ocasiones a la práctica de sexo anal, y suelen ser más frecuentes en varones homosexuales. El meato urinario se afecta en el 20-25% de los varones y 4-8% de las mujeres. Los condilomas pueden diferenciarse en tres grandes grupos: Acuminados son lesiones en forma de "coliflor", con proyecciones digitiformes, muy vascularizadas y con distinto grado de queratinización. Las formas papulosas, habitualmente de color moreno y con características etiológicas e histológicas diferenciadas, suelen estar producidas por VPH-16 y tienen una histología "bowenoide", es la Papulosis bowenoide. Lesiones maculosas, pueden adivinarse por mínimos cambios de color en las mucosas genitales, la presencia de VPH se pone de manifiesto por la aplicación de ácido acético. Una forma poco habitual es el condiloma gigante de Buschke-Loewenstein, en el que coexisten patrones histológicos de condiloma acuminado junto a otras zonas de epitelioma espinocelular. Aunque en los niños, en más de la mitad de los casos la aparición de verrugas genitales es por transmisión perinatal o bien por heteroinoculación, no debe olvidarse que también pueden ser la consecuencia de abusos sexuales.
Mientras que en el hombre la presencia de condilomas acuminados o verrugas genitales, suelen localizarse en el surco balanoprepucial, corona de glande, frenillo, dorso del pene y a veces en el meato uretral y/o en la fosa navicular. Menos frecuentes son los condilomas planos. La Balanopostitis, se aprecian alteraciones inflamatorias en el pene con apariencia muy similar a las originadas por Cándida albicans, en las que se detecta el ADN viral. La infección subclínica, se expresa en lesiones acetoblancas en la penescopia o genitoscopia con amplificación mediante lupa, con una solución de ac. Acético al 5% durante 3-5 minutos. Se presentan la mayoría de los hombres cuyas parejas femeninas tiene infección por VPH. Al ser una infección multifocal hay que considerar también puede afectarse la zona anogenital. No es infrecuente el hallazgo de VPH en varones sin ninguna sintomatología incluso sin lesiones acetoblancas ni alteraciones citológicas lo que nos llevaría al concepto de portador asintomático [72]. La papulosis bowenoide [13] y otras lesiones precancerosas, como la Eritroplasia de Queirat se han descrito respecto al papel del VPH en los tumores urogenitales, la asociación entre infección por VPH y el cáncer genital femenino, en concreto del cervix uterino, ha impulsado el estudio de su participación en otros tumores urogenitales, y en concreto en el cáncer genital masculino.
Está demostrado que el virus del papiloma humano tiene relación con la génisis del cáncer de cérvix y se postula que la infección latente propio de los virus ante determinada características ,en este caso ante la infección por un HPV de alto riesgo , inmunodepresión y presencia de los factores de riesgo mencionados con anterioridad puede reactivar la infección donde se necesitan técnicas de Hibridación del D.N.A del PVH para su diagnóstico, estas pasa a un estado de infección subclínica donde las lesiones no se aprecian y se produce en contagio, donde se precisa de solución de acido acético para visualizar a través de un colposcopio a los condilomas planos múltiples y aplanadas en cualquiera de sus localizaciones , Cérvix, Vulva, Vagina o Pene, estas lesiones difieren de las lesiones clínicas que son inconfundibles para el personal que está familiarizado con ellas pues constituyen las llamadas "cresta de gallo". En esta forma clínica los condilomas acuminados, toman aspecto exofíticos, es el de pequeñas neoformaciones sésiles, papilares, múltiples, en forma de crestas, cubiertas por epitelio queratocico relacionada sobre todo con subtipo de HPV 6, y en menor grado con el subtipo [71].
En el cáncer de pene [83-85], los datos existentes apoyan el papel etiológico de la infección por VPH, y al igual que ocurre en el cáncer genital femenino, los genotipos mas asociados son el 16 y el 18. Al igual que en cáncer de cervix uterino, existen otra serie de factores que colaboran con VPH en la génesis del cáncer de células escamosas de pene; el tabaco, la inmunosupresión, y la deficiente higiene genital.
En relación al cáncer anal [86] parece existir una clara relación entre este y los VPH con genotipos 16 y 18, sobre todo en enfermos homosexuales VIH. Son muy contradictorios los estudios que sugieren la relación de VPH con el cáncer de vejiga y próstata y muy escasos respecto a otras localizaciones tumorales genitales [87].
Existe otra faceta de la participación del VPH en la patología humana y hace referencia a su presencia en el semen. La existencia de genotipos de bajo y alto riesgo de VPH en el semen ha sido demostrada; es probable que el semen se pueda contaminar por VPH de localización uretral(al igual que ocurre con Herpesvirus y Citomegalovirus) en el momento de la eyaculación, pero también es cierto que su existencia ha sido detectada en el 18.5% de muestras obtenidas quirúrgicamente durante vasectomías. La consecuencia de estos hallazgos es múltiple, las muestras de sémenes obtenidas de varones sin aparente VPH pueden ser utilizadas para fertilizaciones in vitro y producir de forma iatrogénica una ETS en la mujer receptora. Por otro, el lavado del semen no asegura la eliminación de las partículas virales vehiculadas por los espermios, y estos pueden transportar ADN viral dentro de los óvulos a fertilizar no pudiéndose descartar que pudiera afectar a su implantación en el útero así como al desarrollo posterior del embrión [88].
Diagnóstico
Inspección simple Colposcopia (condilomas planos) Citología exfoliativa (coilocitos y disqueratocitos) Estudio Histológico (biopsia dirigida) Métodos inmunohistoquímicos Métodos serológicos Técnicas de hibridación del HPV.
Considerándose la colposcopia y la biopsia necesario para el diagnóstico de infección por HPV. En varones se utiliza una solución de ácido acético al 5%, que es mantenido durante 5 minutos.
Tratamiento de la Infección por HPV [86,89,90]
Como toda ITS tiene un tratamiento profiláctico que incluye actuar sobre los factores de riesgo, tener relaciones sexuales protegidas (condón), uso de vacunas.
La mayor parte de las infecciones por PVH se resuelven de forma espontánea y sin consecuencias.
En el tratamiento médico siempre es expectante y se recomienda vitaminoterapia pues ya conocemos que la mayoría de las lesiones curan de forma espontanea, aunque existen determinadas condiciones en una misma paciente que hay que tomar decisiones terapéuticas en primera instancia (dentro de estas estarían la no correlación citología-colposcopia- histológica, imposibilidad de seguimiento posterior, patologías ginecológicas asociadas, presencia de múltiples factores de riesgo).
Existen varias alternativas de tto si las lesiones no regresan, progresan o se transforman y entonces el tratamiento sigue siendo conservador pero teniendo en cuenta muchas circunstancia como posibilidad de curación espontanea, localización y tamaño de la lesión, riesgo oncogénico entre otras). El tratamiento debe ser conservador con seguimiento por colposcopia, se usan tópicamente o local agentes citotóxicos ó químicos (No Invasivos) como podofilina al 20,25%, antimitótico, muy tóxico, podofilotoxina al 0,5%, crema de 5 fluoracilo en crema antimitótico, antiblastico y quimioterapico se recomienda su uso en las mucosas; es altamente toxico y puede provocar úlceras, ácido Tricloroacético al 90 % cáustico potente, nitrógeno líquido.
Los métodos físicos (Invasivos) como electrocoagulación, cauterización y criocirugía. Los métodos escisionales lo conforman el láser de CO2, el asa diatérmica y bisturí frío que se reserva este último solo para cuando la lesión no responde otros tratamientos .Por último mencionaremos el tratamiento inmunológico que se realiza con inmunomoduladores de la talla del Levamisol tabletas de 150 mg,inmunoferón (500mg) capsulas o granulados,factor de transferencia e interferones con acción inmunomoduladores y antiviral y los modificadores de la respuesta inmunológica y biológica como imiquimot al 5 % antiviral en crema.
Vacunas que pueden ser profilácticas y terapéuticas.
Se recomienda seguir los casos con NIC I con colposcopia y citología cada 6 meses durante un período de tiempo de 2 años y de mantenerse negativos alta. Para cuando existe diagnóstico de NICII Y III entonces se recomiendan ambos procederes a los 3,6meses y los 12 meses el primer año, posteriormente cada 6 meses durante dos años y luego anual hasta los 5 años de permanecer negativa se dará el alta a la paciente, si en algunos de estos seguimiento aparece cambios o recidivas se procederá como corresponda con los hallazgos.
Virus del Molusco Contagiosos Humano (MCV-1 y el MCV-2)
Es un virus pox humano, que recibe el nombre de virus del Molusco Contagioso Humano, también fue llamado Molusco Sebáceo de Hebra y pertenece a la familia de Poxviridae con dos subtipos de virus el MCV-1 y el MCV-2, están dentro de los virus de mayor (150-300Mm), DNA de doble cadena y estructura compleja. En la clínica son iguales por lo que no se pueden distinguir uno del otro. El VMC-1 es el más frecuente y se presenta en cara, cuello, tronco y extremidades; generalmente en menores de 5 años. Es responsable del Molusco Contagiosos. [91-93]
Se distinguen tres clases dentro del grupo de los poxvirus:
- Ortopoxvirus: Incluye los virus de la viruela y de la vacuna.
- Parapoxvirus: Incluye los virus del orf o ectima contagioso y de los nódulos de los Ordeñadores.
- Grupo de poxvirus inclasificados entre los que se incluyen el virus del molusco contagioso.
Dentro de los virus causantes de molusco contagioso se han identificado dos tipos, el VMC 1 y el VMC 2, siendo el primero de ellos el responsable de la mayoría de las Infecciones.
Lesiones por molusco contagioso.
Vías de transmisión [91-93]
En adultos las lesiones en área genital constituyen una ITS y en pacientes inmunodeficientes se manifiestan en forma diseminada La transmisión ocurre por contacto directo y también es posible el contagio a través de fómites.
Cuadro Clínico
El período de incubación es de 2 a 7 semanas.
Clínicamente dermatosis benigna con lesiones con aspecto de pápulas cupuliformes de centro deprimido, de unos pocos mm hasta 1 a 2 cm, que se resuelven generalmente en forma espontánea entre 4 semanas hasta varios meses. Afecta cualquier parte de la piel cara, tronco, extremidades y parte baja del abdomen y las neoformaciones pueden ser, semiesféricos, duros, blanco, amarillo ó translúcidos umbilicados cuyo contenido es un material grumoso. Se ha descrito la reacción eccematosa perilesional (molusco-dermatitis). Producido por el Poxvirus es un cuadro muy frecuente en pacientes con algún grado de inmunosupresión, hasta el punto de que hoy en día se piensa que cualquier paciente adulto con molusco contagioso debe ser estudiado su estado inmunológico. Se caracteriza por micropápulas brillantes, de color piel, con umbilicación central, las cuales al “exprimirlas” dejan ver una secreción blanquecina saliendo por el centro, luego de una relación infectiva se localiza en pene, escroto y área púbica en el hombre y en vulva, zona anal, peri anal y pubis en la mujer. Son asintomáticas, pero tienden a autocontagiarse. Cuando se presenta en región genital, por lo general en el adulto, se considera enfermedad por transmisión sexual.
En los pacientes inmunodeprimidos, estas neoformaciones son de mayor tamaño y pueden observarse lesiones muy numerosas y de gran tamaño, localizadas preferentemente en la cara y región anogenital, donde las pápulas individuales confluyen formando grandes placas que pueden llegar a ser muy desfigurantes [93]. Incluso las lesiones individuales que permanecen como pápulas aisladas alcanzan gran tamaño y la presencia de lesiones de molusco contagioso gigante debe hacer pensar en la posibilidad de que el paciente esté infectado por el VIH.
El virus [93] Orf o ectima contagioso y el nódulo del ordeñador, son originados por virus pox de animales y se observan en pacientes que contactan lesiones o secreciones de ovinos o de bovinos infectadas, respectivamente. Se presentan como nódulos de más de 1 cm de diámetro, generalmente en las manos, asociado a linfadenopatía, linfangitis y fiebre. Evolucionan clínicamente en distintos estadios y son auto resolutivo en 4 a 6 semanas.
Diagnóstico [91-93]
Se realiza con la clínica y el citodiagnóstico (Cuerpos de Inclusión) hace el diagnóstico.
Test de Zanck que muestra los queratinocitos alterados con inclusiones intracitoplasmáticas, denominados cuerpo del molusco.
Tratamiento [94-96]
Extirpación con Aguja y Curetaje.
Aplicar crema EMLA (mezcla de lidocaína con pilocarpina) antes del curetaje.
Criocirugia
Ac. Tricloroacético Tretinoina 0.05%-0.1% KOH al 15% Para el tratamiento se utilizan técnicas quirúrgicas, sustancias citolíticas e inmunomoduladores. Existe un antiviral, el cidofovir, que ha mostrado utilidad en infecciones por virus pox.
No existe terapia específica, el objetivo es eliminar las lesiones de forma local o sistémica para prevenir la autoinoculación o el contagio a otras personas. Puede usarse curetaje, extracción con aguja, electrodesecación, crioterapia, parche con cinta adhesiva, medicamentos tópicos diversos, griseofulvina, cimetidina, metisazona.Realciones sexuales protegidas.
Virus Entéricos Humanos (HEV)
Si en las hepatitis se piensa poco como Infecciones de Transmisión Sexual en los virus entéricos se pinsa menos, o simplemente no se piensa.
Los enterovirus pertenecen a la familia Picornaviridae (pico: pequeño, RNA virus), son los agentes virales asociados con mayor frecuencia a meningitis aséptica y miocarditis aguda, además de ser causa frecuente de enfermedades respiratorias leves como el catarro común, meningoencefalitis y parálisis, entre otras. Están asociados a una gran gama de manifestaciones clínicas que afectan anualmente a millones de personas en el mundo. Las infecciones producidas por enterovirus pueden producir cuadros asintomáticos o dar lugar a enfermedades graves e incluso de curso fatal, cuadros febriles, exantemas, enfermedad respiratoria del tracto superior, miocarditis, enfermedad de Bornhölm, poliomielitis, encefalomielitis, ataxia, mielitis transversa e incluso se les ha relacionado con el desarrollo de diabetes mellitus [97].
En conjunto pueden infectar todos los tejidos [97,98], algunos serotipos tiene tropismo positivo ejemplo el Coxsackie B para el corazón. Un serotipo puede tener varias formas de presentación y varios serotipos pueden provocar el mismo síndrome. Son más frecuentes en otoño y verano [97], pero pueden esporádicamente presentarse en cualquier época con un período de incubación entre 3 y 6 días. Los virus con mayor neurotropismo [97,98] y virulencia son Echovirus (Los virus ECHO del inglés Enteric Cytopathic Human Orphan virus) 30, 7, 9 y 11; Coxsackie B5 y Enterovirus 70 y 71, existiendo reportes de secuelas neurológicas y hasta casos fatales con el serotipo 71. Los virus con menor virulencia son Echo 4, 6 y 18, Coxsackie B3, B4 y A9.
Los enterovirus se encuentran bien adaptados al humano ya que no tienen otros hospederos, ni reservorios. Dicha adaptación va acompañada por la preferencia de las células epiteliales de las vías digestivas y respiratorias, estas células no sólo facilitan la replicación de los enterovirus, sino facilitan la excreción y expulsión directa de los mismos al medio ambiente donde probablemente encuentren otro hospedero humano. A diferencia de otros microorganismos que causan gastroenteritis, los enterovirus generalmente se excretan por largos periodos debido a que no se detiene su replicación en la célula intestinal.
Los enterovirus se transmiten por seis rutas diferentes:
I.- transmisión fecal con adquisición oral.
II.- agua.
III.- comida,
IV.- vías respiratorias.
V.- vía sexual.(Válido para Coxsackievirus y Echovirus )
VI.- por sangre.
Propiedades del Genóma [99]
Las propiedades genómicas de poliovirus son representativas para todos los enterovirus, tiene una cápside icosaedríca desnuda, mide 7441 nucleótidos de RNA.Es un virus RNA de cadena sencilla y positiva, se considera igualarse aun RNAm por presentar un extremo 3‘ poliadenilano de 70 a 100 nucleótidos de largo y en el extremo 5'se encuentra asociado un oligopéptido.
Los enterovirus Humanos, se incluyen dentro de la familia Picornaviridae, consta de cuatro géneros. (Cardiovirus y Aphtovirus, Rhinovirus, y Enterovirus) los dos primeros son patógenos para animales y los otros son importantes patógenos humanos. El virus de la hepatitis A fue originalmente clasificado como Enterovirus tipo 72, aunque actualmente ha sido separado del grupo, siendo considerado un género aparte denominado Hepatovirus.
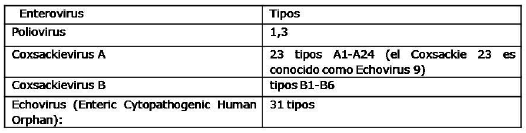
Los enterovirus comparten gran número de características clínicas, epidemiológicas, físicas y químicas. Difieren entre sí por el distinto comportamiento en cultivo, antigenicidad y ciclo replicativo aunque, en todos los casos, el hábitat común y el lugar de replicación es el tracto intestinal humano. El ciclo replicativo de los enterovirus es lítico y su receptor celular es una molécula perteneciente a la superfamilia de las inmunoglobulinas que se presenta en distintos órganos diana, como el corazón (Coxsackievirus), el sistema nervioso central (Poliovirus), el hígado o el intestino.
Son resistentes a todos los antivíricos y quimioterápicos conocidos, y a la inactivación por solventes de lípidos. Presentan una tendencia natural a la agregación espontánea que los defiende del efecto de los agentes externos. Se inactivan rápidamente a más de 50ºC, por la luz ultravioleta y en condiciones de desecación. Son estables a pH ácido, característica que los diferencia de los Rhinovirus. Se conocen más de 70 serotipos que causan infecciones, dan lugar a enfermedades graves del sistema nervioso central, como la meningitis aséptica, encefalomielitis, ataxia cerebelar, síndrome de Guillain-Barré, mielitis transversa y poliomielitis, entre otras.
Clínicamente pueden cursar con fiebre exantema (boca, mano, pié causado por Coxsackie A 16, A5 o enterovirus 71), pleocitis mono nuclear. Meningitis viral, sepsis neonatal especialmente en varones [100] y la más severa se ha visto asociada a Echovirus que afecta Sistema nervioso, pulmones e hígado y se ha visto relacionada con enfermedad materna por enterovirus dos semanas antes del parto, sexo masculino y prematurez. En las primeras dos semanas que siguen al parto en recién nacido comienza con fiebre, rechazo a los alimentos, distención abdominal, letargia e hipotensión y el diagnóstico diferencial se hará con sepsis bacterianas o por herpes virus.
Al examen físico exantema inespecífico [100], rubeoliforme, macular, rosado blanquecino sin adenopatías. Vesículas orales escasas que forman úlceras en paladar, mucosas, encías y lengua con abundante salivación, erupción anogenital micropapulovesiculosa que cuando es por enterovirus 71 puede ser severa, la mayoría de las lesiones comienzan en cara y luego se diseminan. Puede haber síntomas respiratorios, gastrointestinales y meníngeos.
Existen evidencias de que las infecciones por virus Coxsackie del grupo B juegan un papel importante en la etiología de la diabetes mellitus dependiente de insulina (DM-1). Algunos estudios [97] post-mortem de pacientes con cetoacidosis diabética han relacionado a determinados virus de este grupo con esa patología, particularmente el virus Coxsackie B4. Aunque parece posible su implicación en desarrollo de la DM-1, queda por determinar si inician los procesos que dan lugar a la diabetes o bien precipitan la enfermedad en aquellos pacientes con la función endocrina ya dañada. También se ha relacionado a los virus Coxsackie B4, B5 y del grupo A con la pancreatitis en los adultos. Por último, existe una vasta miscelánea de cuadros clínicos en los que se ha implicado a los enterovirus. El síndrome de fatiga crónica, caracterizado por una debilidad del músculo esquelético, acompañada de mialgias, cefaleas, dificultad de concentración, parestesias, etc., se ha asociado con múltiples agentes etiológicos víricos, siendo los enterovirus uno de ellos. Son estables a pH ácido, característica que los diferencia de los Rhinovirus [95] y propiedad que permite a los enterovirus atravesar la barrera gástrica y colonizar el tracto intestinal.
Tipo de enterovirus y Entidad que se relaciona
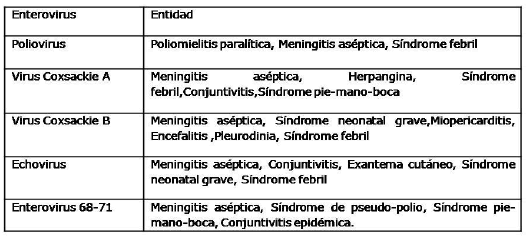
Diagnóstico [101-103]
Puede realizarse el aislamiento del virus a partir de secreciones respiratorias, heces o líquido cefalorraquídeo (LCR), por cultivo sobre líneas celulares susceptibles. Asimismo, se puede aislar de heces fecales o de fluidos vesiculares, orina, exudado conjuntival y secreciones nasales, debe recogerse más de una muestra en un intervalo de 24-48 h ya que la excreción es con frecuencia intermitente. La técnica de la reacción en cadena de la polimerasa (PCR), que permite la detección rápida del genoma, es útil en los procesos en los que un diagnóstico precoz permite establecer un pronóstico y tratamiento adecuados, como en el caso de las meningitis, en las que la PCR del LCR puede dar resultado en pocas horas. Las determinaciones serológicas son poco útiles en el diagnóstico de las infecciones por enterovirus, puesto que el elevado número de serotipos existentes, así como la frecuencia de infecciones inaparentes o subclínica que pueden haber desencadenado una respuesta inmunológica anterior, no permite, en muchas ocasiones, la obtención de resultados significativos. Las determinaciones de anticuerpos pueden ser de interés en casos de brotes epidémicos .Para la profilaxis de las infecciones por enterovirus, el gran número de serotipos de EVNP dificulta la preparación de vacunas adecuadas. En cambio, frente a los poliovirus se han obtenido vacunas inactivadas, tipo Salk, y vacunas atenuadas, tipo Sabin, dotadas de una gran eficacia. Con su utilización se ha conseguido la eliminación de la poliomielitis en numerosos países y la Organización Mundial de la Salud ha señalado como objetivo para un futuro próximo la erradicación de la enfermedad. No existe ningún antivírico con actividad frente a los enterovirus.
El tratamiento de las infecciones se limita al sintomático y de soporte.
La meningitis aséptica, ciertas enfermedades febriles con o sin exantema cutáneo y el resfriado común también se relacionan con los Echovirus. El enterovirus tipo 68 causa infección de vías respiratorias bajas; el enterovirus tipo 70 es el agente de epidemias de conjuntivitis hemorrágica aguda y el enterovirus tipo 71 causa meningitis aséptica, encefalitis y síndrome mano-pie-boca.
Manifestaciones clínicas asociadas con los distintos tipos de enterovirus
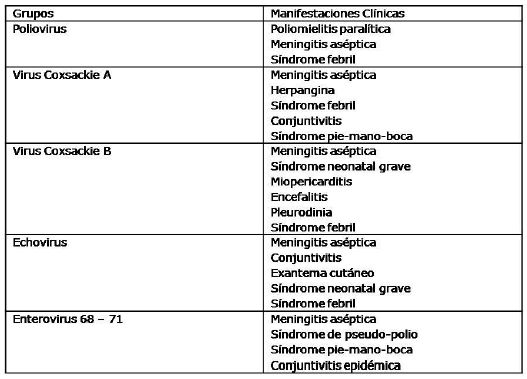
Patogenia
Penetra en el organismo el virus por vía oral o nasofaríngea, con un periodo de incubación que oscila entre 2 y 40 días. Se multiplica en el tejido linfoide de la faringe y placas de Peyer y después se disemina por vía sanguínea a tejidos diana, como la piel, miocardio, meninges, páncreas, en donde se replica. Los síntomas pueden ser el resultado directo de la destrucción de células diana en los tejidos (como ocurre en la poliomielitis), o puede deberse a la respuesta inmune frente al virus (como ocurre en el modelo murino de miocarditis por virus Coxsackie tipo B).
La mayoría de las infecciones son abortivas, debido a la existencia de anticuerpos neutralizantes. Los anticuerpos IgG, IgM e IgA aparecen con bastante rapidez en el curso de la infección. La inmunidad es, predominantemente, humoral, específica de serotipo y duradera persiste durante toda la vida. Las personas con un déficit de la inmunidad humoral tienen un mayor riesgo de desarrollar la enfermedad paralítica cuando se utiliza para su vacunación la vacuna de antipolio oral con virus atenuados (Sabin, OPV), siendo recomendable en esta situación el empleo de la vacuna parenteral de virus inactivados (Salk, IPV).
No hay tratamiento específico para estos agentes disponible hasta la fecha. Gammaglobulina en los agammaglobulinemicos y con infecciones crónicas.
Fármacos que inhiben su replicación: Pleconaril [104] (VP - 63843) unoxadiazole, nuevo agente antipicornavirus de espectro amplio en fase experimental IV efectivo en el 90 % de los serotipos en concentración menor o igual a 0,1 μgrs /ml que atraviesa la barrera hematoencefalica, de gran afinidad por el sistema nerviosos y efectivo frente a infecciones severas del neonato y inmunodeficientes. Vía oral se administra 3 veces por día de 2,5 a 3 mg/kg.
Y finalmente vamos a tocar un tema que aún cuando su etiología se desconoce existen varios estudios pioneros que apuntan con consistencia el hecho de la posibilidad de que los herpes virus estén implicados en la causa de la Esclerosis múltiples y basado en las observaciones que han realizado múltiples investigadores se ha planteado la alta probabilidad que existe en la transmisión sexual sea una de las vía de adquirir esta invalidante enfermedad.
Esclerosis Múltiple/Virus/Transmisión Sexual?
La Esclerosis Múltiples (EM) es de las entidades en la que múltiples factores están involucrado en su etiología, sin embargo desde hace algún tiempo se ha ido incrementando el atesoramiento de un grupo de evidencias que apuntan con una alta probabilidad de que la de transmisión sexual posiblemente está imbricada en su mecanismo, quedará para las futuras generaciones confirmar éste planteamiento o demostrar que no es tal así. Nosotros consideramos oportuno hacer la referencia, pues la enfermedad como tal merece la pena tener en cuenta por los deterioros que provoca.
En 1868 es identificada por el l Dr Jean Martin Charcot (1825- 1893), un neurólogo francés como Esclerosis en Placa, enfermedad desmielinizante, neurodegenerativa y crónica del sistema nervioso central. Se distinguen varios subtipos de esclerosis múltiple y muchos afectados presentan formas diferentes de la enfermedad con el paso del tiempo. Es la enfermedad neurológica más observada entre los adultos jóvenes después de la Epilepsia y la más frecuente de parálisis después de la erradicación de poliomielitis. Afecta aproximadamente a 1 de cada 1000 personas, en particular a las mujeres.
Se presenta cuando los pacientes tienen entre 20 y 40 años. En la actualidad, aunque no existe ninguna prueba de laboratorio que de manera aislada permita confirmar la EM, particularmente la resonancia magnética, el análisis del líquido cefalorraquídeo y los potenciales evocados, permiten un alto grado de seguridad en el diagnóstico, incluso antes de que haya una confirmación clínica de la enfermedad. El proceso de diagnóstico se completa con la realización de pruebas para excluir otras enfermedades que pueden imitar a la esclerosis como la enfermedad de Devic, la sarcoidosis, la vasculitis y la enfermedad de Lyme [105].
Clínicamente encontramos la astenia, pérdida de masa muscular, debilidad muscular, movimientos incordiados, disartria, disfagia, disnea ,espasticidad muscular,calambres,espasmos y fasciculación muscular ,nistagmo,visión doble, disfunción sexual, dificultades para realizar dos tareas a la vez, pérdida de memoria a corto plazo, labilidad emocional,depresión,ansiedad.Se han descrito cambios conductuales del tipo de falta de motivación ,apatía,desinhibición,agresividad e infantilismo. Dificultades en explicar conceptos abstractos, organizar, planificar u olviden determinadas palabras.
La ira es otro sentimiento que puede ir asociado a la EM. También se ha informado de la aparición de "risa patológica" y "llanto patológico". Esencialmente se refiere a una reacción inapropiada a la situación, tal como risas en un funeral o llanto al oír buenas noticias. A menudo es consecuencia de la desmielinización de las áreas del cerebro encargadas del juicio, entre otros síntomas [105]
En la mayoría de los casos la esclerosis comienza con la aparición aguda de síntomas en un espacio que varía de horas a días, habitualmente llamado exacerbación, ataque o episodio. Más adelante se habla de recaída. En los casos de EM benigna, tras uno o dos ataques, la recuperación es completa. La enfermedad no empeora a lo largo del tiempo y suele tener síntomas menos graves. Estos casos sólo se identifican cuando queda una incapacidad permanente pequeña a los 10 o 15 años del primer ataque, que fue identificado en su día como EM con recaídas. Estas recaídas pueden incluir los síntomas anteriores y/u otros nuevos. Sin embargo, estudios de resonancia magnética muestran que el daño a los nervios puede continuar en estos pacientes incluso cuando los síntomas han remitido. Se sabe desde hace mucho tiempo que la EM nunca duerme, por lo que la importancia del tratamiento preventivo es grande. Muchos enfermos permanecen en esta fase el resto de sus vidas.
Patología: Los orígenes de la enfermedad son desconocidos.
Los daños reportados en la desmielinización se basan en que la barrera hematoencefalica que está formada por células endoteliales tapizando las paredes de los vasos, en la esclerosis esta barrera se deteriora y células T autoreactivas la cruzan, provocando una proceso inflamatorio. La inflamación es facilitada por otras células inmunitarias y elementos solubles, como la citocina y los anticuerpos. Motivo por este comportamiento anormal del sistema inmunológico, la esclerosis múltiple es considerada una enfermedad autoinmunitaria.
Se ha aceptado por todos que un subtipo especial de linfocitos, llamados células CD4- Th1-T , tienen función clave en el desarrollo de la enfermedad. Bajo circunstancias normales, estos linfocitos pueden distinguir entre células propias y ajenas. En la esclerosis múltiple, las células reconocen partes sanas del sistema central como ajenas y las atacan como lo harían con un virus. En la esclerosis, la parte atacada es la mielina, una sustancia grasa que cubre los axones de las células nerviosas y que es importante para una transmisión nerviosa adecuada.
La inflamación finalmente lleva a la apertura de la barrera hematoencefalica, lo que puede acarrear problemas como edemas, activación de macrófagos, de metaloproteinaza y otras proteasas y citocinas. Finalmente llevará a la destrucción de la mielina, proceso llamado desmielinización.
El daño a los axones es una de las principales causas del desarrollo de discapacidades permanentes. Se ha demostrado que esta lesión interviene no sólo en formas crónicas o en estadios tardíos de la enfermedad, sino que está presente desde el inicio. Los mecanismos que llevan a este tipo de daños no están explicados en su totalidad.
Factores que provocan una recaída: se han descrito factores que favorecen las recaídas, tienden a ocurrir con más frecuencia durante la primavera y el verano que en otoño o en invierno. Infecciones como un refriado o diarrea aumentan el riesgo de recaída. La vacuna contra el resfriado es inocua y no provoca recaídas como se ha demostrado en diversos estudios recientes. La vacuna del tétanos también se considera inocua, aunque no ha sido estudiada con detalle. En general, las vacunas con virus vivos atenuados aumentan el riesgo de recaída. El embarazo por su parte está descrito que mientras que los primeros meses y especialmente las primeras seis semanas el riesgo aumenta entre un 20 y un 40%, los últimos tres meses de embarazo ofrecen una protección natural contra la recaída según estudios recientes y la esclerosis múltiple no aumenta la probabilidad de tener un niño disminuido, aunque sí existe la posibilidad de transmisión de la enfermedad. También se desaconsejan maratones ya el deporte pudiera provocar recaídas, el estrés, el calor y el agotamiento pueden aumentar los síntomas, fenómeno conocido como síntomas de Uhthoff.
Una rápida regresión de los síntomas iníciales, edad a la que aparece la enfermedad por debajo de los 35, sólo un síntoma inicialmente, desarrollo rápido de los síntomas iníciales y corta duración de la última recaída indican un buen pronóstico.
Los estudios que apoyan el posible mecanismo de transmisión sexual de la esclerosis múltiple se basan en [105]
Etiopatogenia compleja y multifactorial, donde influye determinada susceptibilidad genética y exposición concertada a factores ambientales proponiendo entonces que la EM es una ITS adquirida fundamentalmente [106-108] durante la adolescencia a partir de hombres infectados no necesariamente sintomáticos; la transmisión sexual no será la única causa, pero factores relacionados con la misma crean susceptibilidad a agentes neurotrópicos adquiridos sexualmente; la ocurrencia en zonas de alto riesgo puede representar un efecto combinado del predominio racial blanco, valores culturales (particularmente actitudes de moralidad sexual) y patrones sexuales raciales cruzados y las áreas de bajo riesgo tales como África Central pueden existir por competencia con otras infecciones o exposición temprana a variadas infecciones de tal modo que se produce inmunidad. La incidencia aumentada en áreas aisladas vírgenes de EM seguida a exposición a personal militar implica a un agente transmisible. La similitud de la EM e infecciones por HTLV-1[107], su transmisión familiar y el cambio de género en su prevalencia sugieren que el agente infeccioso puede transmitirse.
La cusa infecciosa que con mayor frecuencia se relacionada con EM son los virus debido a que el 90 % de los pacientes que la padecen tienen altas concentraciones de IgG que se manifiestan como bandas oligoclonales en LCR. Evidencias indirectas que la EM es causada por un virus es la asociación de diferentes virus con encefalomielitis desmielinizante en humanos y la inducción de desmielinización en modelos animales infectados con virus. Análisis moleculares de especificidad del gen de IgG en el cerebro y LCR de pacientes que tuvieron EM han mostrado características de una respuesta inducida por antígeno: amplificación clonal y mutaciones somáticas extensas [109].Los virus que se han aislado en presencia de Esclerosis Múltiple son Virus del herpes simple I y II, virus de Epstein Barr, Virus SHTLV-1,
Human herpesvirus-6, 7 y 8, Varicela Zóster, Sarampión, Parotiditis, Citomegalovirus, Virus JV.
Las posibles relación de ITS y EM se basan en que ITS se desarrollan en la mujer en edades más tempranas y después este patrón cambia .Pudiera ocurrir igual en la esclerosis múltiple La transmisión de las ITS hombre-mujer es más eficiente que mujer-hombre Ej: HIV, HTLV-1, Hepatitis B, Herpes simple, Gonorrea y Clamidia [108]. La prevalencia de las ITS y de la EM es mayor las sociedades permisivas.
En cuanto a prevalencia se ha visto que las personas negras que viven en países en desarrollo tienen inmunidad general a las infecciones por la repetida exposición a las mismas por lo cual incrementa su resistencia a la EM de forma no-específica. En negros africanos no es frecuente la EM y el SIDA en un mismo paciente. Esto fortalece la teoría de la infección (venérea o no) como causa de EM [110-111]. Es rara es poblaciones nativas física o culturalmente aisladas de poblaciones blancas Ej. Aborígenes australianos, negros surafricanos
También se ha observado en las categorías del comportamiento sexual la siguiente relación en cuanto a EM: A: Pocos partners en la vida tanto para el hombre como para la mujer: ITS baja, ausencia de EM Ej.: grupos religiosos. B: La mujer tiene un partner pero los hombres varios: ITS alta, EM media. Ej Italia. C: Tanto el hombre como la mujer tienen varios partners: ITS alta, EM alta Ej. USA.
Como sabemos estos son los pioneros estudios que se han lanzado a proponer la vía sexual como posible mecanismo de transmisión para la Esclerosis Múltiple, de ahí a que se confirme queda mucho camino por recorrer, no obstante debemos tener esta posibilidad presente.
Reproducción asistida y virus de transmisión sexual
No podemos dejar de comentar algunas consideraciones importantes en la literatura respecto a las Técnicas de Reproducción Asistida. [112] Donación de Gametos Y Preembriones El screening de enfermedades infecciosas a que deben ser sometidos los donantes de gametos y embriones queda establecido en el artículo 4 del RD 412/96, siendo los siguientes: Estudios serológicos: sífilis, hepatitis y VIH; b.-Estudios clínicos para la detección de fases clínicas infectivas de: toxoplasmosis, rubéola, herpes virus, Citomegalovirus (CMV), Neisseria gonorrhoeae y Chlamydia trachomatis. Siendo necesario realizar estas pruebas en el caso de donantes de semen cada 6 meses y siendo imprescindible comprobar la seronegatividad en ambas pruebas de marcadores de VIH para la utilización de los gametos masculinos y preembriones. En las donantes de gametos femeninos, y en base a la actual imposibilidad de crioconservación de los ovocitos donados, se considerará suficiente la negatividad de la donante en una única prueba de marcadores VIH.

Hepatitis B Y Reproducción Asistida [113]
La existencia de una vacuna frente a la hepatitis B facilita la actitud a tomar en parejas con deseos reproductivos sero discordantes a la hepatitis B en la que el varón es seropositivo, pues la vacunación prevendría la transmisión a la mujer. En parejas donde es la mujer la seropositiva, la transmisión vertical va a depender de la actividad de la enfermedad, siendo del 2-15% en mujeres AgHBs+ AgHBe- DNA VHB-, y del 80-90% en mujeres AgHBs+ AgHBe+ DNAVHB+. Por esto la actitud a tomar sería retrasar la aplicación de la técnica de reproducción asistida hasta que la carga viral sea baja, y previendo la inmuno profilaxis del recién nacido. Cuando los dos miembros de la pareja son AgHBs+ existe la posibilidad, aunque rara, de reinfección por otros subtipos deVHB, por lo que es recomendable la aplicación de técnicas de RA en estas parejas con deseos reproductivos, además de las medidas comentadas anteriores.
Hepatitis C Y RA [114,115]
En caso de parejas sero discordantes al virus de la hepatitis C (VHC) con deseos reproductivos debemos valorar siempre el estado de la enfermedad. Así, en el caso de varón seropositivo a VHC y mujer sero negativa, y dado que al contrario del VHB no disponemos de una vacuna, se hace necesario un adecuado procesamiento del semen previo a su uso en TRA (swimup+ gradientes de densidad y comprobación mediante PCR de ausencia de VHC RNA en la muestra a utilizar), ya que se encuentra VHC RNA en el semen del 5% de varones seropositivos [112,114]. La presencia en semen del VHC depende de la carga viral sérica del paciente, siendo rara su presencia en semen de varones con menos de un millón de copias/mL, por lo que algunos autores aconsejan en varones con más número de copias tratamiento previo a la TRA .La hepatitis C no empeora con el embarazo ni las gestaciones en mujeres con hepatitis C presentan más complicaciones que en las mujeres seronegativas. La transmisión vertical en mujeres seropositivas depende de la carga viral y ocurre principalmente durante el parto [115]. En mujeres HCV RNA negativo la transmisión es <1%, en mujeres con menos de un millón de copias es del 0-5% y con más de un millón de copias del 10-20%. Por esto se recomienda que encaso de parejas con deseos reproductivos y en los que es necesario realizar TRA en que la mujer es VHCRNA positivo con más de un millón de copias por mL se debe consultar a un hepatólogo con la idea de instaurar algún tratamiento que disminuya la carga viral, y una vez conseguido este objetivo se realice la TRA.
Citomegalovirus Y RA. [117,118]
Existe alta prevalencia de seropositivos a CMV en parejas de RA, cuando analizamos el screening de donantes. En un 40% de varones seropositivos se detecta por PCR DNA de CMV en semen, teniendo la mitad de estos eyaculados cultivos positivos. Por lo que a la horade abordar a una pareja con el varón seropositivo a CMV y la mujer negativa debemos determinar si es infección activa o reciente (Ig M o seroconversión IgG reciente) y en caso de serlo esperar unos meses a que la infección se haga antigua y disminuya considerablemente la posibilidad de aparecer CMV en semen El principal problema en la transmisión vertical del CMV ocurre cuando una mujer seronegativa contrae la enfermedad estando embarazada, si esto ocurre en mujeres seropositivas la transmisión vertical ocurre en menos del 1% con leves consecuencias para el feto. Así toda mujer seropositiva a CMV Ig Gantigua podrá someterse a RA sin apenas riesgos. Cuando los dos miembros de la pareja son seropositivosCMV Ig G existe, aunque remota la posibilidad de reinfección con una cepa diferente de algún miembro de la pareja. Para hacernos idea de lo escaso de este riesgo baste comentar que en trasplante de órganos suele emparejarse donante y receptor seropositivo a CMV.
VIH y Reproducción Asistida.
A la hora de atender a una pareja serodiscordantes para VIH siendo el varón positivo y la mujer negativa debemos tener presente que si desean tener descendencia la posibilidad de contagio de la mujer mediante relaciones es del 5% [119] dependiendo este principalmente de la carga viral. Recientemente Quinn et al. [119] no han observado transmisión heterosexual cuando el varón tenía menos de 1500 copias/mL.
A pesar de este hecho, se debe valorar el tratamiento al varón seropositivo con antiretrovirales antes de laIAC ya que este hace disminuir la cantidad de virus en el semen. Una manera de disminuir al máximo la posibilidad de contagio sería la realización de ICSI a estas parejas, ya que sólo utilizaríamos unos pocos espermatozoides; no obstante no parece una aproximación coste-efectiva dado los buenos resultados de laIAC en estas parejas [120]
En cuanto al tratamiento de parejas serodiscordantes siendo la mujer la portadora de VIH se ha producido recientemente opiniones que apelan a una libre e informada decisión de la pareja [121] más que a un rechazo frontal a someter a estas parejas a técnicas de reproducción asistida. En una encuesta realizada a centros de reproducción en 1997 solo el 2% de los centros franceses y el 5% de los centros británicos se mostraban favorables al tratamiento con técnicas de reproducción asistida a estas parejas. El comentado cambio de actitud se basa en el aumento de la esperanza de vida de las mujeres seropositivas y la baja tasa de transmisión vertical de VIH con un adecuado tratamiento y un parto individualizado [120]. La última posibilidad que debemos analizar es la aplicación de técnicas de reproducción asistida a parejas en que ambos miembros son seropositivos a VIH, debiendo en este caso recomendar la realización de dichas técnicas dada la existencia de multitud de genotipos de VIH con distinta resistencia a la terapia antirretroviral, lo que posibilita la reinfección de un individuo con genotipos diferentes. Además, la mayor incidencia de enfermedades de transmisión sexual (CMV, hepatitis, VHS) en personas VIH+ hace que la utilización de técnicas de reproducción asistida sea recomendada en estas parejas donde ambos miembros de la pareja sonseropositivos y tienen deseos reproductivos.
Transmisión a Terceros.
Cuando se trata a individuos seropositivos mediante TRA, existe la posibilidad de transmisión a otros pacientes sometidos a dichas técnicas en dos momentos claves: durante la crioconservación de semen o embriones y durante procedimientos quirúrgicos como el rescate folicular.
la primera posibilidad no se ha descrito en reproducción, pero si la transmisión de hepatitis B en medula ósea crio conservadas en nitrógeno líquido [122]. Todo individuo que vaya a congelar algún material biológico debe ser sometido a estudios serológicos de VIH, Hepatitis. En caso de tener que almacenar muestras de individuos seropositivos debe almacenarse en bombonas individuales para cada enfermedad infecciosa. El riesgo de contaminación es igual en crio tubos que en pajuelas, e independiente del sellado de estas con polivinilo u otro material, lo realmente importante es el cuidado en el llenado de la pajuela o criotubo. Cada determinado tiempo debe vaciarse y limpiarse las bombonas de almacenamiento de material biológico [123] El otro momento clave en la transmisión de enfermedades infecciosas en la aplicación de TRA es durante la realización de técnicas quirúrgicas. Así Lesourd et al. [124] han descrito recientemente la transmisión de hepatitis C a dos mujeres que fueron sometidas a punción folicular justo después de ser sometida a esta técnica una paciente con hepatitis C.Tras un exhaustivo análisis de estos casos los autores responsabilizan a procedimientos auxiliares más que al laboratorio de FIV o al procedimiento quirúrgico en si de dicha transmisión.
Riesgos de Transmisión al Personal Sanitario
El riesgo de infección del personal del laboratorio de reproducción es 10 veces mayor que la población general y tres veces mayor que otros trabajadores sanitarios [125] El riesgo de infección tras una punción accidental es del 2-40% para la hepatitis B, 3-10% para la hepatitis C y del 0,2-0,5 % para HIV [126]. Ante este panorama es lógico que se extreme la precaución en el trabajo cotidiano y no sólo a la hora de tratar a pacientes seropositivos. Tanto la OMS [127] como lo AFS han editado guías y recomendaciones para el manejo de material biológico reproductivo. Nos gustaría destacar dos aspectos uno la necesidad de vacunación frente a la hepatitis B de todo el personal sanitario, y la prohibición por AFS y el Instituto Nacional para la Seguridad y Salud Laboral de Estados Unidos de pipetear con la boca [128].
En un futuro no muy lejano a la hora de analizar las enfermedades infecciosas y las TRA deberemos incluir nuevos patógenos los cuales actualmente desconocemos muchos aspectos de su epidemiología y transmisión sexual como los virus de la hepatitis G y TT, virus herpes humano tipo 8, papiloma virus, virus Linfotrófico T humano o priones. Sin embargo nunca debemos olvidar que la decisión de asumir determinado riesgo debe ser de la pareja, debiendo el clínico informar objetivamente de todos los pormenores de las enfermedades infecciosas.
Bibliografía
- Mallqui-Osorio Marisela Epidemiología de las ETS dermatología peruana - vol. 10, suplemento nº 1, diciembre 2000.
- Vázquez F, Otero L, Ordás J, Junquera ML, Varela JA. Actualización en infecciones de transmisión sexual: epidemiología, diagnóstico y tratamiento. Enferm Infecc Microbiol Clin. 2004; 22:392-411. [Medline] [Artículo]
- Maw R, Special Interest Group of BASHH. Anogenital warts. Sex Transm Infect. 2006; 82 Suppl 4:iv40-1.
- Renard A. Rawls, MD and Kenneth J. Vega, MD. Viral Hepatitis in Minority America. J Clin Gastroenterol Volume 39, Number 2, February 2005) Etiología y hepatitis Vertical.
- Centers for Disease Control and Prevention. Summary of notifiable diseases: United
- States, 2001. MMWR Morb Mortal Wkly Rep. 2003; 50:1–99.
- Thomas DJ. Sexually transmitted viral infections: epidemiology and treatment.
- Obstet Gynecol Neonatal Nurs. 2001 May-Jun; 30(3):316-23.
- Manzur J, Diaz Almeyda J, Cortes M. Dermatología: La habana; editorial Ciencias Médicas; 2002 310p.
- Vázquez F, Lepe JA, Otero L y Colbs. Diagnóstico microbiológico de las infecciones de transmisión sexual. Enferm Infecc Microbiol Clin 2008; 26: 32 – 37
- LLAVACA, J (2001). Síndrome de TORCH. Revista de Chile. Cap. 21
- N Engl J Med 2004; 350:1970 – 7.
- Geretti AM. Genital Herpes. Sex Transm Infect. 2006; 82 Suppl 4:iv31-4.
- Ramaswamy M, McDonald C, Smith M, Thomas D, Maxwell S, Tenant-Flowers M, et al. Diagnosis of genital herpes by real time PCR in routine clinical practice. Sex Transm Infect. 2004; 80:406-10. [Medline]
- Aznar Martín J, Blanco Galán MA, Lepe Jiménez JA, Otero Guerra L, Vázquez Valdés F. Diagnóstico microbiológico de las infecciones de transmisión sexual y Otras infecciones genitales, 2007. Procedimientos en Microbiología Clínica de la SEIMC, n. º 24. 2. ª ed.
- Kasper, Dennos L.; Braunwald, Eugene; Fauci, Antony S; Hauser,Stephen L.; Longo, Dan L.; Jameson J. Larry, Harrison: Principiosde Medicina Interna, Decimosexta edición, McGraw-Hill, Chile,2005
- World Health Organization, Department of Reproductive Health and Research. Sexually Transmitted and Other Reproductive Tract Infections. A guide to Essential practice, Geneva, 2005.
- Hervas Angulo A, Forcén Alonso T. Mononucleosis Infecciosa. Guías Clínicas 2002; 2 (20).
- Oña de M, Gimeno C, Mendoza J. Diagnóstico de laboratorio de las infecciones por Herpesvirus. En: Procedimientos en Microbiología clínica. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. J. Picazo, 1995. [En línea]. [Fecha de consulta 2 de Abril de 2002].
- Aronson MD. Infectious mononucleosis. UpToDate (version 9.3). [En línea].
- Hannaoui R, Erika J, Sulbarán MZ, Campos MA. Características clínicas y parámetros hematológicos de pacientes con fiebre dengue y mononucleosis infecciosa. Kasmera (2005) 33(2): 93 – 101.
- MURRAY, P (2000). Microbiología Médica. Volm II. 2da Edición. Edit. Harcourt Brace. Hernández Garcés HR, Espinosa Álvarez RF. Hepatitis viral aguda. Rev Cubana Med Gen Integr 1998; 14(5):484-93.
- Berenguer M, Wright T. Viral hepatitis. En Sleisenger and Fordtran’s. Gastrointestinal and Liver Disease, 7ª Ed, Saunders, 2002.
- Halaben Cherem J, Angulo Varquez F .Hepatitis Viral. Rev Fac Med UNAM Vol.43 No.3 Mayo-Junio, 2000.
- Rodríguez Acosta C. Actualización sobre hepatitis viral: etiología, patogenia, diagnóstico microbiológico y prevención. Rev Cubana Med Gen Integr v.16 n.6 Ciudad de La Habana nov.-dic. 2000. 24. Cuthbert J. Hepatis A. Old and new. Clin Microbiol Reviews 2001; 14(1):38-58.
- Bruguera M. Hepatitis Vírica Aguda. En Farreras, Rozman. Tratado de Medicina Interna. 14ª ed. Madrid: Harcourt 2000; 41(sección 2): parte I.
- Martínez G. Hepatitis Aguda. Rev Chil Pediatr 76 (3); 309-315, 2005
- Gust ID. Epidemiological patterns of hepatitis A in different parts of the world. Vaccine 1993; 10(1):s56-58.
- Hu J, Ludgate L (2007). "HIV-HBV and HIV-HCV coinfection and liver Cancer development". Cancer Treat. Res. 133: 241–52.
- Tommy Yen, M.D., Emmet B. Keeffe, M.D., and Aijaz Ahmed, M.D.The Epidemiology of Hepatitis C Virus Infection. J Clin Gastroenterol 2003; 36(1):47–53.
- MCFARLANE IG. Autoimmune hepatitis: diagnostic criteria, subclassifications, and clinical Features. Clin Liver Dis 2002; 6:317-333.
- L. García Buey F. González Mateos. Clínica de la hepatitis vírica. Abril 2000; 8(13): 677-686.
- Fernández MIC, et al. Actualidad en hepatitis por virus A.Rev Panam Infectol 2006; 8(2):9- 16.
- Sherlock S, Doodley J. Diseases of the Liver and Biliary System. 11ª ed. Blackwell Science 2002; 267-283. 34No. 04-4229S. Febrero de 2004 35. García Buey F. González Mateos. Clínica de la hepatitis vírica. Abril 2000; 8(13):677-686.
- Consenso de Hepatitis Viral. Asociación Mexicana de Gastroenterología 1999. Coordinadores: Dr. Lisker Mauricio, Dra. Dehesa Margarita. Grupo Nacional de Consenso de Hepatitis Viral.
- Van Herck K, Van Damme P. Prevention of hepatitis A by Havrix: a review. Expert Rev Vaccines 2005 Aug; 4(4):459-71.
- Tagle Arrospide M, León Barúa R.Hepatitis Viral como factor desencadenante de hepatitis Autoimnune.Reporte de un caso y revisión de la Literatura. Rev. Gastroenterol. Perú v.23 n.2 Lima abr. /jun. 2003
- Wesley A, Samandari T, Bell BP. Incidence of hepatitis A in the United States in the era of vaccination. JAMA 2005 Jul 13; 294(2):246-8.
- Navas E, Salleras L, Gisbert R, Domínguez A, Bruguera M, Rodriguez G, Gali N, Prat Efficiency of the incorporation of the hepatitis A vaccine as a combined A+B Vaccine to the hepatitis B vaccination programme of preadolescents in schools. Vaccine 2005 Mar 18; 23(17- 18):2185-9. 41. Hepatitis C 768 JAMA, 21 de febrero de 2007—Vol 297, No. 7 Descargado de www.jama.com en la Asociación Médica Americana, el 1 de marzo de 2007. 42. FILOVIRUSES AS EMERGING PATHOGENS. C. J. Peters y cols., en Virology, vol. 5, Páginas 147-154, 1994.
- Descargado de: Hipertextos en áreas de biología https://www.biologia.edu.ar República Argentina • ©1998-2008 44. Echevarría JM & Herrera Calvet I: Infecciones causadas por Filovirus, en Farreras Valentí P & Rozman C, Medicina Interna, (2)331:2864-2867, Madrid, 2000. 45. NEW ARENAVIRUS ISOLATED IN BRAZIL. Te rezinha Lisieux y cols., en The Lancet, n.deg. 343, páginas. 391-392,1994.
- Actualización sobre la fiebre de Lassa en África OccidentalWeekly Epidemiological
- Record- Relevé épidémiologique hebdomadaire 2005; 80(10):86-88.
- Richmond JK y Baglole DJ. Fiebre de Lassa: Epidemiología, Características Clínicas y Consecuencias Sociales. BMJ 327(7426):1271-1275, Nov. 2003 48. Jahrling PB, Niklasson BS, McCormick JB. Early diagnosis of human Lassa fever by ELISA detection of antigen and antibody. Lancet 1985; it: 250-252. 49. Jahrling PB, Niklasson BS, McCormick JB. Early diagnosis of human Lassa fever by ELISA detection of antigen and antibody. Lancet 1985; it: 250-252. 50. OMS. Fiebre hemorrágica del Ebola.Nota descriptiva N° 103 Revisión provisional:
- Septiembre de 2007.
- Daddario-DiCaprio KM, Geisbert TW, Ströher U, et al. "Postexposure protection
- Against Marburg haemorrhagic fever with recombinant vesicular stomatitis virus
- Vectors in non-human primates: an efficacy assessment". Lancet 367 (9520): 1399–1404. DOI: 10.1016/S0140-6736(06)68546-2.
- Jones SM, Feldmann H, Stroher U et al. (2005). "Live attenuated recombinant vaccine Protects nonhuman primates against Ebola and Marburg viruses". Nature Med 11 (7): 786– 90. DOI: 10.1038/nm1258. PMID 15937495.
- Definiciones de Caso: Enfermedades víricas de Ébola-Marburg. Boletín Epidemiológico, Vol. 24 No. 2, Junio 2003
- Manjarrez HHA, Gavilanes PS, Vega FL. Fiebre hemorrágica por virus Ébola. Lo que debemos saber. Rev Mex Pediatr 2003; 70 (6): 299-302
- Echevarría JM & Herrera Calvet I: Infecciones causadas por Filovirus, en Farreras Valentí P & Rozman C, Medicina Interna, (2)331:2864-2867, Madrid, 2000.
- http:www:umm.edu. University of Maryland Medicine. Fiebre hemorrágica de Ébola.
- Revisión Feb. 2002.
- Descargado de:
- Kalden JR, Gay S. Retroviruses and autoimmune rheumatic diseases. Clin Exp Immunol 1994; 98: 1-5.
- Robert Belshaw, Pereira V; Katzourakis A; Talbot G; Paces J; Burt A; Tristem M. (April de 2004). "Long-term reinfection of the human genome by endogenous retroviruses". Proc Natl Acad Sci USA 101 (14): 4894–99
- Retrovirus. https://www.enciclopedia.com/es/l/le/lentivirus.php. Acceso: Octubre 2006 61. Leucemia / Linfoma T del Adulto (HTLV-I positivo). https://www.msal.gov.ar/htm/site/pngcam/normas.Acceso: Octubre 2006
- Quintana M, Villalobos J y col. Estudio de la seroprevalencia de la infección por los virus Linfotrópicos humanos (HTLV) I y II en poblaciones del departamento de Córdoba, Colombia. Colombia Médica 2004; 35: 22-30.
- Uchiyama T, Yodoi J, Sagawa K, Takatsuki K, Uchino H. Adult T-cell leukemia: clinical and hematologic features of 16 cases. Blood 1997; 50: 481-92.
- Eguchi K, Origuchi T, Takashima H, et al. High seroprevalence of anti-HTLV _1 antibody in rheumatoid arthritis. Arthritis Rheum 1996; 39: 463-467.
- Griffiths D, Cooke S, Herve C et al. Detection of humans retrovirus 5 in patients with arthritis and systemic lupus erythematous. Arthritis Rheum 1999; 42: 448-454
- Uchiyama T, Yodoi J, Sagawa K, Takatsuki K, Uchino H. Adult T-cell leukemia: clinical and hematologic features of 16 cases. Blood 1997; 50: 481-92.
- Hudson CP. Community-based trials of sexually transmitted disease treatment: Repercussions foe epidemiology and HIV prevention. Bull World Health Organ 2001; 79:48-58.
- Descargado de https://nobelprize.org/
- Hoover, D. R. et al.,"Lon-term survival without clinical AIDS after CD4 cell counts fall bellow 200/ml." AIDS 9, 1995, pp. 145-152.
- Hudson CP. Community-based trials of sexually transmitted disease treatment: Repercussions foe epidemiology and HIV prevention. Bull World Health Organ 2001; 79:48-58.
- https://www.healthsystem.virginia.edu/UVAHealth/peds_infectious_sp/aidshiv.cfm] El Síndrome de Inmunodeficiencia Adquirida (sida) / El Virus de Inmunodeficiencia Humana (VIH), tomado el 26 de diciembre de 2007
- Coovadia, H. (2004). "Antiretroviral agents—how best to protect infants from HIV and save Their mothers from AIDS". N. Engl. J. Med. 351 (3): 289-292
- Smith, D. K., Grohskopf, L. A., Black, R. J., Auerbach, J. D., Veronese, F., Struble, K. A., Cheever, L., Johnson, M., Paxton, L. A., Onorato, I. A. and Greenberg, A. E. (2005). "Antiretroviral Postexposure Prophylaxis After Sexual, Injection-Drug Use, or Other Nonoccupational Exposure to HIV in the United States". MMWR 54 (RR02): 1-20
- Organización Panamericana de la Salud. El Control de las Enfermedades Transmisibles Decimoséptima Edición. Washington, 2004
- N.E.Journal of Medicine, 348:6, February 6, 2003.
- Epidemiología Del Virus Papiloma Humano. 2002.
- Beutner R, Tyring S. Human papilloma virus and human disease.Am J Med 1997; 102(5A):9-15. 2. Ponce I, Sebastiá J. Cáncer de cervix. ¿Enfermedad oncológica o enfermedad infecciosa? Prog Obst Ginecol 2001; 44: 285-286.
- Hawes SE, Kiviat NB. Are genital infections and inflamamation cofactors in the Pathogenesis? in the pathogenesis of invasive cervical cancer? J Natl Cancer Inst 2002; 94:1592- 1593.
- Smith JS, Herrero R, Bosetti C, Muñoz N, Bosch FX, Eluf- Neto J. Castellsague X, Meijer CJ, Van de Brule A, Franceschi S, Ashley R. Herpex simplex virus 2 as human papillomavirus cofactor in the etiology of invasive cervical cancer. J Natl Cancer Inst 2002; 94:1604-1613.
- Green J, Berrington de González A, Smith JS, Franceschi S, Appleby P, Plummer M. V. Human papillomavirus infection and use of oral contraceptives. Br J Cancer 2003; 88: 1713-1720.
- Brown DR, Schroeder JM, Bryant JT, Stoler MH, Fife KH. Detection of multiple papillomavirus types in condyloma acuminata lesions from otherwise healthy and Immunosupressed patients. J Clin Microbiol 1999; 37:3316-3322.
- Aznar J, Ojeda A, Torrese MJ, Palomares JC, Rodriguez- Pichardo A. Dual genitropic human papillomavirus infection in genital warts. Genitourin Med 1193; 69:60-62.
- Gómez García, E. Gómez Mampaso*, S. Conde Someso, E. Maganto Pavón, S. Navío Niño, A. Allona Almagro. Infección por Papillomavirus en el hombre. Estado actual. Actas Urol Esp v.29 n.4 Madrid abr. 2005
- Wikstrom A, Popescu C, Forslund O. Asymtomatic penile HPV infection: a prospective study. Int J STD AIDS 2000; 11:80-84
- Pala S, Poleva I, Vocatura A. The presence of HPV types 6/11, 16/18, 31/33/51 in Bowenoid papulosis demonstrated by DNA in situ hybridization. Int J STD AIDS 2000; 11:823-824
- Griffiths TRL, Mellon JK. Human papillomavirus and urological tumours: I. Basis science and role in penile cancer. BJU Int 1999; 84(suppl):579-586.
- Cupp MR, Malek RS, Goellner JR, Smith TF, Espy MJ. The detection of human papillomavirus deoxyribonucleic acid in intraepithelial, in situ, verrocous and invasive carcinoma of the penis. J Urol 1995; 154:1024-1029.
- Ching-Hong P, Palefsky JM. Natural history and clinical management of anal human papillomavirus disease in men and women infected with human Inmunodeficiency virus. Clin Inf Dis 2002; 35:1127-1134.
- Griffiths TRL, Mellon JK. Human papillomavirus and urological tumours: II Role in bladder, prostate, renal and testicular cancer. BJU Int 2000; 85:211-217.
- Marjut A, Rintala M, Pöllanen PP, Nikkanen VP, Grénman SE, Syrjanen SM. Human papillomavirus is found in the vas deferens. J Infect Dis 2002; 185: 166
- Schneede P, Hofstetter A. Human papillomaviruses (HPV) in Urology. Part II: 10 year evaluation of differential HPV therapy. Urologe (A) 2002; 41:32-37.
- Krogh G, Lacey CJN, Gross G, Barrasso R, Schneider A. European course on HPV associated pathology: guidelines for primary care physicians for the diagnosis and management of anogenital warts. Sex Transm Inf. 2000; 76: 162-168
- López JL. Epidemiología y estructura molecular del virus Molluscum contagiosum. Piel 1998; 3:6-8.
- Bugert JJ, Melquiot NV, Darai G. Mapping of mRNA transcripts in the genome of Molluscum virus: transcriptional analysis of the viral slam gene family. Vir Gen 2000; 21:189-92. 93. Requena L.Molusco Contagioso. Disponible en:
- Hinostroza-Da-Conceicao D; Beirana-Palencia A. Tratamiento del molusco Contagioso Con hidróxido de potasio al 15% en solución acuosa.Dermatol.peru. v.14 n.3 Lima sep./dic. 2004.
- Liota E. Smith KJ, Buckley R. Menon P, Skelton H. Imiquimot therapy for Molluscum Contagiosum. J Cutan Med Surg 2000; 4:76-82.
- Gonzales Márquez G. Estudio comparativo del uso de criocirugía vs. Ácido Tricloroacético a saturación en pacientes con sida de la Clínica de Enfermedades de Transmisión Sexual del Centro Dermatológico Pascua 1998. (Tesis)
- Avellón A, Casas I, Trallero G, Pérez C, Antonio Tenorio A, Palacios G. Molecular analysis of Echovirus 13 isolates and aseptic meningitis, Spain. Emerging Infectious Diseases 2003; 9: 934-941.
- Enterovirus (Nonpoliovirus) Infections (Group A and B Coxsackievirus, Echoviruses, and Numbered Enteroviruses). En: Pickering LK, Baker GJ, Long SS, McMillan JA, editores. Red Book: 2006 Report of the Committee on Infectious Diseases. 27th Edición. Elk Grove Village, IIL,: American Academy of Pediatrics; 2006.p.284-5.
- I, Palacios GF, Trallero G, Cisterna D, Freire MC, Tenorio A. Molecular characterization of human enteroviruses in clinical samples: comparison between VP2, VP1, and RNA polymerase regions using RT nested PCR assays and direct Sequencing of products. J Med Virol 2001; 65:138-148.
- Sawyer M .Enterovirus infections: diagnosis and treatment. Pediatr infect Dis J 1999.18(12):1033-40.
- Andréoletti L, Blasel-Damman N, Dewilde A, Vallée L, Cremer R, Wattré P. Comparison of use of cerebrospinal fluid, serum and throat swab specimens in diagnosis of enteroviral acute neurological infection by a rapid RNA detection PCR assay. J Clin Microbiol 1998; 36:589-591.
- Guastadisegni S, Porto L, Callejas D, Botero J.Enterovirus detected by PCR in the Effluent of a treatment system to be employed in irrigation: Preliminary study. Rev Tec Ing Univ Zulia. 2002:25(1):20-25.
- Weinberg S, Prose N, Kristal L: Dermatología Pediátrica. Marbán Libros SL 2002; 99-157.
- Picone Zulema.Que hay de nuevo en los exantemas Virales? Dermatología Argentina.Vol.VIII-No 1-2002.
- J Neurol Neurosurg Psychiatry 2002; 73: 439-443
- Dean G, et al. BMJ 1971; 725-9.
- Hook EW et al. Sexually transmitted disease, 3rd ed. New York, 1999, chapter 32
- Bolan G, et al. Sexually transmitted disease, 3rd ed. New York, 1999, chapter 8
- Infectious causes of multiple sclerosis.Gilden DH.Lancet Neurol, 2005 May; 4(5): 268-9.
- Dean G, et al. Neurol Neurosurg Psychiatry 1997; 63: 565-8).
- Skegg DC, el at. Lancet 1982; 581-3
- Castilla JA, Suarez I, Expósito A, Gil MT1, Luceño F, Núñez AI, Fontes J, Mendoza N, Martínez L. Parejas serodiscordantes y reproducción asistida. Revista iberoamericana de fertilidad. Vol. 18 - nº 2 - Marzo-Abril 2001.
- Federation des BLEFCO.: Propositions díattitudes en matiere de dépistage des Hepatitis B et C Préalables tentative díAMP intracouple. Contracept Fertil Sex, 1997, 25:313-324.
- Semprini AE, Fiore S, Savasi S, Ravizza M, Pardi Lesourd F, Izopet J, Mervan C, Payen JL, Sandres K, Monrozies X et al.: Transmissions of hepatitis C virus During ancillary procedures for assisted conception.Hum Reprod, 2000, 15:1083- 1085.
- Levy R, Tardy JC, Bourlet T, Cordonier H, Mion F, Lornage J et al.: Transmission risk Of heptitis C virus in assisted reproductive techniques. Hum Reprod, 2000, 15:810- 816.
- Gibb DM, Goodall Rl, Dunn DT, Healy M, Neave P, Cafferkey M, et al.: Mother-to- child transmission of hepatitis C virus: evidence for preventable peripartum Transmission. Lancet, 2000, 356:904-907.
- Wits CA, Duan YD, Burns WN, Atherton SS,Schenken RS.: Is there a risk of Cytomegalovirus transmission during in vitro fertilization with donated oocytes?. Fertil Steril, 1999, 71:302-307.
- Liesnard CA, Revelard P, Englert Y.: Is matching between women and donors feasible to avoid cytomegalovirus infection in artificial insemination with donor semen?. Hum Reprod, 1998, 13 supplement 2:25-31.
- Quinn TC, Waver MJ, Sewankambo N, Serwadda D, Li C, Wabwire-Mangen F et al.: Viral load And heterosexual transmission of human immunodeficiency virus type 1. Rakai Project Study Group. N Engl J Med, 2000, 342:921-929.
- Marina S, Marina F, Alcolea R, Nadal J, Expósito R, Huguet J.: Pregnancy following Intracytoplasmic sperm injection from an HIV-1-seropositive man. Hum
- Minkoff H, Santoro N.: Ethical considerations in the treatment of infertility in women with human Immunodeficiency virus infection. N Engl J Med, 2000, 342:1748-1750.
- Tedder RS, Zuckerman MA, Goldstone AH et al.:Hepatitis B transmission from contaminated Crypreservation tank. Lancet, 1995, 346:137-140.
- Steyaert SR, Leroux-Roels GG, Dhont M.:Infections in IVF: review and guidelines. Hum Reprod Update, 2000, 6:432-441
- Lesourd F, Izopet J, Mervan C, Payen JL, Sandres K, Monrozies X et al.: Transmissions of hepatitis C virus during ancillary procedures for assisted conception.Hum Reprod, 2000, 15:1083-1085
- Sewell DL.: Laboratory-associated infections and biosafety.Clin Microbiol Rev, 1995, 8:389-405.
- Gerberding JL.: Management of occupational exposures to blood borne viruses. N Engl J Med, 1995 332:444-451.
- American Fertility Society.: Guidelines for human embryology and andrology laboratories. Fertil Steril, 1992, 58 supplement1.
- Gerrity M.: Legislative efforts affecting the reproductive biology laboratory. Curr Opin Obstet Gynecol, 1993, 5:623-629.
961




























