Palabras clave: Amiloidosis. Rojo Congo. Síndrome nefrótico
Keywords: Amyloidosis. Congo Red. Nephrotic Syndrome.
Introducción:
La amiloidosis es un trastorno sistémico, que se caracteriza por el depósito generalizado de material fibrilar proteico con estructura terciaria b-plegada, insoluble y resistente a acción proteolítica, en diferentes tejidos y órganos, principalmente en riñón, hígado y corazón, con importante repercusión clínica.
Para el diagnóstico es necesaria la demostración de depósito de amiloide en biopsias de grasa abdominal, recto, riñón o hígado, si es necesario.
Caso clínico:
Varón de 34 años con antecedentes de osteomielitis crónica que fallece debido a shock séptico. Tras realizarse la autopsia, se diagnostica de Amiloidosis AA secundaria a Osteomielitis Crónica. Las imágenes corresponden a dicho estudio.
Discusión Histológica:
Macroscópicamente, los órganos afectados suelen ser de aspecto normal o estar aumentados de tamaño con una consistencia ligeramente más firme y superficie de corte cérea. En ocasiones, en casos avanzados, pueden estar disminuidos de tamaño debido a la isquemia producida por afectación de paredes vasculares como ocurre en los riñones.
El amiloide se puede depositar de manera difusa o formando nódulos de tamaño variable en cualquier órgano. Es un material de coloración eosinófila en la hematoxilina-eosina, acelular, homogénea que mediante la técnica de Rojo Congo presenta una coloración anaranjada con birrefringencia verde manzana a la luz polarizada. Con la técnica de Tioflavina se observa una fluorescencia verdosa. Mediante técnicas inmunohistoquímicas se puede discernir entre amiloide AA, AL y TTR.
Los órganos principalmente afectados en la amiloidosis son:
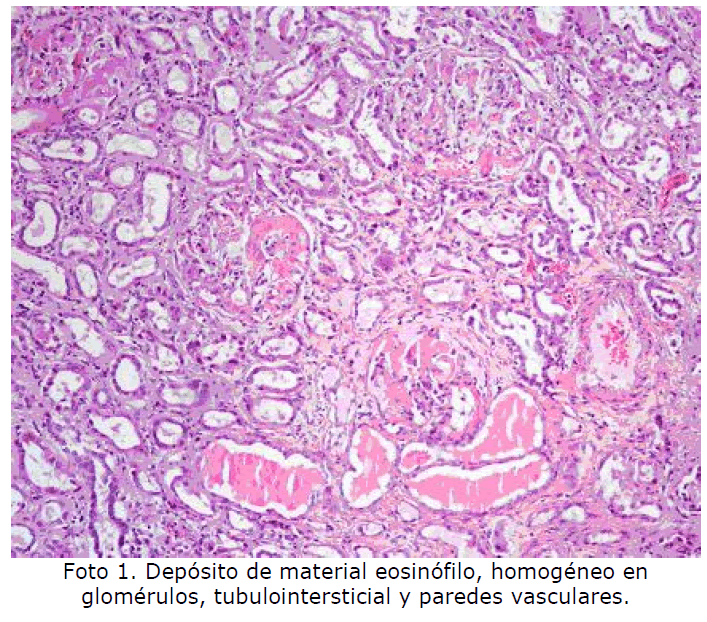
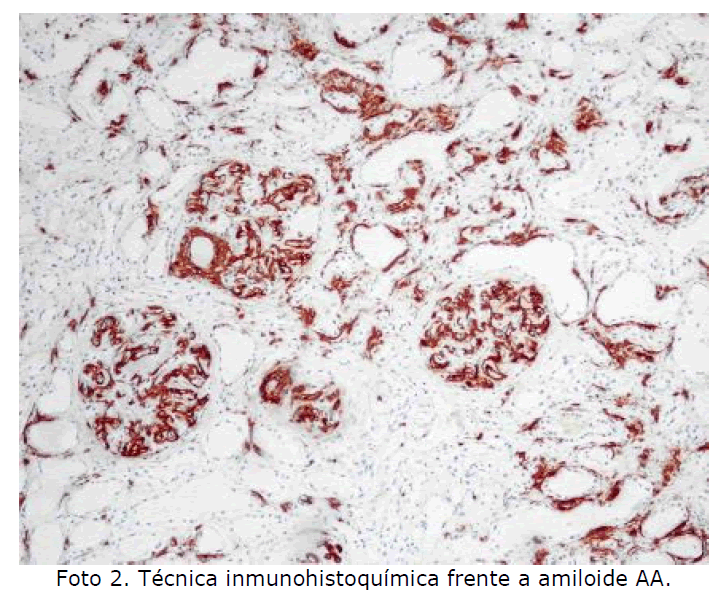
Riñón: el amiloide se deposita principalmente en los glomérulos observándose un engrosamiento difuso de paredes capilares y matriz mesangial que en casos más evolucionados obliteran las luces capilares y forman masas o nódulos confluentes. Además puede depositarse a nivel tubulointersticial produciendo focos de atrofia tubular y en paredes vasculares de distinto calibre. La insuficiencia renal que conlleva el depósito de amiloide en el riñón suele ser la causa de la muerte en la mayoría de los pacientes (Foto 1, Foto 2).
Foto 1: Depósito de material eosinófilo, homogéneo en glomérulos tubulointersticial y paredes vasculares.
Foto 2: Técnica inmunohistoquímica frente a amiloide AA.
Bazo: en el parénquima esplénico existen dos tipos de patrones histológicos. En el primero el amiloide se deposita a nivel folicular pudiendo ocupar todo el folículo en estadios avanzados. Macroscópicamente se pueden ver pequeños gránulos que se denomina bazo en sagú (sago spleen). El segundo patrón es la afectación sinusoidal con depósitos a nivel de la pulpa roja esplénica denominándose bazo de aspecto lardáceo (lardaceous spleen).
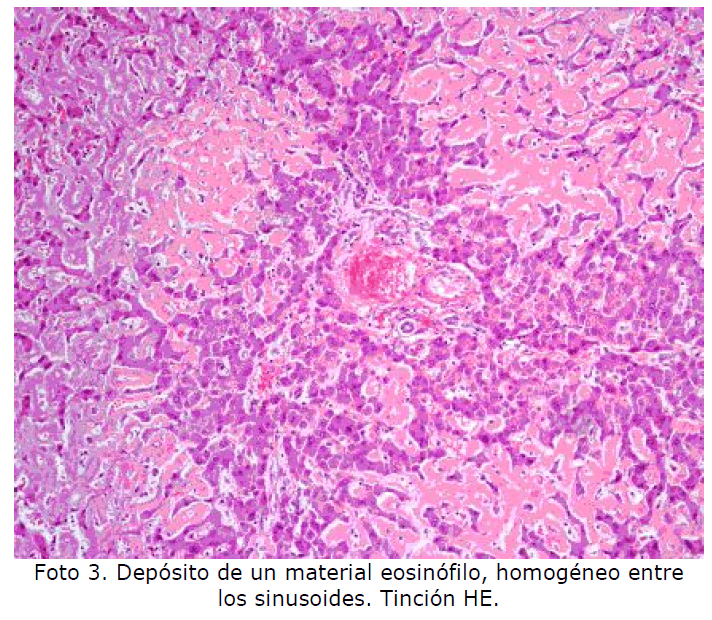
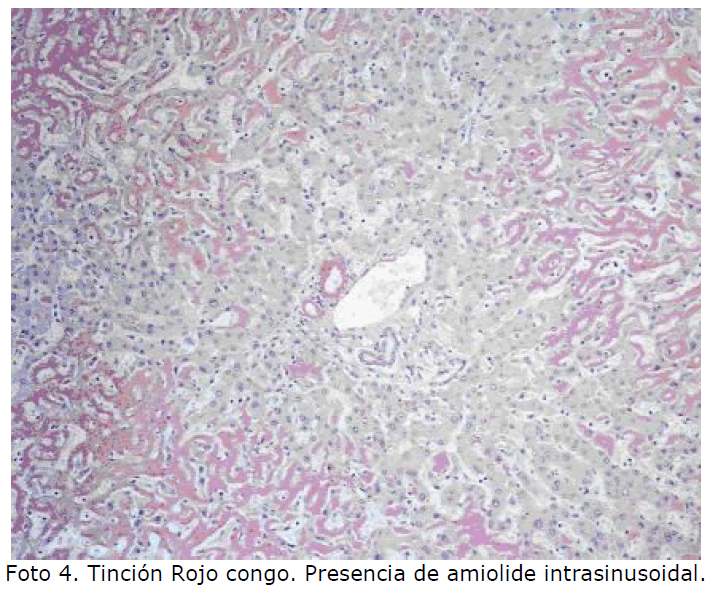
Hígado: el espacio de Disse es donde se deposita el amiloide y progresivamente se extiende a sinusoides y hepatocitos pudiendo llegar a sustituir gran parte del parénquima hepático. Es frecuente la afectación vascular e incluso el depósito intracelular en las células de Kupffer (Foto 3, Foto 4). Foto
Foto 3: Dipósito de un material eosinófilo, homogéneo entre los sinusoides. Tinción HE.
Foto 4. Tinción Rojo congo. Presencia de amiolide intrasinusoidal.
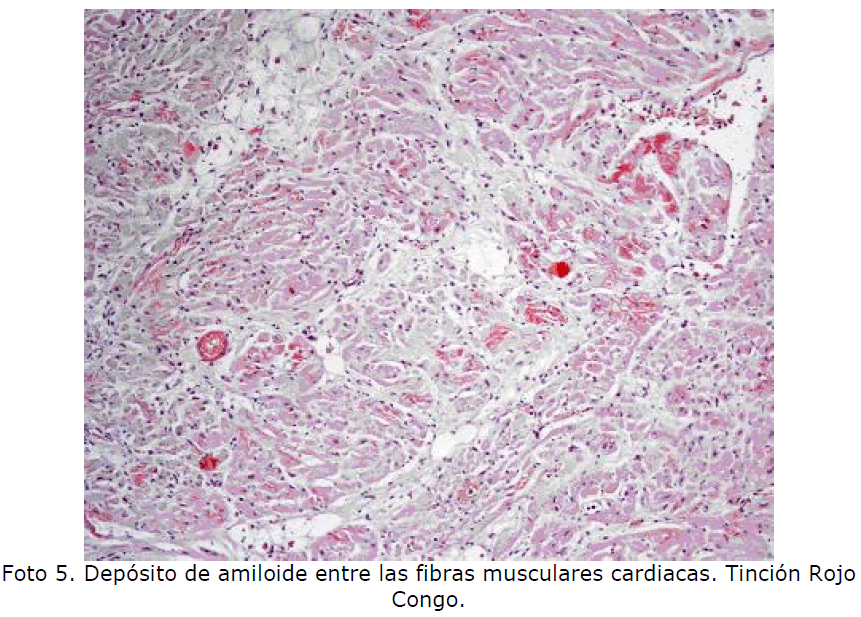
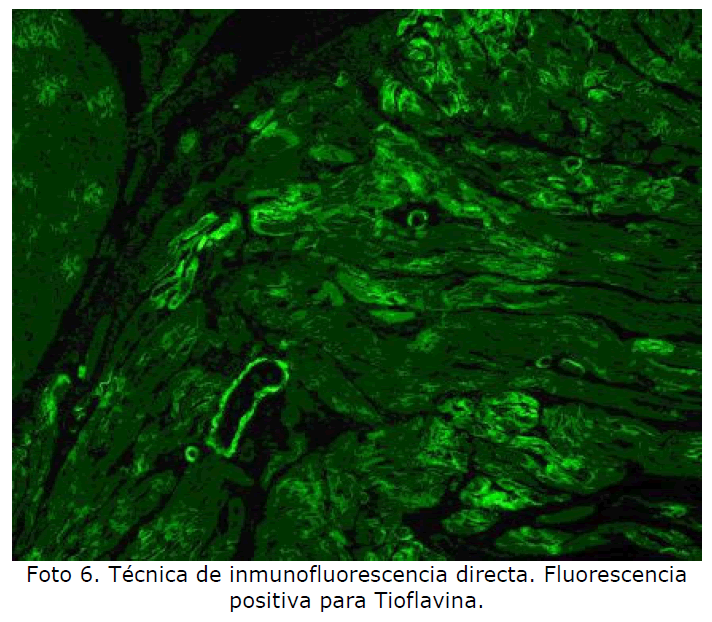
Corazón: el amiloide se deposita primero en subendocardio y se va extendiendo al miocardio entre las fibras musculares. El sistema de conducción se puede alterar produciendo cuadros de arritmias (Foto 5, Foto 6). Otros órganos: tiroides, suprarrenal, tracto gastrointestinal, lengua, piel.
Foto 5. Depósito de amiloide entre las fibras musculares cardiacas. Tinción Rojo Congo.
Foto 6. Técnica de inmunofluorescencia directa. Fluorescencia positiva para Tioflavina.
Bibliografía:
Abbas AK. Diseases of immunity. En: Robbins SL, Cotran RS, editors. Pathologic basis of disease. Philadelphia: Saunders, 2005; p. 193-269.
Rosai J, editors. Surgical Pathology. Philadelphia: Mosby-elsevier, 2004.
Sternberg SS, editors. Diagnostic surgical pathology. Philadelphia: Lippincott Williams and Wilkins, 1999.
Pérez Martínez J, Llamas F, López A, Massó P, Poblet E, López E, Gallego E, Gómez Roldán C. Amiloidosis primaria asociada a déficit severo de Factor X. Nefrologia. 2004;24(5):493-8.
1309