Key Words
Epilepsy, anti-epilepsy drugs
Epilepsia
La mayoría de los estudios estiman la incidencia de la epilepsia entre el 0.5 y 2% del total de la población. Se trata de una alteración funcional cerebral caracterizada por la aparición periódica e impredecible de crisis. Se define como "crisis" a la alteración transitoria de la conducta, y al desorden sincrónico y rítmico de un grupo de neuronas epilépticas y no epilépticas. [1]
Anatomía Funcional De La Epilepsia
La epilepsia se debe a una despolarización excesiva (facilitación) de la membrana de las neuronas epileptógenas que origina, por un lado, una descarga neuronal unitaria de alta frecuencia y, por el otro, cambios hiperpolarizantes compensatorios (inhibición) que tratan de regular esta descarga. Además, la epilepsia se debe a un reclutamiento anormal de las neuronas del conglomerado epiléptico (foco epiléptico) y de las neuronas vecinas o distantes (sistema epiléptico), lo que origina una hipersincronía de las descargas neuronales individuales.
Así, despolarización-hiperpolarización y descargas neuronales excesivas e hipersincrónicas son la esencia de la actividad convulsiva, y estos fenómenos son comunes a todos los tejidos cerebrales epilépticos, independientemente de la causa que los produce y de la región cerebral de que se trate.
Actualmente se sabe que el cambio paroxístico despolarizante (CPD) se origina por un exceso de impulsos excitatorios que afectan a la membrana neuronal y que en el caso de los focos epilépticos corticales, provienen de circuitos locales intracorticales o del tálamo. Por otra parte la hipersincronía de la descarga local se debe a un cambio paroxístico hiperpolarizante (CPH) consecutivo al CPD. La proporción y la secuencia alterna entre CPD y CPH dan como consecuencias:
1. La generación de espigas electroencefalográficas locales en el foco epiléptico.
2. La generación de impulsos que se propagan a otros sitios del cerebro y a los músculos, donde se originan actividades epileptiformes a distancia y contracciones musculares espasmódicas, respectivamente. Cuando los CPD son breves y predominan los CPH se producen espigas electroencefalográficas aisladas llamadas “interictales” porque generalmente carecen de expresión sintomática. Sin embargo, cuando estos cambios ocurren en la corteza motora y existe una permeabilidad fisiológica de las vías corticoespinales, estas espigas interictales se acompañan de sacudidas musculares.
Estas descargas ictales se acompañan generalmente de manifestaciones clínicas que se explican como resultado de la propagación de impulsos tonicoclónicos del sitio cerebral involucrado a diversos grupos musculares. En el caso de las crisis focales motoras hay adversión de la cabeza y el cuello (fase tónica), y sacudidas de los músculos faciales y las extremidades contralaterales al foco epiléptico (fase clónica). En el caso de las crisis convulsivas generalizadas se presenta hiperextensión de los músculos del cuello y de otros músculos proximales (fase tónica), además de sacudidas bilaterales de los músculos distales y proximales (fase clónica). No obstante que estas fases de la crisis epiléptica se encuentran presentes en una sola neurona, debe señalarse que la propagación de impulsos tónicos y clónicos del foco epiléptico a los músculos se realiza diferencialmente por vías piramidales y extrapiramidales. Estas fases electroencefalográficas de las crisis convulsivas presentan fenómenos clínicos paralelos y equivalentes en las crisis parciales sensoriales simples y complejas. [1,2]
Cambios Celulares En El Foco Epileptico
No se conoce claramente el mecanismo por el cual las lesiones cerebrales producen crisis epilépticas, pero se ha considerado que el tejido cortical perilesional, más que la lesión epiléptica en sí misma, es el responsable de las convulsiones. En los inicios de la investigación, se describió una zona de sustancia gris parcialmente destruida, con una vascularización anormal alrededor de las cicatrices epileptógenas corticales, en bloques del lóbulo temporal extirpado a pacientes epilépticos cuyas crisis ameritaron un tratamiento quirúrgico. Las descargas paroxísticas electroencefalográficas de estos pacientes se originan en esta zona, su estimulación eléctrica reproduce el patrón clínico de las crisis espontáneas y su extirpación quirúrgica suprime o atenúa significativamente los ataques epilépticos.
Durante la etapa convulsiva la corteza cerebral adyacente a la lesión epiléptica muestra una reducción significativa en su espesor y en el número de células en todas las capas corticales. Durante la etapa de remisión se observa una reducción en el espesor y la composición celular corticales significativamente mayor que en la etapa convulsiva.
En estudios con microscopía electrónica, las células piramidales mostraron evidencia de una degeneración lenta y progresiva: aumento de la densidad de la matriz citoplásmica, desorganización de los elementos intraterminales, dilatación de las vesículas en los botones terminales y deformación de las mitocondrias.
Estos cambios se mostraron incipientes en la etapa de latencia; en la convulsiva fueron preponderantes y en la de remisión se encontró una despoblación neuronal y glial total en el tejido cortical perilesional. [1]
Clasificación De La Epilepsia
Según la Commission Classification and Terminology of the International League Against Epilepsy (1981), las enfermedades epilépticas se clasifican en parciales y generalizadas. [3]
Existen una serie de mecanismos que posiblemente intervienen en el desarrollo de la crisis epiléptica:
• Cambios en las proteínas de membrana
• Niveles alterados de neurotransmisores (GABA, glutamato) y neuropéptidos endógenos. Alteraciones en el GABA. Potenciación de las respuestas mediadas por receptores glutaminérgicos (NMDA) con alteraciones en el flujo iónico.
• Cambios en la relación intra y extracelular de iones. Aumento de iones potasio en el espacio extracelular que favorece una hiperactividad constante.
• Influencias colinérgicas y monoaminérgicas sobre la zona epileptógena que pueden hacer variar su extensión intercrítica
Teorías actuales plantean posibles anomalías en la migración neuronal durante la 7ª-10ª semana de gestación que puede ser el denominador común de la crisis.
• Las neuronas del tálamo tienen una propiedad intrínseca: "Corriente en T o corriente de bajo umbral" regulada por iones calcio. Genera espigas/ondas a un ritmo de 3/s. Así, en contraste con el pequeño tamaño de estas neuronas talámicas, la corriente en T amplifica las descargas.
La fisiopatología de las crisis se puede resumir en tres factores íntimamente relacionados:
1.- Modificaciones intrínsecas de la permeabilidad de la membrana, probablemente un fallo de la ATPasa-Na/K, que podrían inducir una disminución de la conductancia a los iones K y aumento de la conductancia a los iones Ca++ o Na+ a través de los canales iónicos.
2.- Reducción de los mecanismos de control inhibitorios; Ej: GABA (neurotransmisor inhibidor).
3.- Acoplamiento sináptico excitador entre neuronas de la región epileptógena. Este acoplamiento es el que va a producir una sincronización no fisiológica entre neuronas y posteriormente puede propagarse a zonas vecinas y, en ocasiones, generalizarse a toda la corteza cerebral, lo que explica que las manifestaciones puedan ser localizadas, propagadas a regiones vecinas o secundariamente generalizadas. [1]
Tratamiento De La Epilepsia
Medidas Generales
Las limitaciones que se imponen al epiléptico son: no ingestión de bebidas alcohólicas, suspensión de medicamentos sin prescripción médica y la permanencia en lugares peligrosos para el paciente. Se debe brindar información adecuada a la familia en cuanto a la enfermedad, tratamiento, reacciones adversas del mismo y pronóstico del paciente [1].
Tratamiento Medico
El primer tratamiento médico eficaz en el control de la epilepsia se basaba en la utilización de depresores no específicos del SNC. Sir Charles Locock introduce los bromuros en la mitad del siglo XIX y el fenobarbital fue adaptado en 1912 después de las observaciones de Hauptmann. Actualmente han surgido una serie de nuevos antiepilépticos que intentan incrementar la eficacia del tratamiento y reducir los efectos secundarios. 4
Son tres los mecanismos principales de actuación de los fármacos anticomiciales, en donde cada fármaco actúa a varios niveles:
• Aumento de la inhibición sináptica mediada por el GABA. En presencia del GABA, el receptor GABAa, se abre y se produce un flujo de iones cloro que aumenta la polarización de la membrana. Existen fármacos que disminuyen el metabolismo del GABA ( ácido valproico, vigabatrina) y otros actúan sobre el receptor GABAa (barbitúricos, benzodiacepinas, felbamato, topiramato).
• Inhibición de los canales de iones sodio (hidantoinas, carbamacepina, ácido valproico, lamotrigine, felbamato, topiramato, zonisamide) y del calcio (pentobarbital). Algunos también actúan sobre los receptores del glutamato.
• Reducción o inhibición del flujo de calcio a través de los canales de calcio tipo T (principal mecanismo de los fármacos que controlan las crisis de ausencia): ácido valproico, etosuximida, trimethadiona, zonisamida. 5
Fármacos
1) Barbitúricos: Fenobarbital y pentobarbital. Actúan sobre el receptor GABAa, aumentando la inhibición mediada por el neurotransmisor. El más utilizado es el fenobarbital en dosis de 2-4 mg/kg/día. El pentobarbital es más liposoluble y penetra con mayor rapidez en el cerebro que el fenobarbital. Actúa bloqueando la entrada de calcio en las terminales presinápticas y, por lo tanto, inhibe la liberación del neurotransmisor glutamato.
2) Hidantoinas: Actúan inhibiendo los canales del ion Na+. Difenilhidantoina en dosis de 3-5 mg/kg/día. La fosfenitoina es el éster fosfato disódico de 3-hidroximetil-5-5 difenilhidantoina que se convierte en fenitoina por acción de fosfatasas circulantes.
3) Benzodiacepinas: Aumentan el flujo de iones cloro por apertura del receptor GABAa. Las más utilizadas: diazepam, clonazepam y también el lorazepam y nitrazepam. Actualmente por su gran potencia se está utilizando el clobazam.
4) Iminostilbenes: Carbamacepina. Actúan inactivando los canales de Na+. Dosis de 10 mg/kg/día.
5) Valproato sódico: Mecanismo de inactivación de canales de sodio de forma igual que la hidantoinas y carbamacepina. Disminuye o inhibe la corriente en T como la etosuximida y trimethadiona. In vitro aumenta la síntesis de GABA. Dosis: 30 mg/kg/día.
6) Deoxibarbitúricos: Primidona. Mecanismo de acción propio del fármaco y de los metabolitos activos principalmente el fenobarbital. Dosis:10-20 mg/kg/día.
7) Succimidas: Etosuximida. Actúa reduciendo la corriente en T talámica
8) Oxazolidinedionas:Trimetiloxazolidindiona. Parametadiona.
Trimethadiona. Actúan inhibiendo la corriente en T.
9) Acetazolamida: Potente inhibidor de la anhidrasa carbónica utilizado como antiepiléptico desde hace más de 40 años. Produce un acúmulo de CO2 a nivel cerebral por inhibición del 90% de la anhidrasa carbónica localizada en la neuroglia, mielina y plexo coroideo
10) Otros fármacos relacionados con el GABA: Entre los que se incluyen los nuevos fármacos antiepilépticos. Progabide y g-vinil-GABA (vigabatrin), lamotrigine, acetazolamida, topiramato, tiagabine, gabapentin y felbamato (aprobado por la FDA en 1993 para el tratamiento de las crisis parciales, eficaz en el síndrome de Lennox Gastaut).
Anticonvulsivos: Los anticonvulsivos según su mecanismo de acción pueden dividirse en: drogas antiepilépticas específicas y no específicas. Las primeras actúan modificando la conducción de iones a nivel de la membrana excitable. A éste grupo pertenecen las fenitoinas, carbamacepina y el valproato. Las no específicas (barbitúricos, benzodiacepinas) tienen efecto depresor sobre el SNC al relacionarse con la acción del ácido gammaaminobutírico.
Existen algunas características específicas de los anticonvulsivos relacionadas con la edad. La disposición de las drogas en sangre depende de tres factores fundamentales que son: la afinidad de las proteínas plasmáticas a unirse a ellas, el contenido de agua del cuerpo y el desarrollo de los biotransformadores hepáticos; por tanto, en los pequeños es más fácil obtener cantidades terapéuticas en sangre que en el adulto, pero con una vida media más corta.
Por último, debemos recordar que en los niños el uso prolongado de algunos anticonvulsivos puede producir trastornos del metabolismo de los huesos, disfunciones hepáticas y modificación de los sistemas inmunitarios.
No hay una droga antiepiléptica más eficaz que otra, su efectividad depende del tipo de crisis y del paciente al que se le va a administrar. No obstante, en la actualidad se prefiere el uso de la carbamacepina por la menor cantidad de reacciones secundarias. Existen algunos tipos de epilepsia que requieren regímenes terapéuticos específicos. [1,6]
Cuando el paciente logra un control de los ataques queda por determinar el momento de supresión de la medicación. Hay autores que aconsejan comenzar la disminución lenta de los anticonvulsivos a los dos años del control y otros recomiendan su retirada paulatina a los cuatro o cinco años de no presentarse manifestaciones clínicas, basados en los resultados del último electroencefalograma (EEG).
En otras oportunidades, a pesar de la terapéutica medicamentosa, no se logra el control de los ataques y se convierte en una epilepsia refractaria (ER) al tratamiento, condición en la que debe analizarse la posibilidad de tratamiento quirúrgico.
Finalmente, nos referiremos a un esquema de tratamiento recomendado por Aicardi, según el tipo de epilepsia, donde relaciona las drogas anticonvulsivas y las clasifica de primera o segunda línea acorde a la respuesta terapéutica.
1.- Crisis parciales y tónico-clónicas generalizadas primaria o secundariamente:
• Drogas de 1ra línea: Carbamacepina, fenitoina, primidona, fenobarbital.
• Drogas de 2da línea: Valproato de sodio/ácido valproico, clonazepan, acetozolamida, sultiano, clobazan.
• Drogas de 3ra línea: Mesantoina, etosuximida, bromuros.
2.- Ausencias, Epilepsia mioclónica juvenil, crisis atónicas o tónicas:
• Drogas de 1ra línea: Etosuximida, valproato de sodio/ácido valproico.
• Drogas de 2da línea: Clonazepan, acetozolamida, sultiano, primidona, fenobarbital.
• Drogas de 3ra línea: Trimetadiona, nitrazepan, parameta-diona
3.- Espasmos infantiles:
• Drogas de 1ra línea: ACTH, esteroides.
• Drogas de 2da línea: Acido valproico/valproato de sodio, nitrazepan, clobazan, clonazepan. [1,7]
Tratamiento Quirurgico
El manejo quirúrgico de la epilepsia es una opción importante para los niños con crisis epilépticas resistentes al tratamiento. Aunque la cirugía ha sido en ocasiones pospuesta hasta la adolescencia o edad adulta, los avances recientes han permitido una clasificación temprana de las crisis y la selección del caso quirúrgico.
El tratamiento quirúrgico de la epilepsia hoy día tiene gran interés y es efectivo debido a la estrecha cooperación que hay entre el neurólogo, radiólogo, neuropsicólogo y el cirujano, aunado a otros aspectos como lo son :
1.- La posibilidad de realizar EEG acoplado a cámaras de video.
2.- La posibilidad de monitorear en sangre las drogas antiepilépticas.
3.- Por los daños que se producen desde el punto de vista biológico, por el descontrol
de las crisis; así como por las repercusiones sobre la vida del enfermo desde el punto de vista psico-social, entre otras.
Evaluación Pre-quirúrgica
Una mayor sensibilidad en las técnicas imagenológicas como son: tomografía axial computarizada (TAC), resonancia magnetica nuclear (RMN), tomografía de positrones por emisión (PET), y las técnicas electroencefalográficas (EEG), entre otras, han permitido detectar focos que antes pasaban inadvertidos, lo que unido a los adelantos en la cirugía posibilitan la resección de los mismos con el menor daño al tejido sano circundante. Lo ideal en el tratamiento quirúrgico de la epilepsia es poder localizar el foco de origen de las crisis con la consiguiente ablación del mismo; pero no siempre esto es posible. Se han propuesto diversos procedimientos operatorios: Resección parcial de un foco, lobectomía temporal, amigdalohipocampotomías, callosotomía, cirugía esterotáxica, resecciones corticales, estimulación cerebelosa y hemisferectomía, estimulación o inhibición vagal, etc. Lo cierto es que en la actualidad predomina la cirugía encaminada a la resección del foco epileptógeno y la interrupción de vías. Los tres procedimientos que han brindado mejores resultados y que mas se usan en la actualidad son las resecciones de foco, la hemisferectomía y la callosotomía. [1,8,9,10,11]
Otros Tratamientos Para Epilepsias Refractarias
Estimulador vagal
El estimulador vagal es una nueva técnica para el control de las crisis refractarias. Está indicado en crisis parciales y permite una reducción del número de crisis en aproximadamente un 30% de los pacientes. La indicación de su implantación debe de ser hecha en Unidades de Epilepsia y su implantación requiere un cirujano familiarizado con la técnica. [12]
Dieta cetogéna
La dieta cetogéna está indicada en niños con epilepsia resistente a medicaciones, ya sea parcial o generalizada. Recientes ensayos aleatorizados han demostrado que la dieta es altamente eficaz en el 30-50% de estos pacientes. La iniciación de la dieta precisa un ingreso hospitalario y un equipo médico multidisciplinario (neurólogo, pediatra, dietista) con experiencia en este tratamiento. Dado que la dieta es muy restrictiva y requiere la ingestión de importantes cantidades de grasas se considera su uso sólo en pacientes que hayan sido resistentes o hayan presentado importantes efectos adversos con los fármacos antiepilépticos (FAE). [13,14].
Nuevos Fármacos Antiepilépticos Y Sus Características
A continuación, en el Cuadro 1 se revisan de forma breve las características de los nuevos fármacos más utilizados en la terapia contra la epilepsia. [15-35].
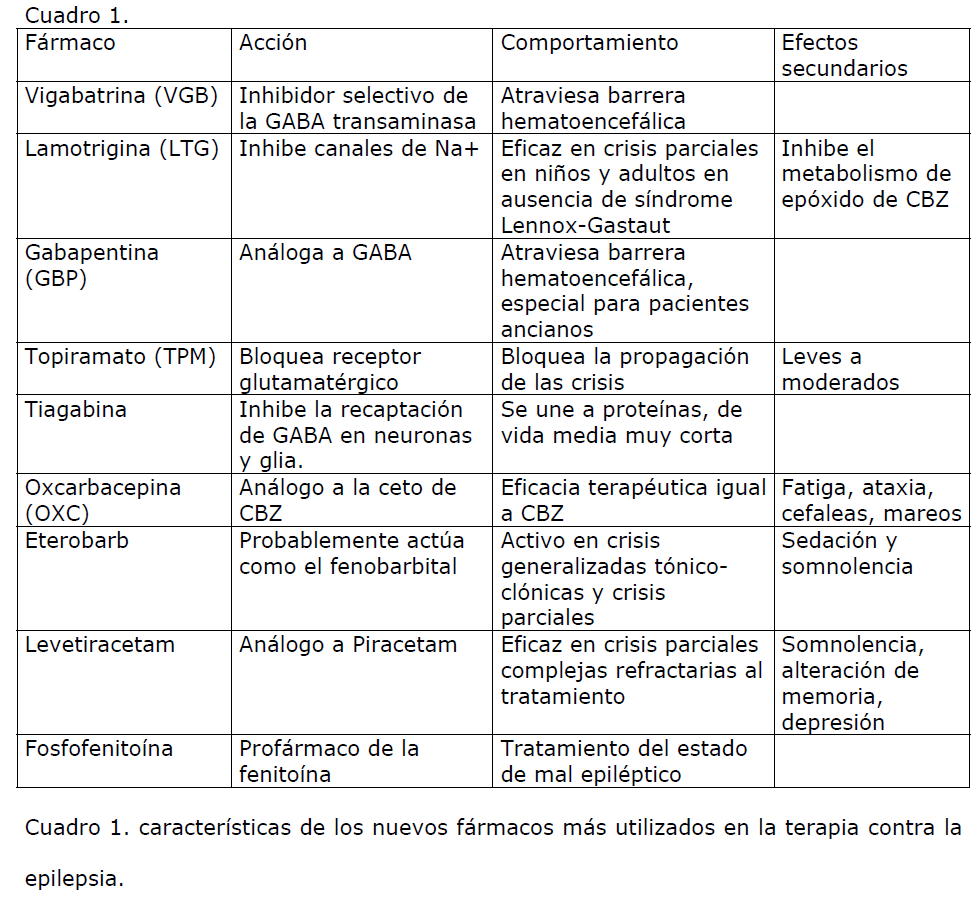
Cuadro 1. características de los nuevos fármacos más utilizados en la terapia contra la epilepsia.
Conclusiones
Los nuevos FAE, aunque no cumplen todas las características del antiepiléptico ideal, ofrecen numerosas ventajas sobre los FAE tradicionales. Algunos tienen un mecanismo de acción conocido, lo que permite una estrategia terapéutica más apropiada. Varios tienen características farmacocinéticas muy interesantes: se absorben fácilmente, se eliminan sin modificarse principalmente por la orina y no son susceptibles de inducción o eliminación enzimática, siendo su potencial de interacción mínimo. Sin embargo, no hay que perder de vista que aunque las características farmacocinéticas son importantes, estas son secundarias a las propiedades farmacodinámicas. Para sustituir a los antiepilépticos convencionales, los nuevos FAE deberán tener una mejor eficacia clínica.
Ninguno de los fármacos incorporados recientemente o en investigación clínica domina claramente en términos de eficacia y seguridad. Todos tienen, además, la desventaja potencial de un elevado costo. El médico deberá familiarizarse y desarrollar su propia experiencia con los nuevos FAE para administrarlos correctamente, ya sea en el tratamiento primario o secundario de las epilepsias.
La investigación futura deberá definir con más exactitud el campo de acción específico de cada nuevo fármaco y su acción sobre determinados tipos de crisis (espectro) y posición dentro del tratamiento de las epilepsias de nuevo diagnóstico (monoterapia o politerapia). El conocimiento de las bases bioquímicas de las epilepsias es esencial para el desarrollo de nuevos fármacos, al igual que el refinamiento de modelos experimentales que permitan simplificar los procedimientos de evaluación de moléculas potencialmente útiles. La investigación debe seguir en todos los campos que puedan ofrecer alguna esperanza de prevención o tratamiento, como la genética o la biología molecular, que ya están dando frutos en otras áreas de la neurología.
1398
References
- Goyenechea Gutiérrez F, García R. Tratamiento quirúrgico de la epilepsia. www.compendium.com.ar/neuroc99/text/ttoepilepsia.htm
- Rees Cosgrove G, Cole AJ. Surgical treatment of epilepsy. Functional and Stereotactic Neurosurgery. https://neurosurgery.mgh.harvard.edu/functional/ep-sxtre.htm.
- Commission classification and terminology of the international league against epilepsy. Epilepsy. 1981;22(4):489-501
- Mattson RH, Williamson PD, Hanahan E. Eterobarb therapy in epilepsy. Neurology. 1976; 26:1014-7.
- Armijo JA. Mecanismos de acción de los fármacos antiepilépticos. En: Herranz J.L., Armijo J.A. editores. Actualización de las epilepsias (II). Barcelona: Ediciones Consulta, S.A. 1992. p. 101-22.
- Rogawski MA, Porter RJ. Antiepileptic drugs: pharmacological mechanisms and clinical efficacy with consideration of promising developmental stage compounds. Pharmacological Reviews. 1990;42:223-186.
- Mattson RH. Current challenges in the treatment of epilepsy. Neurology. 1994;44:S4-S9.
- Aicardi J. Clinical approach to the management of intractable epilepsy. Dev Med child Neurol. 1988;30(4):429-440.
- Fusco L, Vigevano F. Indications for surgical tretment of epilepsy in childhood: a clinical and neurophysiological approach. Acta Paediatr Suppl. 2004;93(445):28-31.
- Arroyo S. Surgery for epilepsy: evaluation and indication. Neurología. 1996;11 (Suppl 4):122-128.
- Uthman BM, Wilder BJ, Penry JK, Dean C, Ramsey RE, Reid SA, Hammond EJ, et al. Treatment of epilepsy by stimulation of the vagus nerve. Neurology. 1993;43:1338-1345.
- Freeman JM, Vining EPG, Pillas DJ, Pyzik PL, Casey JC, Kelly LMT. The efficacy of the ketogenic diet-1998: A prospective evaluation of intervention in 150 children. Pediatrics. 1998;102:1358-1363.
- Vining EP, Freeman JM, Ballaban-Gil K, et al. A multicenter study of the efficacy of the ketogenic diet. Arch Neurol. 1998;55:1433-1437.
- Mattson RH, Cramer JA. The choice of antiepileptic drugs in focal epilepsy. En: Wyllie E, editor. The treatment of epilepsy: principles and practice. Philadelphia: Lea & Febiger. 1993. p. 817-23.
- Patsalos PN, Duncan JS. Antiepileptic drugs. A review of clinically significant drug interactions. Drug Safety. 1993;9:156-84.
- Porter RJ, Rogawski MA. Potential antiepileptic drugs. En: Wyllie E, editor. The treatment of epilepsy: principles and practice. Philadelphia: Lea & Febiger. 1993. p. 974-85.
- Ramsay RE. Advances in the pharmacotherapy of epilepsy. Epilepsia. 1993;34:S9-S16.
- Patsalos PN, Duncan JS. New antiepileptic drugs: a review of their current status and clinical potential. CNS Drugs. 1994;2:40-77.
- Bialer M. Comparative pharmacokinetics of the newer antiepileptic drugs. Clin Pharmacokinet. 1993;24:441-52.
- MacDonald RL, Kelly KM. Mechanisms of action of currently prescribed and newly developed antiepileptic drugs. Epilepsia. 1994;35:S41-S50
- Walker MC, Sander JW. Developments in antiepileptic drug therapy. Curr Opin Neurol. 1994;7:131-9.
- Kälviäinen R, Keränen T, Riekkinen PJS. Place of newer antiepileptic drugs in the treatment of epilepsy. Drugs. 1993;46:1009-24.
- Dichter MA, Brodie MJ. New antiepileptic drugs. N Engl J Med. 1996;334:1583- 90.
- Feucht M, Brantner-Inthaler S. Gamma-vinyl GABA (vigabatrin) in the therapy of Lennox-Gastaut syndrome: an open study. Epilepsia. 1994;35:993-8.
- Appleton RE. The role of vigabatrin in the management of infantile epileptic syndromes. Neurology. 1993;43:S21-S23
- Mackenzie R, Klistorner A. Severe persistent visual field constriction associated with vigabatrin. Asymptomatic as well as symptomatic defects occur with vigabatrin [letter]. BMJ. 1998;316:233.
- Brodie MJ. Lamotrigine versus other antiepileptic drugs: a star rating system is born. Epilepsia. 1994;35:S41-S46.
- Langtry HD, Gillis JC, Davis R. Topiramate. A review of its pharmacodynamic and pharmacokinetic properties and clinical efficacy in the management of epilepsy. Drugs. 1997;54:752-73.
- Sander JW. Practical aspects of the use of topiramate in patients with epilepsy. Epilepsia. 1997;38 Suppl 1:S56-8.
- Baruzzi A, Albani F, Riva R. Oxcarbazepine: pharmacokinetic interactions and their clinical relevance. Epilepsia. 1994;35:S14-S19.
- Brodie MJ, Porter RJ. New and potential anticonvulsants. Lancet. 1990;336:425-6.






