Investigating Article - (2023) Volume 19, Issue 1
Como programar el ventilador mecanico How to program the mechanical fan
Isaias Garcerant Campo1*,
Gustavo Andrés Solano Sopo1,
Ronald Castro A humada1,
José Correa Guerrero2,
Carmelo Dueñas3,
Karen Perales Caballero4,
Ruber Rodriguez Diaz5 and
Juan Esteban Tafur Delgado6
1Especialista en Medicina Critica y Cuidado Intensivo, Universidad Simón Bolívar, Colombia
2Especialista en Medicina Interna Fellow de Medicina Critica y Cuidados Intensivos, Universidad de Cartagena, Colombia
3Especialista en Medicina Critica y Cuidado Intensivo-neumólogo, Universidad de Cartagena, Colombia
4Medico Intensivista, Universidad Simón Bolívar, Colombia
5Medico Geneneral, Universidad del Sinu, Elias Bechara Zainum Montería Cordoba, Colombia
6Residente de pediatría-Tercer año, Universidad del Sinú, Montería, Colombia
*Correspondence:
Isaias Garcerant Campo, Especialista en Medicina Critica y Cuidado Intensivo, Universidad Simón Bolívar,
Colombia,
Email:
Received: 04-Jan-2023, Manuscript No. ipadm-23-13440;
Editor assigned: 06-Jan-2023, Pre QC No. ipadm-23-13440;
Reviewed: 20-Jan-2023, QC No. ipadm-23-13440;
Revised: 22-Jan-2023, Manuscript No. ipadm-23-13440;
Published:
30-Jan-2023, DOI: 10.36648/1698-9465.23.19.1580
Introducción
L a ventilación mecánica representa una alternativa terapéutica
que brinda la oportunidad de suministrar un soporte avanzado
de la vía aérea en pacientes con limitación de la entrada de aire
[1].
Dado el concepto, para mejorar la mortalidad a corto plazo
que ocasiona el distrés respiratorio agudo, es necesario
identificar factores potencialmente modificables asociada a
dicha mortalidad, en el estudio LUNG SAFE identificaron que la
modificación de variables como PEEP alta, Presión pico (Pico),
presión meseta (Pm) y presión de conducción (VP) disminuida, al
igual que una frecuencia respiratoria baja se asocian con mayor
supervivencia [2].
Se estima que la mortalidad en pacientes con distrés respiratorio
agudo (SDRA) en las últimas dos décadas, se encuentra alrededor
del 44% [3-5].
La ventilación mecánica con presión positiva (VPP) trae
complicaciones como: aumento de las presiones intra y
extrapulmonares, neumonía asociada al ventilador en un 14-28%,
cor pulmonar 50%, barotrauma y neumotórax 6-12%, derrame
pleural 80%, respuesta fibroproliferativa 50% [6].
Por ende, debemos conocer los principios fisiológicos de la
ventilación mecánica con presión positiva, funcionamiento y
programación de dicho dispositivo. A continuación, revisaremos
algunos principios fisiológicos de la presión positiva en la vía aérea.
Cambios fisiológicos de la Presión Positiva
La presión positiva puede reducir el gasto cardíaco y la presión
arterial media, a través de la disminución del retorno venoso y
por lo tanto del llenado ventricular (Figura 1). En los pacientes
con una pobre función ventricular izquierda y edema pulmonar,
la adición de presión positiva puede mejorar el gasto cardíaco
por la mejoría del volumen sistólico [7].
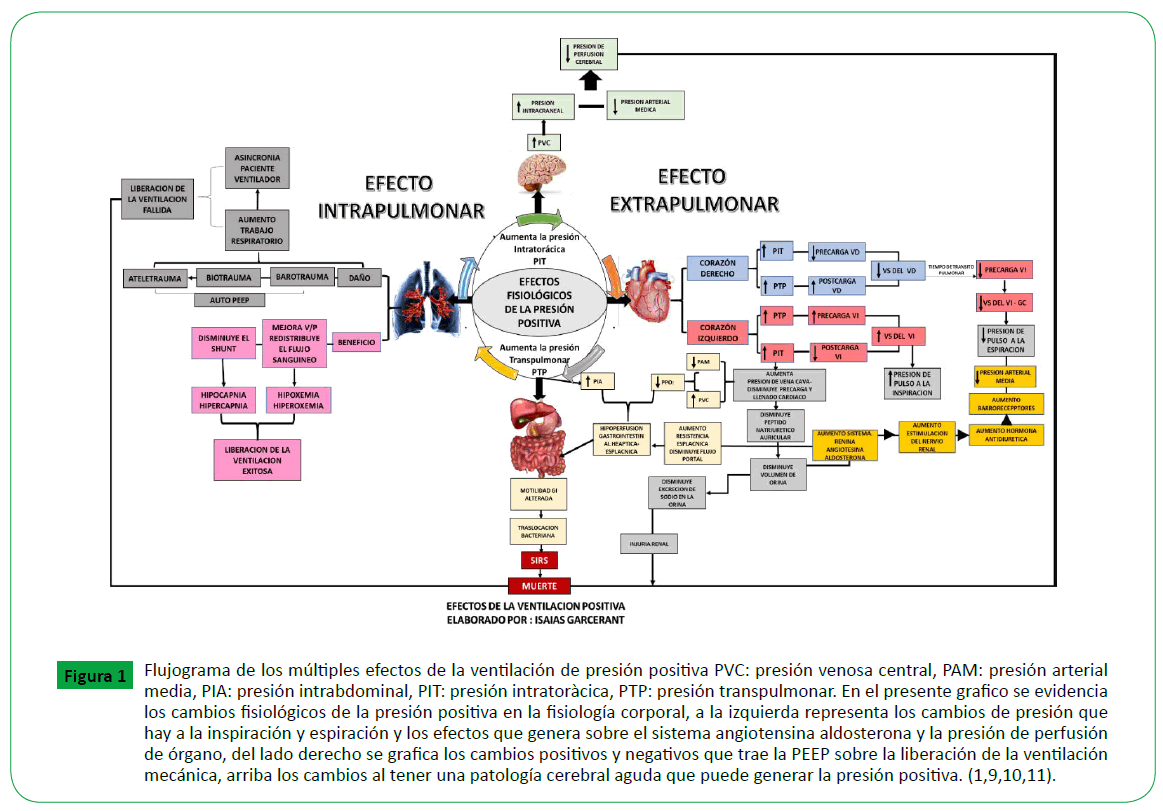
Figure 1. Flujograma de los múltiples efectos de la ventilación de presión positiva PVC: presión venosa central, PAM: presión arterial media, PIA: presión intrabdominal, PIT: presión intratoràcica, PTP: presión transpulmonar. En el presente grafico se evidencia los cambios fisiológicos de la presión positiva en la fisiología corporal, a la izquierda representa los cambios de presión que hay a la inspiración y espiración y los efectos que genera sobre el sistema angiotensina aldosterona y la presión de perfusión de órgano, del lado derecho se grafica los cambios positivos y negativos que trae la PEEP sobre la liberación de la ventilación mecánica, arriba los cambios al tener una patología cerebral aguda que puede generar la presión positiva. (1,9,10,11).
La retención de líquidos y una diuresis disminuida son
comúnmente observadas en los pacientes a quienes se adiciona
presión positiva. Esta combinación aumenta la producción de la
hormona antidiurética, disminuyen la presión de perfusión media
de la arteria renal y la perfusión redistribución de la corteza,
reducen el flujo urinario, disminuyen el clearance de creatinina y
la fracción excretada de sodio [8].
Funcionamiento del Ventilador Mecánico
El funcionamiento básico de un ventilador va a acorde con el
ciclo ventilatorio se compone de la inspiración y espiración. Tiene
cuatro fases, una de insuflación, una meseta, una de deflación
y la pausa espiratoria. Se denomina ciclado al cambio de fase
inspiratoria a la espiratoria, el cual depende del mecanismo del
ventilador. Durante la inflación se genera una presión sobre un
volumen de un gas, haciendo que se presente la apertura de la
válvula inspiratoria y movilizando un volumen corriente a expensas
de un gradiente de presión en los alveolos y el flujo respiratorio
[8-11]. En la fase de meseta se presenta una pausa inspiratoria
que es el final de la insuflación y el comienzo de la espiración
para facilitar la distribución del gas. La suma del tiempo que
tarda la insuflación y la pausa inspiratoria se denomina tiempo
inspiratorio. La deflación se inicia con la apertura de la válvula espiratoria y ocurre de forma pasiva por la retracción elástica
pulmonar y la pausa espiratoria que comprende el tiempo entre
la deflación y el comienzo de la siguiente espiración, y no hay
presencia de flujo. Cada una de estas fases a su vez tiene presión,
el volumen, el flujo y tiempo que a su vez permiten evaluar y
clasificar los ventiladores [12] (Figura 2).
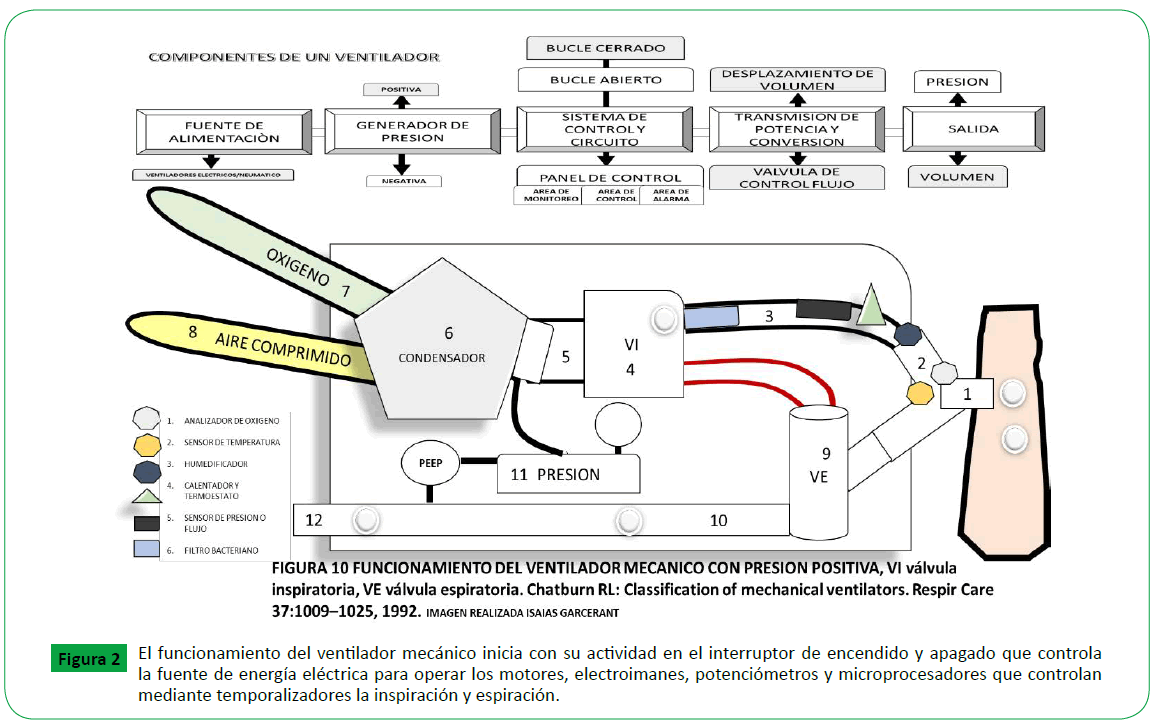
Figure 2. El funcionamiento del ventilador mecánico inicia con su actividad en el interruptor de encendido y apagado que controla la fuente de energía eléctrica para operar los motores, electroimanes, potenciómetros y microprocesadores que controlan mediante temporalizadores la inspiración y espiración.
El ventilador tiene 2 tipos de circuito:
• Asa abierta (el ventilador no puede ser programado).
• Asa cerrada ("sistema inteligente" el cual el ventilador puede
ser programado).
• Tiene un Panel de mando el cual está dividido en 3 zonas:
• Área de monitoreo: Donde registra las variables que realiza
el paciente.
• Área de control: botos por el cual modifica los parámetros
a utilizar.
• Área de alarma: registra alarmas.
1. El circuito neumático externo o del paciente se conecta al
ventilador, durante la inspiración el gas llena el globo y cierra la
válvula de espiración. Esto permite que el ventilador al tener un
circuito cerrado cense el flujo de gas o de presión del paciente por
el circuito de la válvula inspiratoria lo que genera el disparo, inicio
de la fase inspiratoria, si el paciente no inicia la respiración será ventilación obligatoria, si el paciente no termina la inspiración
será ventilación asistida, pero si el paciente no recibe ayuda del
ventilador será ventilación soportada o espontanea [13-74].
2. Existen unos sensores de flujo y presión que evalúan el
esfuerzo inspiratorio para abrir la válvula inspiratoria y se conoce
como “trigger” si es censado por presión lo hace a 1 cmH20
(115milisegungo), si es censado por flujo es a 2 litros x minuto
[74] (milisegundos), si los presentes valores son más altos de lo
que tolera el paciente aumenta el trabajo respiratorio y genera
disincronía.
3. Al abrir la válvula inspiratoria pasa el gas por un sistema
humificador de temperatura y barrera antibacterial que gradúa
el gas a una temperatura constante, húmeda y aséptica.
4. En el ventilador hay un circuito interno neumático que es
una “caja negra” ”blender [6]” donde ingresa aire comprimido
(amarillo), oxigeno (verde) y se almacena, pasa por un compresor
que contiene un fuelle de resorte con válvulas solenoides que
mezcla los gases y aplica una fuerza (PRESION = FUERZA / AREA
), y crea un campo electromagnético que proporciona y genera
una presión positiva que ingresa a la vía aérea del paciente.
5. Esa presión positiva es limitada por presión o flujo y uno puede
generar 4 patrones de curvas de flujo (cuadrática, desacelerante,
acelerante, sinosoidal), al terminar la fase inspiratoria nos da la
variable de ciclo el cual va estar determinada por el flujo, volumen o tiempo y esto genera que se cierre la válvula inspiratoria y se
abra la válvula espiratoria [9], durante la espiración, el globo se
desinfla, la válvula se abre, y el gas del paciente es exhalado hasta
llegar a una línea de base y va a estar determinada por la PEEP
(presión positiva al final de la espiración). Es importante porque
controla y regula la capacidad residual funcional al estabilizar el
alveolo, evita la atelectasia y contrarresta la auto-PEEP [1,7].
Programacion basica del Ventilador Mecanico
Calcular El Peso Predicho Del Paciente: No hay duda de que un
Volumen corriente (Vt) de 6 ml / kg es el estándar de oro, tal
como se aplica en el ensayo clínico ARDSNet es considerado la
estrategia protectora en el paciente sometido a la ventilación
mecánica con SDRA, el cual se calcula sobre la base del peso
corporal predicho [17-21].
Calcular el peso corporal predicho [PBW]
Hombres = 50 + 2.3 (altura (pulgadas) – 60)
Mujeres = 45.5 + 2.3 (altura (pulgadas) -60)
Fracción Inspirada De Oxígeno [Fio2]: El oxígeno (O2) además
de ser receptor de electrones es también un oxidante fuerte,
que conduce a la formación de '' especies reactivas de oxígeno ''
(ROS). Aumentos relacionados con la hiperoxia en la producción
de ROS son particularmente pronunciados durante la isquemia
/ reperfusión y la hipoxia / Re oxigenación [13] ROS también
comparten características a pesar de su potencial tóxico son
vitales en los sistemas de defensa del huésped y como moléculas
de señalización [14]. En consecuencia, las directrices actuales recomiendan la fracción más baja de O2 inspirada (Fio 2) posible
[15], efectos pulmonares En condiciones normobáricas '', la
toxicidad del oxígeno '' se refiere a la inflamación pulmonar. En
los animales, tal toxicidad requiere a largo plazo de la exposición
o ventilación perjudicial, mientras que la ventilación pulmonarprotectora
sobre períodos más cortos no es perjudicial. En
voluntarios sanos, la exposición a O2 por un tiempo de 6-25 H
produce signos histológicos y clínicos de traqueítis o alveolitis
[16].
Varios Estudios clínicos han demostrado que PAO2 >125 MMHG
y Saturación de oxígeno (SAO2) >94% han demostrado efectos
deletéreos a nivel pulmonar, en pacientes post paro cardíaco y
aquellos sometidos a circulación extracorpórea [19].
Modo Ventilatorio: Cuando nos enfrentamos a la programación
del ventilador, Diferentes revisiones sistemáticas y metaanálisis
han concluido que no existen diferencias significativas, a la hora
ventilar los pacientes por volumen vs presión [22,23] (Tabla 1).
| VARIABLE |
VENTILACIÓN CICLADA POR VOLUMEN |
VENTILACIÓN CICLADA POR PRESION |
| |
Ofrece un volumen fijo con una presión variable (determinada por la resistencia, distensibilidad y el esfuerzo inspiratorio). (25,26,27) |
Tiene una presión fija (ventilación controlada por presión adicionada a CPAP o PEEP), un volumen y una tasa de flujo variable (determinado por la resistencia, distensibilidad, esfuerzo inspiratorio y niveles de presión).
Tiempo inspiratorio fijo y ciclado apagado por el tiempo inspiratorio (ventilación ciclada por tiempo controlada por presión) o la relación I: E (ventilación controlada por presión ciclada por relación I:E) (24,28,27). |
| Variables ajustar y metas a seguir. |
Se programa un volumen fijo, FIO2, PEEP, Sensibilidad, Frecuencia respiratoria.
Presiones para medir para tener control:
Presiones inspiratoria pico:
Presión meseta:
Presión de conducción:
Ejemplo:
Pip < pmes: aumento de resistencia
Pmes aumentada indica disminución de la distensibilidad. (28) |
Se programa una Presión pico, FIO2, PEEP, tiempo inspiratorio para determina cuanto tiempo va a limitar la presión. Por lo tanto, es controlada por presión cuando la presión está "controlada" para un tiempo determinado y es ciclada para este tiempo, porque el "tiempo" es lo que determina la duración de la inspiración
Metas para seguir: Garantizar un volumen tidal óptimo. (24,29) |
| Variable de control |
Flujo (30) |
Presión (30) |
| Presión alveolar máxima |
Mayor presión meseta (30) |
Menor presión meseta (30) |
| Volumen corriente |
Monótono (30) |
Variable (30) |
| Tiempos inspiratorios: |
No es posible ajustar porque está determinado por el flujo inspiratorio pico, la forma de onda de flujo y la pausa inspiratoria (22). Si se programa una pausa inspiratoria el tiempo inspiratorio aumenta (30) |
Se ajusta. |
| Deformabilidad |
Acentuado por injuria avanzada (30) |
Inefectiva o reducida por injuria avanzada (7) |
| Perfil de flujo |
Cuadrada (30) |
Desacelerado (7) |
| Ventajas |
Facilidad de uso: tipo de ventilación familiar para el personal de cuidado critico
Volúmenes establecidos: con este parámetro regula la eliminación de co2 y es el protocolo inicial de Ventilación protectora (25,26, 30,31). |
Presenta menos "inanición de flujo" experimentado por los pacientes en respiración asistida, extendiendo el tiempo inspiratorio puede incrementarse el volumen corriente.
Favorece los pacientes que requieren estrategias de ventilación protectora limitadas por presión y en los pacientes con mala adaptación a la ventilación mecánica.
Este método ventilatorio brinda comodidad, un patrón de flujo desacelerado, que varía con el requerimiento del paciente, disminuyendo el riesgo de asincronía.
Tiene una presión pico y una presión alveolar constantes, reduciendo el riesgo de barotrauma y lesión inducida por el ventilador. (31, 30,31) |
| Desventajas |
Presiones variables y tasa de flujo establecida, por tanto, es necesario monitorizar estrechamente la presión inspiratoria y observarlo en busca de signos de “inanición de flujo” (29) |
El volumen corriente no se fija en la presión controlada (36) |
| Respuesta a flujo demandado |
Inflexible (30) |
No restrictivo (30) |
| Manejo de presión |
Influenciado por impedancia (30) |
Constante (30) |
| Respuesta a injuria avanzando |
Incremento de presión pico (30) |
Reducción de volumen corriente (30), (32) |
Tabla 1. Diferencias entre Modo Ciclado por Volumen VS Presión.
Volumen Corriente Y Variales A Monitorizar [PIP, PM, PC]: Desde hace 20 años, se imparte gracias al estudio ARMA, que
La ventilación protectora con un Vt de 6ml/kg de PBW, ha
demostrado reducir mortalidad. Debido al edema heterogéneo
en el pulmón que sufre el paciente con SDRA, la superficie
aireada del mismo es menor y el requerimiento de volumen
es inferior, evitando la sobre distensión y la lesión secundaria
[24-32] Esta aproximación ha sido adoptada por la literatura
vigente y se recomienda en todas las guías de manejo la
ventilación mecánica con parámetros de ventilación protectora.
La evidencia actual demuestra que la ventilación protectora en
efecto, disminuye mortalidad, sin embargo, no impacta en los
días de hospitalización en la unidad de cuidados intensivos , ni
mejora la calidad de vida [33,34]. Estos hallazgos sugieren que
la ventilación protectora evita la lesión inducida por ventilador, más no interviene en la reparación del tejido; por lo que
abordajes recientes han incluido la monitorización del estrés y
el Strain tisular, fijándose que deben modificarse los parámetros
ventilatorios para cumplir las metas descritas en el aparte de
evitar el VILI, durante la ventilación mecánica tanto del paciente que cursa con SDRA como de aquel que se encuentra en riesgo
[11,34,35,37] Petrucci et al, publicaron un metaanálisis en año
2013, donde demostraron que una estrategia de ventilación
protectora en pacientes con SDRA, evidenció una reducción
notable de la mortalidad en un 26% a los 28 días para un valor
estadístico RR 0.74 (95% (IC) 0.61 - 0.88); así como también
reducción de la mortalidad intrahospitalaria en un 20% con un
valor estadístico RR 0.80 (95% IC 0.69 - 0.92) indiferentemente
de la presión plateau [38]. Pese a la descrita utilidad del driving
pressure y el poder mecánico, su uso no se ha determinado
como estándar en el manejo del paciente con SDRA, a la fecha
se están llevando a cabo estudios que pretenden esclarecer no
solo su utilidad, que ya ha sido discutida previamente, sino el
analizar realmente la meta para el uso de estas herramientas en
el manejo del SDRA.
Presión inspiratoria pico [PIP]: Es la presión máxima obtenida,
durante la entrega de un gas activo. Esta presión depende de
la distensibilidad pulmonar, el tórax y la resistencia de las vías
aéreas, incluyendo la contribución hecha por el tubo traqueal y
el circuito del ventilador (si la presión se mide desde un sitio en
el circuito que está cerca del ventilador). Controla la velocidad
a la cual es entregado el volumen corriente o en cuanto tiempo
fue entregada la presión inspiratoria programada en el ventilador
(Figura 3).
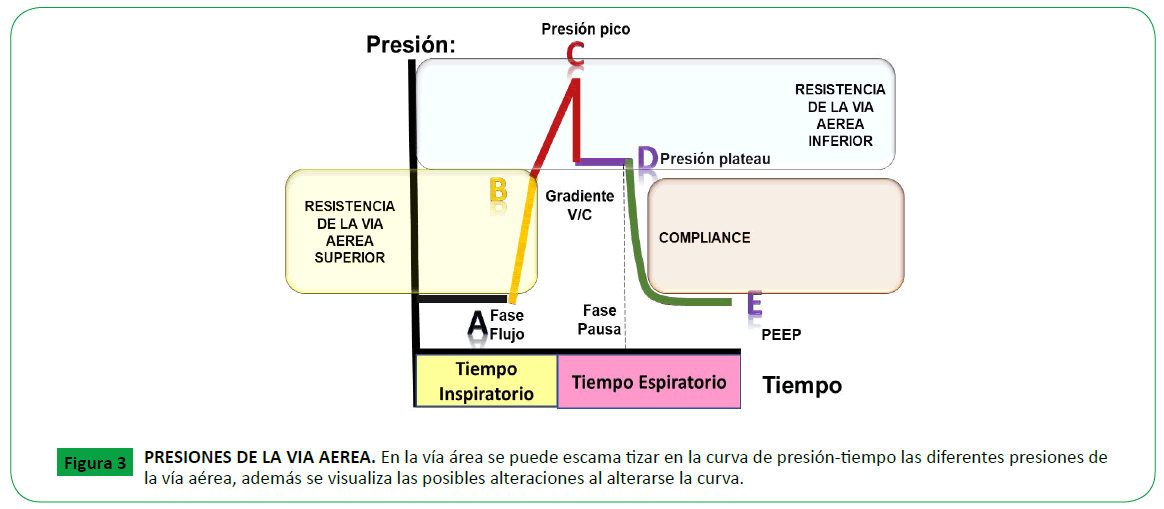
Figure 3. PRESIONES DE LA VIA AEREA. En la vía área se puede escama tizar en la curva de presión-tiempo las diferentes presiones de la vía aérea, además se visualiza las posibles alteraciones al alterarse la curva.
Presión Plateau o meseta: Se define como la presión inspiratoria
final, durante un período de ausencia de flujo de gas. Es una
pausa inspiratoria sin flujo aéreo, que guarda relación con la
distensibilidad, produce un descenso leve en la presión en la vía
aérea, equilibrando las presiones. Refleja el retroceso elástico
pulmonar y de la caja torácica frente al volumen de gas [39]. La
caída en la presión pico al nivel de la presión meseta, demuestra
que el flujo inspiratorio ha cesado, por lo tanto, la presión no
está obligada a vencer la resistencia al flujo. La presión también
cae como resultado de la redistribución de gas dentro de los
pulmones. Esta es una propiedad de los materiales elásticos, que
se traduce en la disminución de presión después de un periodo de tiempo, al mismo volumen. Esta depende del reclutamiento
de los alvéolos y el efecto del surfactante. Esta presión es la más
similar a la presión alveolar y, por lo tanto, tiene una importancia
considerable para limitar la presión de los alvéolos. Una presión
excesiva puede resultar en aire extrapulmonar (por ejemplo,
neumotórax) y la lesión pulmonar aguda [39].
Presión de conducción: Es la diferencia entre la presión meseta y
la PEEP y se relaciona directamente con la presión transpulmonar
por ende es una medida de control de las presiones aplicadas
sobre la vía aérea para prevenir el daño asociado a la ventilación,
Esta definición es independiente de la modalidad ventilatoria,
ya sea en ventilación controlada por volumen (VCV), o durante
ventilación controlada por presión (VCP). En ambas modalidades
basta hacer una maniobra de pausa inspiratoria-usualmente de
2 a 3 segundos- para obtener la presión meseta y restarla a la
PEEP. Los estudios de Ranieri, Amato y Villar manifiestan que una
presión de conducción mayor de 15-18 cmH2o están asociado
a mayor mortalidad y hay que hacer medidas para mejorar las
presiones con disminución del volumen minuto o aumentar
PEEP. Si no mejora con los parámetros descritos se recomienda
instalar un catéter esofágico [40].
Un aumento de la resistencia en las vías respiratorias resulta
en un aumento de la presión inspiratoria Pico. Este aumento
excesivo de la resistencia dará lugar a una amplia diferencia
entre presión inspiratoria Pico y la presión meseta. Una caída en
la distensibilidad elevará tanto presión inspiratoria Pico como
presión meseta
Frecuencia Respiratoria [Relación I: E, Triger,
Rise Time, Poder Mecanico]
Frecuencia respiratoria, y relación I: La frecuencia respiratoria
corresponde a una variable que será modificada por factores
propios del modo ventilatorio, dado que si este es espontaneo,
dependerá netamente del paciente, o si es asisto controlado
también la hará el mismo [48] Por Lo contrario, ocurrirá en
pacientes quienes se encuentran bajo sedación o en modos controlados donde la frecuencia la determinara el ventilador.
Para dichos cálculos el ventilador tiene en cuenta la relación
inspiración espiración, que traduce cuantas unidades de tiempo
en segundo dura la inspiración y cuantas durara la espiración
en proporción a la misma [49]. Esta relación entre el Tiempo
Inspiratorio y tiempo Espiratorio TE, suele determinarse de forma
empírica en 8 -12 respiraciones minuto, de tal forma que simule
las condiciones de la respiración fisiológica [48,49]. Sin embargo
la estandarización de los tiempo inspiratorio y espiratorio
representa un riesgo especialmente para los pacientes que se
encuentran con neumopatía obstructiva que restringe el flujo
espiratorio, y por ende requiere la evaluación objetiva de los
periodos inspiratorio y espiratorio durante la VMI. Ejemplo de
ello son los pacientes que presentan Enfermedad pulmonar
obstructiva crónica, quienes por compensación suplen los
fenómenos de atrapamiento aéreo con prolongación del tiempo
espiratorio. Para poder aproximar de forma más adecuada la
frecuencia respiratoria en este grupo de pacientes, debemos
evaluar la constante de tiempo, que se define como el tiempo
en que logra insuflarse una unidad alveolar. Partiendo de este
principio, se ha establecido que 1 unidad de tiempo es suficiente
para deflazar el 63% de los alveolos, 2 constantes 86% y 3
constantes de tiempo el 95% de las unidades alveolares [50,51].
Se calculo se hace multiplicando la compliance de la vía aérea
por la resistencia de la misma. La relación ideal se establece
entre 1:2 a 1:3 para permitir que todas las unidades alveolares
[lentas y rápidas] se desinflen de forma homogénea y así evitar
el fenómeno de atrapamiento aéreo. Pese a ello, la frecuencia
respiratoria en una variable que va a depender principalmente
de la integridad del drive central del paciente, y su automatismo,
dada la universalidad demostrada de la ventilación asisto
controlada sobre la ventilación controlada [48,49,52]
Sensibilidad O Triger: Se refiere al mecanismo mediante el
cual, el ventilador censa el esfuerzo inspiratorio y proporciona
un flujo de gas o una respiración mecánica. Esto provoca la
activación y apertura de la válvula inspiratoria, causando que
el total del trabajo respiratorio sea hecho por el ventilador. El
nivel de sensibilidad debe ser adecuado para el paciente, para
que no realice un esfuerzo adicional. La válvula de demanda se
activa por un cambio en la presión (sensibilidad por presión] o un
cambio en el flujo (sensibilidad por flujo) [41,42]
Sensibilidad por Presión: Se refiere a la cantidad de presión
negativa, que el paciente debe generar para recibir un flujo de
aire o gas. Si la sensibilidad se ajusta a 1 cm, entonces el paciente
debe generar 1 cm de H2O de presión negativa, en el sitio de
medición de presión, para que la máquina detecte el esfuerzo
y entregar un flujo de aire o gas. La sensibilidad debe ajustarse
lo más cerca posible a cero, sin permitir que la máquina cicle
espontáneamente. Si la sensibilidad es demasiado alta el trabajo
respiratorio del paciente va a incrementarse innecesariamente
[43].
Auto-trigger: Se genera cuando el respirador inicia una respiracion
no iniciada por a través de la observación del trazo de la gráfica
presión-tiempo o del manómetro de presión de los ventiladores,
se visualizará la frecuencia con que la presión cae por debajo de
la sensibilidad fijada. La razón de esta caída en la presión se debe al retardo en el tiempo entre cuando la presión en el circuito cae
y el ventilador proporciona un flujo de gas. Esto se conoce como
la capacidad de respuesta de demanda del ventilador. En algunos
ventiladores la caída de presión de las vías respiratorias al final
de la espiración es tan grande como 6-8 cm H2O con un retardo
de 0.3-0.7 segundo en el tiempo. Los factores antes mencionados
están determinados en parte, por las características de la válvula
de demanda y la resistencia añadida de los circuitos inspiratorio
y espiratorio. Esto conduce a un incremento del trabajo muscular
inspiratorio y el consumo de oxígeno [7].
Sensibilidad por Flujo: Es el flujo, en la cual se entrega un flujo
base o continuo antes del esfuerzo inspiratorio, esto produce un
flujo espiratorio de la misma magnitud. La demanda temprana del
paciente por flujo es satisfecha por el flujo base. La sensibilidad
de flujo es definida como la diferencia entre el flujo base y el flujo
exhalado. Por lo tanto, es la magnitud de flujo que se desvía del
circuito de exhalación al pulmón del paciente. A medida que el
paciente inhala, la sensibilidad de flujo alcanzado la presión de
flujo se abre y activa la válvula entregando gas fresco [7].
El tiempo necesario para el inicio del esfuerzo inspiratorio hasta
el inicio del flujo espiratorio es considerablemente menor con
la sensibilidad por flujo, en comparación de la sensibilidad por
presión. La sensibilidad por flujo de 2 litros por minuto, por
ejemplo, el tiempo que tarda es de 75 milisegundos, mientras
que el tiempo que tarda la sensibilidad por presión de 1 cm de
H2O es 115 milisegundos, dependiendo del tipo de ventilador
utilizado. El uso de sensibilidad por flujo disminuye el trabajo
implicado en el inicio de una respiración [7].
Tiempo: El tiempo, en ventilación mecánica se divide en tiempo
inspiratorio (Ti) y tiempo espiratorio (Te). El tiempo inspiratorio
es una combinación del período de flujo inspiratorio y el
tiempo necesario para hacer una pausa inspiratoria. El tiempo
inspiratorio con la adición de una pausa inspiratoria se denomina
tiempo inspiratorio total (Figura 4). El tiempo espiratorio, es el
tiempo que dura la espiración. La frecuencia respiratoria, son el
número de ciclos respiratorios por unidad de tiempo que puede
realizar un paciente o el ventilador [44].
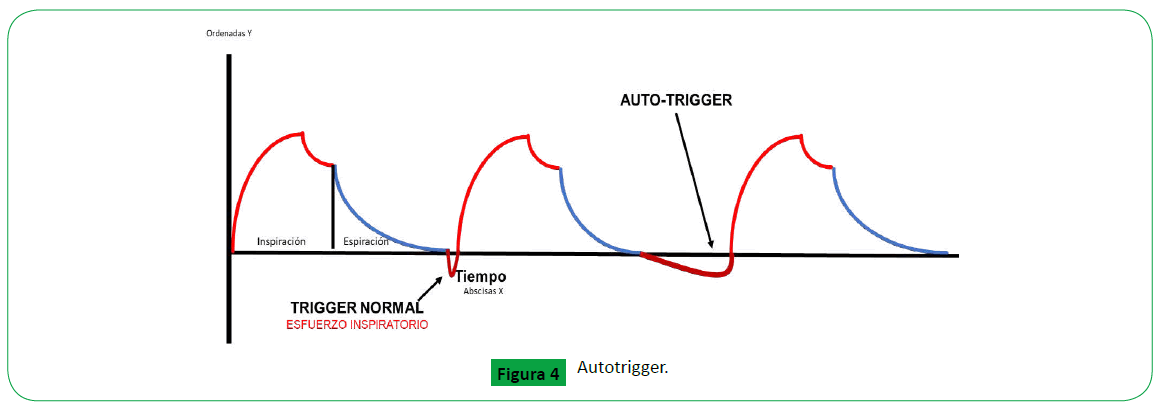
Figure 4. Autotrigger.
El tiempo inspiratorio normal en el adulto sano con respiración
espontánea es de aproximadamente 0,8-1,2 segundos. La
relación Inspiración: Espiración, como su nombre lo con una
relación Inspiración: Espiración (I: E) de 1:1,5 a 1:2.2, es la
analogía entre la fracción de tiempo requerida en cada ciclo para
llevar a cabo la espiración y la espiración. Una relación I: E de
1:2, significa que el ventilador proporciona una inspiración en un
segundo y una espiración en dos segundos. A veces puede ser
beneficioso aumentar el tiempo inspiratorio, con el fin de mejorar
la oxigenación a través de la adición de una pausa inspiratoria
y aumentar el volumen corriente en la ventilación con presión
controlada. Los efectos adversos de los tiempos inspiratorios
excesivamente largos son el compromiso hemodinámico,
disincronía ventilador-paciente y el desarrollo de Auto-PEEP [44].
Presion Positiva Al Final De La Espiracion Y [AUTOPEEP]: Para
comprender el concepto de PEEP, se hace necesario rescatar
algunos conceptos fisiológicos y así intentar elucidar la forma
más adecuada de establecerla, para el paciente [53]. Primero debemos reconocer los componentes resistivos del sistema
respiratorio, que va a ser definido por las fuerzas elásticas y
las no elásticas. Estas van a resistirse al flujo de aire, pero son
vencidas por la presión negativa en la cavidad pleural en la
respiración espontanea [54]. Estas mismas fuerzas van a facilitar
la espiración por la propiedad que tienen a recuperar su forma
una vez son deformadas, elastancia, proceso que ocurre gracias
a la energía potencial resultante de la inspiración. Si la expulsión
de aire fuese completa y no quedara un remanente al final de
la inspiración, el colapso alveolar seria total, debido que este
carece de componente cartilaginoso que se oponga a la presión del entorno durante la espiración [48,55,56]. Es allí donde la
capacidad de cierre, el volumen de aire que permanece en las
vías respiratorias al final de la espiración, se vuelve primordial
para evitar el colapso por deflación, y el posterior trauma a la
insuflación, lo que generaría permanente lesión pulmonar
durante le respiración espontanea [36,49] (Figura 5).
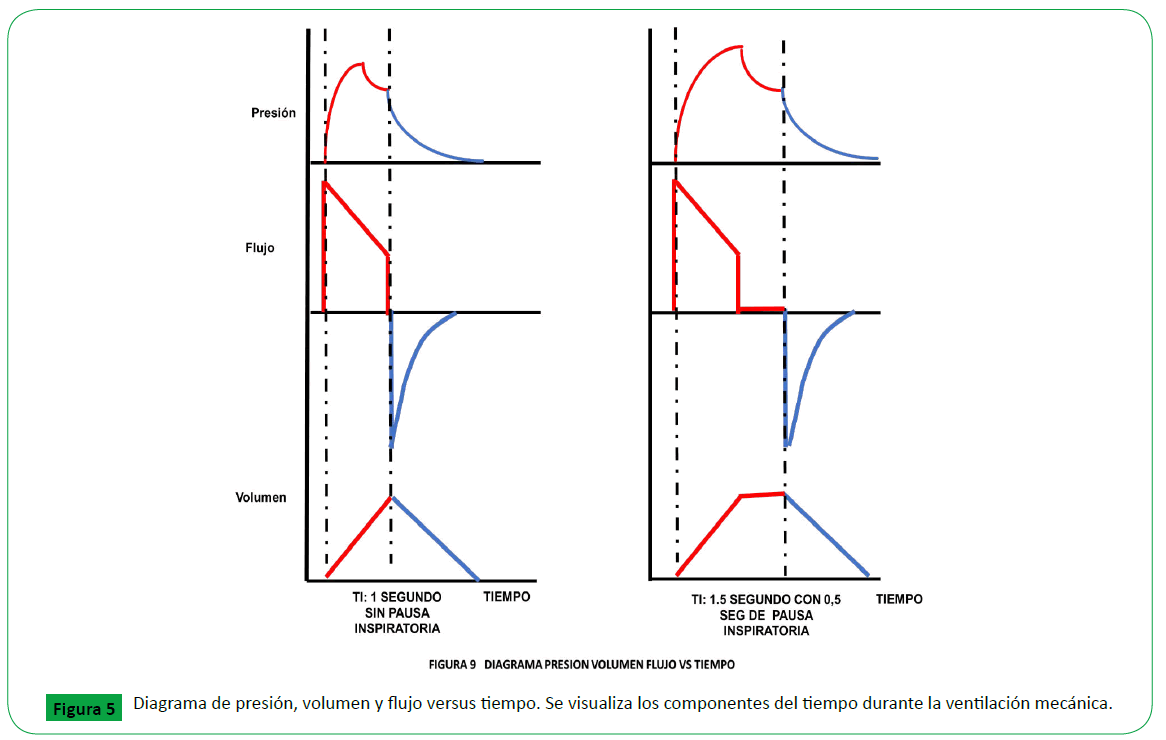
Figure 5. Diagrama de presión, volumen y flujo versus tiempo. Se visualiza los componentes del tiempo durante la ventilación mecánica.
La Administración De Presión Positiva De Forma
Artificial, Al Fin De Cada Ciclo Respiratorio
Durante la VMI fue descrita en 1.938 por Barach, en un
profundo análisis de la presión positiva y sus efectos durante la ventilación mecánica [57-59], posteriormente discutido por
Hill y colaboradores en 1965 [31,49], al analizar las variables
que modificaban la capacidad residual funcional en el paciente
en ventilación mecánica durante la cirugía cardiovascular. Se ha
propuesto que proceso emula lo que el cierre glótico genera
durante la ventilación espontánea [aunque existen no pocos
detractores al concepto de la PEEP fisiológica, manteniendo
un remanente de volumen y presión en las vías respiratorias.
[49] Al ser administrada por el ventilador, la conocemos
como PEEP extrínseca (ePEEP), aunque debemos también
reconocer que el pulmón está en capacidad de generarla en
lo que conocemos como PEEP intrínseca (iPEEP) que posee
importantes consideraciones fisiopatológicas que describiremos
más adelante. Sus efectos durante la ventilación mecánica
incluyen el aumento de la CFR, aumento de la presión arterial
de oxígeno, disminución del shunt intrapulmonar, conservación
del volumen residual, reclutamiento alveolar y disminución del
riesgo de toxicidad por oxígeno [31,49]. En los últimos años
se ha estudiado su rol en el paciente con SDRA [36,59,60]
así como en EPOC, edema pulmonar cardiogénico, SAHOS y
síndromes de hipoventilación alveolar [61]. Más recientemente
se ha considerado en los modelos predictores de lesión
pulmonar inducida por el ventilador, como una de las variables
determinantes en el compromiso de las propiedades reológicas
del tejido pulmonar durante la Ventilación mecánica [59] Las
consecuencias de la administración de presión positiva han sido
expuestas con anterioridad y se resumen en la (Tabla 2) (XX), y
pueden resumirse como comprobadamente benéficas para el
paciente en ventilación mecánica, aunque potencialmente lesivas
para el paciente con labilidad hemodinámica [31]. Corresponde
entonces determinar si existe una PEEP ideal, concepto que ha
sido ampliamente discutido en la literatura científica y sobre el
cual no existe aún una posición oficial [62], así como describir las
estrategias actualmente descritas para el manejo de la PEEP y los
escenarios para su potencial uso.
| MECANISMO |
EFECTO |
| Disminucion de Postcarga del VI |
Mentor trabajo para VI |
| Disminuye el diámetro de VI |
Mejora el Gasto Cardiaco |
| Aumento de la presion transmural |
Mejora el Gasto Cardiaco |
| Aumento de la Presion Alveolar al fin de la espiraction |
Mejora la compliance alveolar y previene el colapso |
| Aumenta la resistencia Vascular Pulmonar |
Favorece la salida del edema alveolar por presión hidrostatica al mismo tiempo que aumenta la postcarga al VD |
| Disminuye la precarga del VD |
Mayor riesgo de bajo gastro si aumento desmesurado den post carga de VD |
Tabla 2. Efectos de la Presión positiva y PEEP en la hemodinamia. VI: ventrículo izquierdo, VD: ventrículo
Pese que no existe una receta para la PEEP ideal, una práctica
común durante la ventilación mecánica inicial es el uso de Presión
positiva profiláctica a una presión de 5cmH2O. Algunos autores
han establecido que las metas de la PEEP se resumen en mantener
una PO2 >60 mmHg, Reclutamiento alveolar, Restablecimiento
de la capacidad residual funcional y mejorar la oxigenación tisular
[48]. Estas metas son comunes a todo paciente en ventilación
mecánica, por ende, partiríamos del principio que todo paciente
bajo VMI requerirá algún nivel de PEEP. Los términos ideal y
optimo se asocian por los autores con la PEEP desde la década de
los 60´s[63] y se postula que existe un nivel fisiológico que oscila
entre los 3 a 5 cmH2O[48] (lo que valida la práctica de programar a todos los pacientes que reciben ventilación mecánica con PEEP
de 5 cmH2O, por lo menos desde el concepto de plausibilidad
fisiológica], sin embargo no hay estudios que hayan logrado
demostrar que su uso profiláctico genere un impacto sobre
mortalidad o estancia en UCI en el paciente ventilado [64,65]. En
segundo lugar encontramos el grupo de pacientes que requieren
niveles de PEEP terapéuticos, que usualmente son > a 5 cmH2O;
que pretenden utilizar los efectos benéficos de esta última sobre
el aporte de O2, la capacidad residual funcional y el shunt. En
casos muy selectos como el SDRA se requerirán niveles de PEEP
muy altos que alcanzan valores por encima de los 15 cmH2O
[48]. Para este grupo analizaremos los métodos para la búsqueda
de la PEEP óptima basados en el requerimiento de mejorar la
oxigenación, en el reclutamiento alveolar o en la necesidad de
proteger el pulmón.
En el primer escenario se ha establecido una relación entre altos
niveles de PEEP y mejoría de PaO2 así como de la presión media
de la vía aérea [66], ambas variables se encuentran relacionadas
con la oxigenación del paciente y por ende se acepta que la PEEP
puede mejorar la oxigenación en el paciente, así como que altos
niveles de PEEP son potencialmente benéficos en el paciente con
SDRA, por ejemplo [67]. Una de las estrategias más estudiadas
para el cálculo de la PEEP, es la (Tabla 3) de relación PEEP/FiO2
publicada por el grupo ARDS NETWORK. [68,69] Una revisión
sistemática y metaanálisis del grupo Cochrane, no demostró
que dicha estrategia impactara en mortalidad, pero tampoco
aumentaba el riesgo de baro-trauma; sin embargo, altos niveles
de PEEP, mejoraban la oxigenación en los primeros 7 días [70]. Al
no contar con una fórmula que permita calcular un PEEP ideal,
el enfoque se inclina a hacia un PEEP óptimo para mantener una
fio2 adecuada en nuestros pacientes [60,67].
| COMBINACIÓN PEEP/FIO2 ALTA |
| FiO2 |
0,3 |
0,3 |
0,4 |
0,4 |
0,5 |
0,5 |
0,5 |
0,6 |
0,7 |
0,8 |
0,8 |
0,9 |
1,0 |
| PEEP |
12 |
14 |
14 |
16 |
16 |
18 |
20 |
20 |
20 |
22 |
22 |
22 |
22-24 |
| COMBINACIÓN PEEP/FIO2 BAJA |
| FiO2 |
0,3 |
0,3 |
0,4 |
0,4 |
0,5 |
0,5 |
0,5 |
0,6 |
0,7 |
0,8 |
0,8 |
0,9 |
1,0 |
| PEEP |
5 |
5 |
8 |
8 |
10 |
10 |
10 |
12 |
14 |
14 |
14 |
16 |
18 |
Tabla 3. PEEP/FiO2 ADRDS Network.
Como segunda estrategia tenemos el reclutamiento alveolar o el
enfoque del “Open Lung”, que consiste en la apertura de la mayor
cantidad de unidades colapsadas posibles, con el fin de mejorar
la oxigenación, y mantener estas últimas abiertas, para evitar el
Atelectrauma y Biotrauma [48,49]. Mercat et al, en un ensayo
clínico aleatorizado compararon altos niveles de PEEP [20-30
cmH2O] frente a bajos niveles (5-9cmH2O), demostrando que
altos niveles de PEEP se asociaban a mayor días de ventilación
mecánica y mayor disfunción de órgano, sin impactar en
mortalidad [68]. posteriores trabajos han evaluado esta respuesta
en relación a la mejoría de la distensibilidad, y como en pequeños
grupos de pacientes los niveles altos de PEEP lograban mejorar
la oxigenación en los pacientes con un nivel de distensibilidad
estática mayor. Posteriores trabajos han comparado esta mejoría
por métodos de imágenes diagnostica con ecografía, tomografía
de tórax convencional y por impedancia eléctrica. Permitiendo el desarrollo de modelos predictivos de PEEP, que aún se
encuentran en validación y presentan importantes limitaciones
[64,67,69,72].
En tercer lugar, se encuentra la aproximación a la ventilación
protectora, que consiste en utilizar las medidas de PEEP
necesarias para obtener el mayor beneficio en oxigenación,
manteniendo unos límites seguros para el paciente. La diferencia
entre la presión plateau y la PEEP o Driving Pressure (DP)
representa el volumen pulmonar corregido por la distensibilidad
del paciente. Con un punto de corte 15 cmH2O predice el daño
a pulmón inducido por VMI con alta eficacia. Aunque faltan
estudios que avalen su uso de forma generalizada [13,70,71]
Sin embargo se ha propuesto que obviar los valores elevados de
PEEP, concentrándose en mantener una meta de DP < 15cmH2o,
disminuyen la aparición de Barotrauma [69,70]. Otros modelos
como el Poder Mecánico propuesto por Gattinoni [24,72,73] y
posterior poder de distensibilidad de Marini et al, extrapolaron
una forma simplificada del poder mecánico [73] Pese al
promisorio rol de estas 2 entidades para la prevención del VILI
faltan estudios suficientemente grandes para estandarizar su
uso, y no existe posición oficial en las guías de manejo de SDRA
publicadas hasta el momento [74,]. Finalmente Amato et al
determinaron la forma de calcular la PEEP como una medida
cercana al punto de inflexión inferior, y calculaban este a través
del grafico de las presiones de la vía aérea en una curva presión/
volumen. Este método se asociado con una notoria disminución
de la mortalidad en frente al grupo de paciente con PEEP
tituladas por métodos estandarizados, sin embargo, posee como
limitante el requerimiento de relajación/sedación en el paciente,
lo que limita su uso a escenarios moderado a severos del SDRA
[61-66,68].
Ante la evidencia expuesta varios autores han concluido que la
necesidad de hallar una “PEEP ideal”, podría ser renombrada
a “Mejor PEEP”, ya que ha demostrado ser superior a otras
estrategias [60,63,67] siempre y cuando preservemos la
estabilidad hemodinámica del paciente y objetivemos una
respuesta a la terapia con PEEP elevada, esta podrá ser utilizada.
Las Metas a considerar como respuesta a PEEP se resumen
en la (Tabla 3.1) XXXX, y podrían funcionar como guía en los procesos de manejo del paciente en ventilación mecánica.
Modelos promisorios e integrativos como el recientemente
propuesto por Rezoagli y Bellani [69], representan estrategias
muy interesantes para un establecimiento fisiológico de la
PEEP, aún deben ser validados para su aplicación y uso de
forma generalizada.
| PARÁMETROS PARA EVALUAR RESPUESTA A LA TERAPIA CON PEEP |
| PaO2 60mmHg-100mmHg con FiO2<40% |
| DO2 Optimo (≈1000mL/min) y Shunt menor al 15% |
| Minimo compromiso cardiovascular, disminución en la PA y GC<20% |
| Compliance estatica adecuda |
| PaFIO2 >300 |
| ΔCO2 <6mmHg |
Tabla 3.1. Parámetros para evaluar respuesta a PEEP, adaptado.
Auto-PEEP
La medición de la presión del circuito no es siempre es un indicativo
de la presión alveolar. Durante la espiración, la presión alveolar
es mayor que presión del circuito, hasta que el flujo espiratorio
cesa. Si el flujo espiratorio, no cesa antes de la iniciación de la
respiración siguiente, se puede producir un atrapamiento de gas.
Este atrapamiento de gas aumenta la presión en los alvéolos al
final de la espiración y se denomina Auto-PEEP [6].
El objetivo del PEEP en los pacientes ventilados es aumentar la
presión en los alvéolos al final de la espiración, pero el Auto-PEEP
es potencialmente perjudicial, ya que no se puede ser consciente
de su presencia. Los efectos de Auto-PEEP son los mismos que
PEEP o CPAP y puede predisponer al paciente a un aumento del
riesgo de injuria pulmonar por presión, caída del gasto cardíaco,
hipotensión, retención de líquidos y aumento del trabajo
respiratorio [45].
De qué manera la presencia Auto-PEEP
incrementa el trabajo respiratorio
En un paciente sano, la presión en los alvéolos al final de la
espiración es el equivalente a la presión atmosférica. La presión
entre la pleura parietal y la pleura visceral en ese momento
es negativa. Para conseguir un flujo de gas en los alvéolos, el
diafragma y los músculos intercostales externos se contraen,
creando una presión intrapleural más negativa. Esto hace que los
alvéolos se expandan y da como resultado una presión alveolar
sub atmosférica, que produce un flujo de gas. Cuando hay
Auto-PEEP, la presión en los alvéolos a final de la espiración es
mayor que la atmosférica, el tamaño del tórax se expande y los
músculos respiratorios han vuelto a un largo estado de reposo.
Para generar un flujo de gas, los músculos respiratorios deben
acortarse lo suficiente para expandir el tórax e incrementar sus dimensiones y crear una presión alveolar sub atmosférica. Si esta
presión no se genera, no se producirá ningún flujo de gas. Cuando
un paciente es intubado y conectado a un respirador, el tiempo
de respuesta a la demanda del ventilador puede exacerbar el
problema [46] (Tabla 4).
| PASOS |
PARAMETRO |
| Necesita Ventilación |
Falla ventilatoria
Disfunción cardiovascular
Alteración neurológica
Alteración neuromuscular |
| CABECERA A 30ª |
Evita aspiración |
| Calcular El Peso Predicho |
Masculino: 50 +0.91 (cm de altura -152.4)
Mujer 45.5 + 0.91 (cm de altura – 152.4) |
| FIO2 |
Pao2: 110-125 mmHg
Sao2 90-92%
Fio2 <40 no > 80 mmHg
Hiperoxia ajustar fio2
Hipoxemia evaluar de acuerdo con tabla de PEEP |
| Modo Ventilatorio |
Ciclado Por Volumen |
| Volumen Corriente Y Variables A Monitoriazar |
Riesgo sdra o pulmón enfermo: 6 ml/kg
Sin riesgo sdra: 8 ml/kg
Objetivo: Disminuir el volutrauma
Con metas:
presión pico <45 cmh2o -Presión meseta: < 30 cmh2o
Presión de conducción < 15 cmh2o
Si esta aumentado se considera
Disminuir volumen tidal Hasta 4 cc/kg
Descartar aumento de otras presiones Presión abdominal
Derrames pleurales
Neumotórax
Enfermedades pulmonares ò
¿está midiendo la presión meseta correctamente?
La meseta real puede parecer falsamente elevada si el paciente realiza un esfuerzo inspiratorio al final de su control de inspiración final. |
| Ajustar Frecuencia Respiratoria |
< 12 – 20 rxm
AJRCCM.2000. Marini JJ.; ICM. 2016.LUNGSAFE
> 20: evalúa I/E; PEPI; DP; PM
NEJM 2015.Amato; Gattinoni.2016-2019 |
| Calcular El Poder Mecánico |
0,098 x (fr x vm) x (pip -1/2 dp(plat-PEEP)
Si el valor en mayor a 20 jul., disminuir Frecuencia respiratoria y volumen corriente |
| Instaurar PEEP |
PEEP > 5 CMH2O
IMC > 30 PEEP 6-8 CMH20
IMC > 40 PEEP 10 CMH20
VER TABLA DE PEEP FIO2 |
Tabla 4. Esquema De Pasos Para Programar El Ventilador Mecanico
El circulo más grande Muestra el volumen pulmonar en reposo
con auto-PEEP también presente., en la (Figura 6) se evidencia
a medida que aumenta el auto-PEEP aumenta el volumen
atrapado, en a la Figura 7. se aprecia como el punto de autopeep
desplaza hacia la vía aérea superior y genera mas atrapamiento
aéreo, a medida que nosotros disminuimos PEEP podemos
disminuir el punto de quiebre de la auto-PEEP y lograr disminuir
la hiperinsuflación dinámica.
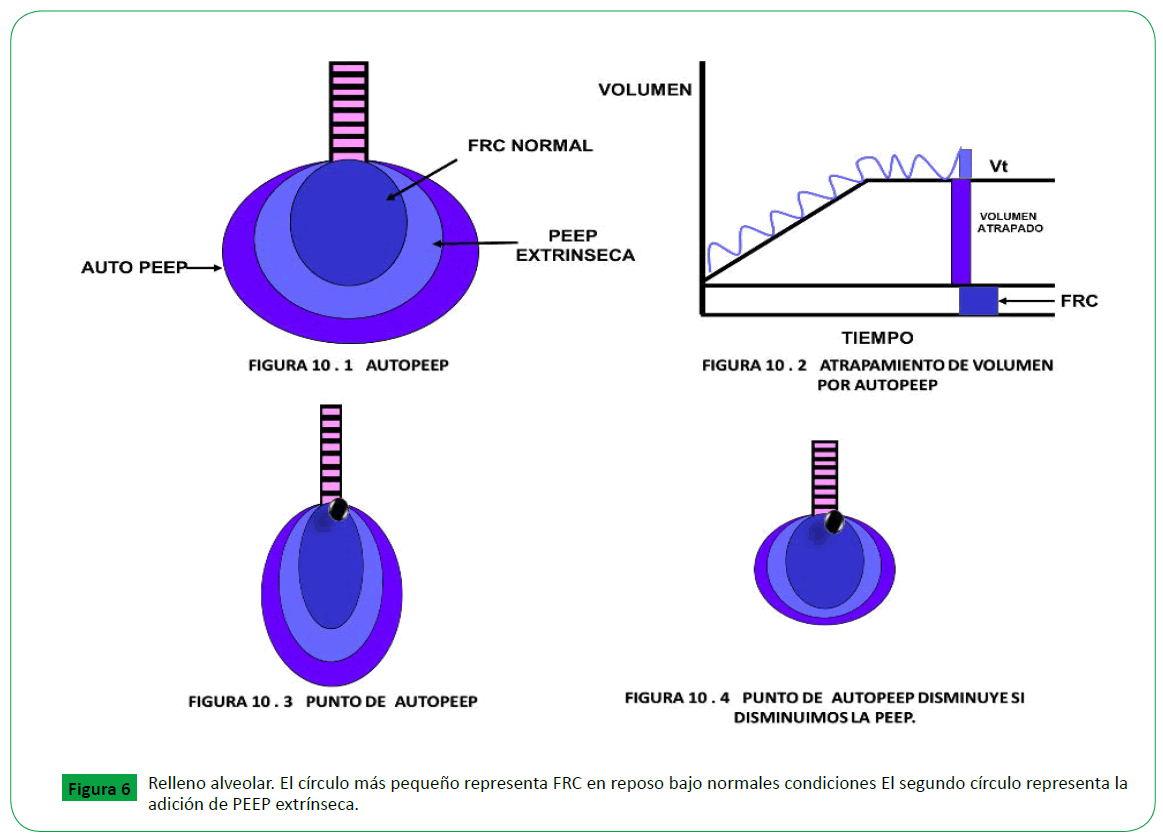
Figure 6. Relleno alveolar. El círculo más pequeño representa FRC en reposo bajo normales condiciones El segundo círculo representa la adición de PEEP extrínseca.
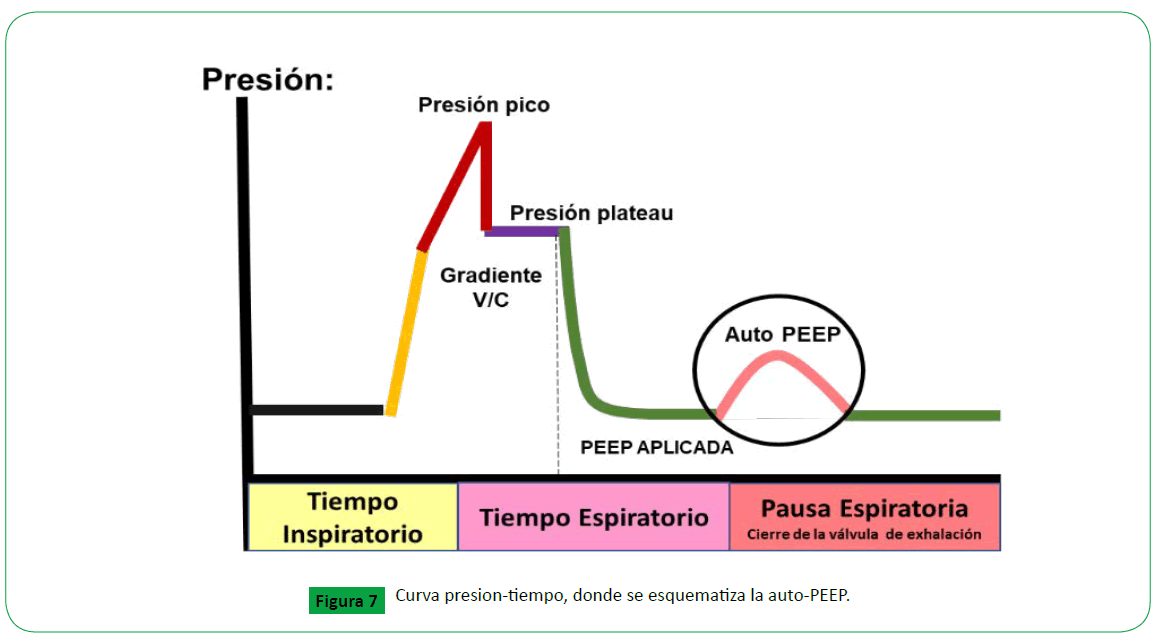
Figure 7. Curva presion-tiempo, donde se esquematiza la auto-PEEP.
La medición de Auto-PEEP
El Auto-PEEP, a diferencia de PEEP (PEEP externo), no se registra
en manómetro de presión del ventilador. Esto es porque el ventilador registra la presión del circuito y no la presión
alveolar. Sin embargo, si la válvula de exhalación en el respirador
está ocluida inmediatamente antes del inicio de la siguiente
respiración, la presión en los alvéolos y el circuito del ventilador
se equilibran. Al realizar esta maniobra el nivel de auto-PEEP se
mostrará en el ventilador [47] (Figura 8).
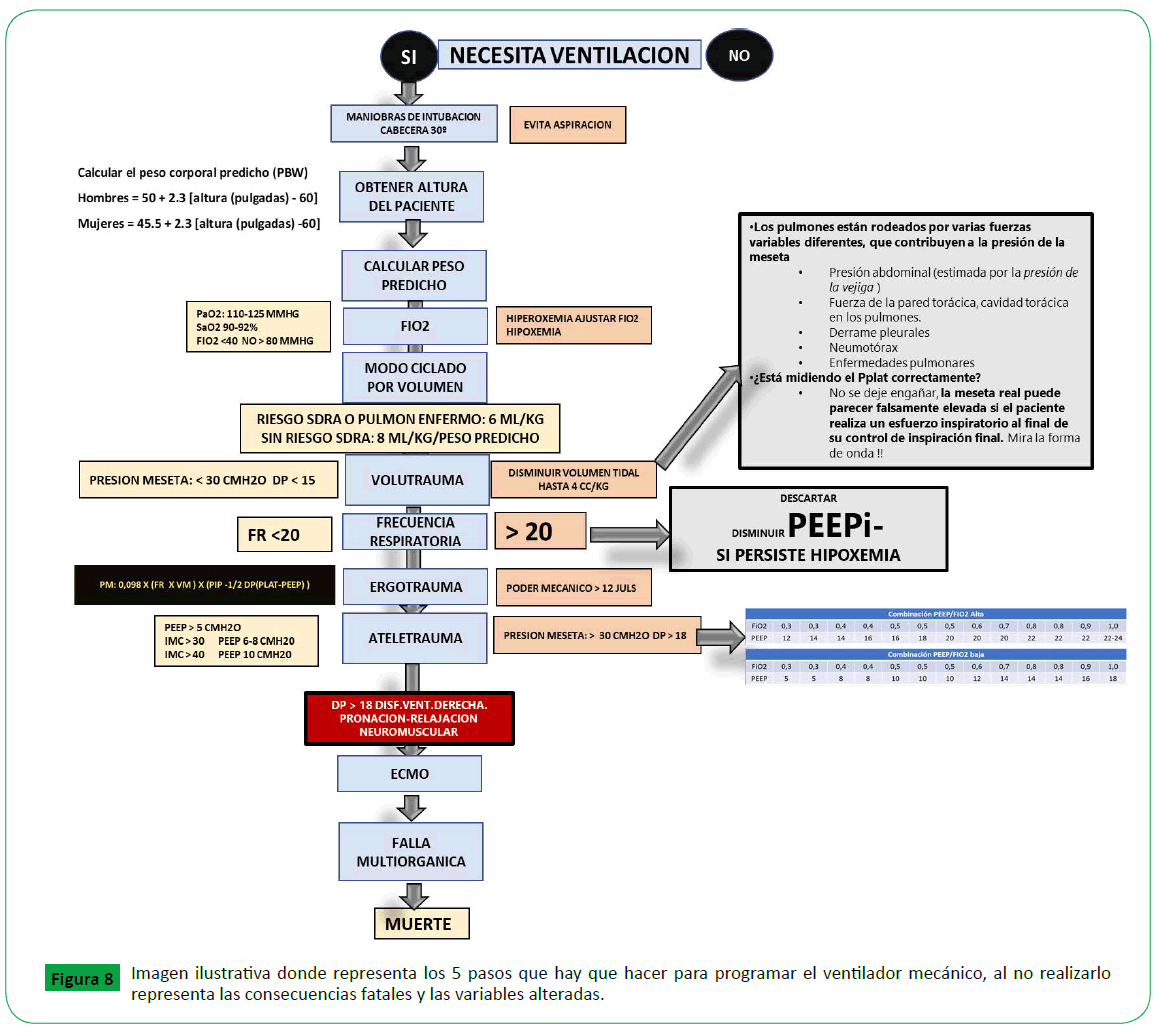
Figure 8. Imagen ilustrativa donde representa los 5 pasos que hay que hacer para programar el ventilador mecánico, al no realizarlo representa las consecuencias fatales y las variables alteradas.
Es importante señalar que este método de medir Auto-PEEP, sólo
se puede utilizar cuando el paciente está recibiendo respiraciones
controladas. Cuando el paciente está tomando respiraciones
espontáneas o asistidas, la presión en el circuito se reducirá,
para iniciar el flujo de gas, y una medición de Auto-PEEP será
inalcanzable. Para determinar si un paciente tiene Auto-PEEP
durante las respiraciones espontáneas o asistidas, es necesario
ver las formas de la onda de flujo en el ventilador o insertar un
balón esofágico. Si hay Auto-PEEP la onda de flujo no egresa a la
línea de base antes de la siguiente respiración.
Conclusiones
La ventilación mecánica es un proceso complejo, donde
intervienen variables técnicas y fisiológicas complejas a tener en
cuenta.
No existe una estrategia para determinar la PEEP ideal, acorde a la
evidencia actual, debemos utilizar la tabla de relación PEEP/FiO2
diseñadas por el Grupo ARDS NETWORK y vigilar activamente la
respuesta del paciente por medio de variables fisiológicas.
La frecuencia respiratoria debe centrarse en las necesidades
del paciente; si este requiere emular condiciones fisiológicas, se
beneficiará de respiraciones espontáneas, siempre y cuando se
tenga en cuenta el riesgo de realizar atrapamiento aéreo.
Conflicto de Intereses
Los Autores declaran no tener conflicto de interés.
Consentimiento informado
Cada uno de los autores aquí presentes aporto de manera
equitativa y por igual a la realización del presente trabajo.
References
- Tobin MJ. Principles and practice of mechanical ventilation. 2006.
- Laffey JG, Bellani G, Pham T. Cuidados. Intensivos Med. 2016; 42: 1865.
- Esteban A, Anzueto A, Frutos F, Alía I, Brochard L, Stewart TE, et al. Characteristics and outcomes in adult patients receiving mechanical ventilation: A 28-day international study. JAMA. 2002; 287(3): 345-355.
Indexed at, Google Scholar, Cross Ref
- Villar J, Blanco J, Añón JM, Santos-Bouza A, Blanch L, Ambrós A, et al. The alien study: Incidence and outcome of acute respiratory distress syndrome in the era of lung protective ventilation. Intensive Care Med. 2011; 37: 1932-1941.
Indexed at, Google Scholar, Cross Ref
- Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016; 315(8): 788-800.
Indexed at, Google Scholar, Cross Ref
- Bein T, Grasso S, Moerer O, Quintel M, Guerin C, Deja M, et al. The standard of care of patients with ARDS: ventilatory settings and rescue therapies for refractory hypoxemia. Intensive Care Med. 2016; 42: 699-711.
Indexed at, Google Scholar, Cross Ref
- Cairo JM. Pilbeam's mechanical ventilation. Physiol Clin. 2016.
Google Scholar
- Marini JJ. Dynamic hyperinflation and auto–positive end-expiratory pressure: Lessons learned over 30 years. Am J Respir Crit Care Med. 2011; 184(7): 756-762.
Indexed at, Google Scholar, Cross Ref
- Tratado De Ventilacion Mecanica Editorial Distribuna Seccion I Pag. 2017; 3-55.
- Fisiología respiratoria aplicada de nunn septima edicion editorial distribuna cap.3-50.
- Duncan BW, Desai S. Pulmonary arteriovenous malformations after cavopulmonary anastomosis. The Annals of thoracic surgery. 2003; 76(5):1759-1766.
Indexed at, Google Scholar, Cross Ref
- Turrens JF. Mitochondrial formation of reactive oxygen species. Physiol J. 2003; 552(2): 335-344.
Indexed at, Google Scholar, Cross Ref
- Magder S. Reactive oxygen species: Toxic molecules or spark of life? Crit Care. 2006; 10(1): 1-8.
Indexed at, Google Scholar, Cross Ref
- Suzuki S, Eastwood GM, Glassford NJ, Peck L, Young H, Garcia-Alvarez M, et al. Conservative oxygen therapy in mechanically ventilated patients: A pilot before-and-after trial. Crit Care Med. 2014; 42(6): 1414-1422.
Indexed at, Google Scholar, Cross Ref
- Calzia E, Asfar P, Hauser B, Matejovic M, Ballestra C, Radermacher P, et al. Hyperoxia may be beneficial. Crit Care Med. 2010; 38(10): S559-S568.
Indexed at, Google Scholar, Cross Ref
- Hofmann R, James SK, Jernberg T, Lindahl B, Erlinge D, Witt N, et al. Oxygen therapy in suspected acute myocardial infarction. N Engl J Med. 2017; 377(13): 1240-1249.
Indexed at, Google Scholar, Cross Ref
- Ni YN, Wang YM, Liang BM, Liang ZA. The effect of hyperoxia on mortality in critically ill patients: A systematic review and meta analysis. BMC Pulm Med. 2019; 19: 1-1.
Indexed at, Google Scholar, Cross Ref
- Wheeler AP, Bernard GR. Acute lung injury and the acute respiratory distress syndrome: a clinical review. The Lancet. 2007; 369(9572): 1553-1564.
Indexed at, Google Scholar, Cross Ref
- Slutsky AS, Marco Ranieri V. Mechanical ventilation: Lessons from the ARDSNet trial. Respir Res. 2000; 1 (2): 73-77.
Indexed at, Google Scholar, Cross Ref
- Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000; 342(18):1301-1308.
Indexed at, Google Scholar, Cross Ref
- Chacko B, Peter JV, Tharyan P, John G, Jeyaseelan L. Pressure‐controlled versus volume‐controlled ventilation for acute respiratory failure due to acute lung injury (ALI) or acute respiratory distress syndrome (ARDS). Cochrane Database Syst Rev. 2015(1).
Indexed at, Google Scholar, Cross Ref
- Rittayamai N, Katsios CM, Beloncle F, Friedrich JO, Mancebo J, Brochard L. Pressure-controlled vs volume-controlled ventilation in acute respiratory failure: A physiology-based narrative and systematic review. Chest. 2015; 148(2): 340-355.
Indexed at, Google Scholar, Cross Ref
- Chatburn RL. Fundamentals of mechanical ventilation: A short course in the theory and application of mechanical ventilators. Mandu Press; 2003.
Google Scholar
- Garnero AJ, Abbona H, Gordo-Vidal F, Hermosa-Gelbard C. Pressure versus volume controlled modes in invasive mechanical ventilation. Med Intensiva. 2013; 37(4): 292-298.
Indexed at, Google Scholar, Cross Ref
- Marini JJ. Point: Is pressure assist-control preferred over volume assist-control mode for lung protective ventilation in patients with ARDS? Yes. Chest. 2011; 140(2): 286-290.
Indexed at, Google Scholar, Cross Ref
- Prella M, Domenighetti G. Effects of short-term pressure-controlled ventilation on gas exchange, airway pressures, and gas distribution in patients with acute lung injury/ARDS: comparison with volume-controlled ventilation. Chest. 2002; 122(4): 1382-1388.
Indexed at, Google Scholar, Cross Ref
- Lapinsky SE, Leung RS. Auto-PEEP and electromechanical dissociation. N Engl J Med. 1996; 335(9): 674-675.
Indexed at, Google Scholar, Cross Ref
- Jaber S. New dual ventilator modes: are we ready to perform large clinical trials? Respir Care. 2009; 54(11): 1451-1452.
Indexed at, Google Scholar
- Marini JJ. Evolving concepts for safer ventilation. Crit Care. 2019; 23(1): 1-7.
Indexed at, Google Scholar, Cross Ref
- Griffiths MJ, McAuley DF, Perkins GD, Barrett N, Blackwood B, Boyle A, et al. Guidelines on the management of acute respiratory distress syndrome. BMJ Respir Res. 2019; 6(1): e000420.
Indexed at, Google Scholar, Cross Ref
- Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, et al. Experts’ opinion on management of hemodynamics in ARDS patients: focus on the effects of mechanical ventilation. Intensive Care Med. 2016; 42: 739-749.
Indexed at, Google Scholar, Cross Ref
- Gattinoni L, Marini JJ, Pesenti A, Quintel M, Mancebo J, Brochard L. The" baby lung" became an adult. Intensive Care Med. 2016; 42: 663-673.
Indexed at, Google Scholar, Cross Ref
- Fan E, Del Sorbo L, Goligher EC, Hodgson CL, Munshi L, Walkey AJ, et al. An official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2017; 195(9): 1253-1263.
Indexed at, Google Scholar, Cross Ref
- Petrucci N, Iacovelli W. Lung protective ventilation strategy for the acute respiratory distress syndrome. Cochrane Database Syst Rev. 2007(3).
Indexed at, Google Scholar, Cross Ref
- Amato MB, Meade MO, Slutsky AS, Brochard L, Costa EL, Schoenfeld DA, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2015; 372(8): 747-755.
Indexed at, Google Scholar, Cross Ref
- Mauri T, Guérin C, Hubmayr R. The ten pressures of the respiratory system during assisted breathing. Intensive Care Med. 2017; 43: 1504-1506.
Indexed at, Google Scholar, Cross Ref
- Hill LL, Pearl RG. Flow triggering, pressure triggering, and autotriggering during mechanical ventilation. Crit Care Med. 2000; 28(2): 579-581.
Indexed at, Google Scholar, Cross Ref
- Marini JJ, Wheeler AP.Crit Care Med. The essentials 3rd ed Philadelphia: Lippincott Williams & Wilkins. 2006.
- Lumb AB, editor. Nunn’s Applied respiratory physiology. 6th ed Philadelphia: Elsevier. 2005.
- Richard JC, Maggiore SM, Mercat A. Clinical review: Bedside assessment of alveolar recruitment. Crit Care. 2004; 8: 163-169.
Indexed at, Google Scholar, Cross Ref
- Martin-Loeches I, De Haro C, Dellinger RP, Ferrer R, Phillips GS, Levy MM, et al. Effectiveness of an inspiratory pressure-limited approach to mechanical ventilation in septic patients. Eur Respir J. 2013; 41(1): 157-164.
Indexed at, Google Scholar, Cross Ref
- Cairo JM. Mechanical Ventilation Phisiology and Clinical applications vol. 12. Ecosystems and Human Well-being: A Framework for Assessment. 2013; 81-87
- Andrew Lumb. Nunn’s Applied Respiratory Physiology. In: Nunn’s Applied Respiratory Physiology. 2016; 175-193.
- Pérez-Vela JL, Ramos-González A, López-Almodóvar LF, Renes-Carreño E, Escribá-Bárcena A, Rubio-Regidor M, et al. Neurologic complications in the immediate postoperative period after cardiac surgery. Role of brain magnetic resonance imaging. Rev Esp Cardiol (English Edition). 2005; 58(9): 1014-1021.
Indexed at, Google Scholar, Cross Ref
- Shevade MS. Time constant: what do we need to know to use it. Indian J Respir Care. 2019; 8(1): 4-7.
Google Scholar
- Terragni PP, Rosboch G, Tealdi A, Corno E, Menaldo E, Davini O, et al. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2007; 175(2): 160-166.
Indexed at, Google Scholar, Cross Ref
- Cressoni M, Gotti M, Chiurazzi C, Massari D, Algieri I, Amini M, et al. Mechanical power and development of ventilator-induced lung injury. Anesthesiology. 2016; 124(5): 1100-1108.
Indexed at, Google Scholar, Cross Ref
- Lumb AB, Thomas CR. Nunn's applied respiratory physiology eBook. Elsevier sci. 2020.
Google Scholar
- Gattinoni L, Carlesso E, Caironi P. Stress and strain within the lung. Curr Opin Crit Care. 2012; 18(1): 42-47.
Indexed at, Google Scholar, Cross Ref
- Gattinoni L, Tonetti T, Cressoni M, Cadringher P, Herrmann P, Moerer O, et al. Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med. 2016; 42: 1567-1575.
Indexed at, Google Scholar, Cross Ref
- Barach Al, Martin J, Eckman M. Positive pressure respiration and its application to the treatment of acute pulmonary edema. Ann Intern Med. 1938; 12(6): 754-795.
Google Scholar, Cross Ref
- Hill Jd, Main Fb, Osborn Jj, Gerbode F. Correct use of respirator on cardiac patient after operation. Arch Surg. 1965; 91(5): 775-778.
Indexed at, Google Scholar, Cross Ref
- Alviar CL, Miller PE, McAreavey D, Katz JN, Lee B, Moriyama B, et al. Positive pressure ventilation in the cardiac intensive care unit. J Am Coll Cardiol. 2018; 72(13): 1532-1553.
Indexed at, Google Scholar, Cross Ref
- Masa JF, Pépin JL, Borel JC, Mokhlesi B, Murphy PB, Sánchez-Quiroga MÁ. Obesity hypoventilation syndrome. Eur Respir Rev. 2019; 28(151): 1–14.
Indexed at, Google Scholar, Cross Ref
- Henderson WR, Chen L, Amato MB, Brochard LJ. Fifty years of research in ARDS. Respiratory mechanics in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2017; 196(7): 822-833.
Indexed at, Google Scholar, Cross Ref
- Gattinoni L, Carlesso E, Cressoni M. Selecting the ‘right’positive end-expiratory pressure level. Curr Opin Crit Care. 2015; 21(1): 50-57.
Indexed at, Google Scholar, Cross Ref
- Lesur O, Remillard MA, St-Pierre C, Falardeau S. Prophylactic positive end-expiratory pressure and postintubation hemodynamics: an interventional, randomized study. Can Respir J. 2010; 17(3): e45-50.
Indexed at, Google Scholar, Cross Ref
- Fernández-Mondéjar E, Chavero M, Machado J. Prophylactic positive end-expiratory pressure: are good intentions enough? Crit Care. 2002; 7(2): 1-191.
Indexed at, Google Scholar, Cross Ref
- Sahetya SK, Goligher EC, Brower RG. Fifty years of research in ARDS. Setting positive end-expiratory pressure in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2017; 195(11): 1429-1438.
Indexed at, Google Scholar, Cross Ref
- Bos LD, Martin-Loeches I, Schultz MJ. ARDS: challenges in patient care and frontiers in research. Eur Respir Rev. 2018; 27(147): 1-9.
Indexed at, Google Scholar, Cross Ref
- Brower RG, Matthay MA, Morris A, Schoenfeld D, Thompson BT, Wheeler A. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000; 342(18): 1301-1308.
Indexed at, Google Scholar, Cross Ref
- Thompson BT, Bernard GR. ARDS Network (NHLBI) studies: successes and challenges in ARDS clinical research. Crit Care clinics. 2011 Jul 1;27(3): 459-468.
Indexed at, Google Scholar, Cross Ref
- Santa Cruz R, Villarejo F, Irrazabal C, Ciapponi A. High versus low positive end‐expiratory pressure (PEEP) levels for mechanically ventilated adult patients with acute lung injury and acute respiratory distress syndrome. Cochrane Database Syst Rev. 2021; 3.
Indexed at, Google Scholar, Cross Ref
- Mercat A, Richard JC, Vielle B, Jaber S, Osman D, Diehl JL, et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2008; 299(6): 646-655.
Indexed at, Google Scholar, Cross Ref
- Tonetti T, Vasques F, Rapetti F, Maiolo G, Collino F, Romitti F, et al. Driving pressure and mechanical power: new targets for VILI prevention. Ann Transl Med. 2017; 5(14): 1-10.
Indexed at, Google Scholar, Cross Ref
- Grieco DL, Chen L, Dres M, Brochard L. Should we use driving pressure to set tidal volume?. Curr Opin Crit Care. 2017; 23(1): 38-44.
Indexed at, Google Scholar, Cross Ref
- Gattinoni L, Tonetti T, Quintel M. Regional physiology of ARDS. Crit Care. 2017; 21: 9-14.
Indexed at, Google Scholar, Cross Ref
- Gattinoni L, Marini JJ, Pesenti A, Quintel M, Mancebo J, Brochard L. The “baby lung” became an adult. Intensive Care Med. 2016; 42(5): 663-673.
Indexed at, Google Scholar, Cross Ref
- Griffiths MJ, McAuley DF, Perkins GD, Barrett N, Blackwood B, Boyle A, et al. Guidelines on the management of acute respiratory distress syndrome. BMJ open Respir Res. 2019; 6(1): 1-54.
Indexed at, Google Scholar, Cross Ref
- Werner Möller P, Jakob S, Takala J, Berger D, Stanga Z. 36th International Symposium on Intensive Care and Emergency Medicine: Brussels, Belgium. Crit Care (London, England). 2016; 20.
Indexed at, Google Scholar, Cross Ref
- Cavalcanti AB, Suzumura ÉA, Laranjeira LN, de Moraes Paisani D, Damiani LP, Guimarães HP, et al. Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. 2017; 318(14): 1335-1345.
Indexed at, Google Scholar, Cross Ref
- Amato MB, Barbas CS, Medeiros DM, Magaldi RB, Schettino GP, Lorenzi-Filho G, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998; 338(6): 347-354.
Indexed at, Google Scholar, Cross Ref
- Chiumello D, Brochard L, Marini JJ, Slutsky AS, Mancebo J, Ranieri VM, et al. Respiratory support in patients with acute respiratory distress syndrome: an expert opinion. Crit Care. 2017; 21(1): 1-8.
Indexed at, Google Scholar, Cross Ref
- Rezoagli E, Bellani G. How I set up positive end-expiratory pressure: evidence-and physiology-based! Crit Care. 2019; 23(1): 1-3.
Indexed at, Google Scholar, Cross Ref













