Keywords
Cutaneous leishmaniasis; Efficacy; Meta-analysis; Amphotericin B; Rifampicin
Introducción
La leishmaniasis es una enfermedad parasitaria transmitida por la picadura de flebotómos infectados; ésta genera un espectro de manifestaciones clínicas que incluye lesiones cutáneas ulcerativas en el sitio de la picadura del vector (leishmaniasis cutánea localizada); múltiples nódulos no ulcerosos (leishmaniasis cutánea difusa); destrucción de las membranas mucosas (leishmaniasis mucosa) y una infección visceral diseminada (leishmaniasis visceral). La leishmaniasis cutánea es la forma más común de la infección y constituye un problema de salud pública por su alta incidencia y amplia distribución geográfica; sin embargo, debido a que causa baja mortalidad y afecta principalmente a personas de bajos recursos económicos, se ha constituido en una enfermedad olvidada que suscita poco interés en las autoridades sanitarias y los profesionales de la salud para realizar actividades de investigación, prevención, control y tratamiento de la enfermedad [1].
En este sentido, los fármacos disponibles para el tratamiento de la enfermedad son limitados y los que han sido utilizados en el ámbito mundial se caracterizan por presentar alta toxicidad y eficacias heterogéneas dependiendo de la especie del parásito, la localización geográfica de la infección y el perfil inmunogenético de las personas infectadas [2,3].
Los fármacos pentavalentes derivados del antimonio han sido utilizados por varias décadas como agentes terapéuticos de primera línea a pesar de que requieren de administración intravenosa, largo periodo de tiempo (usualmente 20 días), es frecuente la necesidad de hospitalización y son comunes la generación de efectos secundarios importantes como pancreatitis, pancitopenia, neuropatía periférica y cardiotoxicidad, situaciones que en conjunto limitan la adherencia terapéutica y suscitan un dilema en el equipo médico sobre el riesgo-beneficio de su utilización [2].
Este escenario pone de manifiesto la necesidad de desarrollar alternativas terapéuticas menos tóxicas y más seguras que favorezcan la adherencia terapéutica y la eficacia de curación, y que su evaluación se lleve a cabo en el marco de estudios clínicos bien diseñados que permitan conocer de una manera adecuada el efecto de las terapias. Entre las opciones terapéuticas que se han estudiado se encuentran tratamientos locales como crioterapia y termoterapia, antiparasitarios como pentamidina, antifúngicos como Ketoconazol y Anfotericina B y antibióticos como Rifampicina [4-8]. En este orden de ideas, en dos revisiones sistemáticas previas se evidenció un número relativamente alto de opciones terapéuticas investigadas en las últimas décadas; en compuestos azólicos se concluyó que los más estudiados son Ketoconazol, Itraconazol y Fluconazol; siendo el primero el de mejor eficacia clínica [9,10].
En alusión a la Anfotericina B liposomal la Organización Mundial de la Salud recomienda su uso en las Américas como tratamiento de elección para la leishmaniasis visceral, como tratamiento de segunda línea para la forma mucocutánea y su uso para la forma cutánea en casos de falla terapéutica a los antimonios [3]; aunado a ello, ha sido evaluada su eficacia en ensayos clínicos controlados para la leishmaniasis cutánea demostrando elevados porcentajes de eficacia [11]. Por su parte la Rifampicina, aunque no figura dentro de los medicamentos recomendados por la Organización Mundial de la Salud para tratar la infección [3], su actividad contra los promastigotes y amastigotes de Leishmania spp. ha sido probada en modelos in vitro [12] y en ensayos clínicos controlados obteniendo resultados de eficacia variables [8].
A pesar de la divergencia en los resultados de estas dos opciones terapéuticas, los metanálisis para evaluar la eficacia de los tratamientos de leishmaniasis cutánea se han centrado en antimonios pentavalentes, Paromomicina, Imidazol [13], por lo que no hay evidencia en la literatura de estudios que sinteticen los resultados de ensayos clínicos controlados que utilizaron Anfotericina B y Rifampicina, de manera que la eficacia real de estos dos agentes permanece incierta. Aunado a lo anterior, es ampliamente conocida la baja calidad de la evidencia disponible para la recomendación del tratamiento de la leishmaniasis cutánea, la falta de estandarización de los métodos para conducir los ensayos clínicos y la baja calidad epidemiológica en el diseño de los estudios [14]. En coherencia con lo descrito en los párrafos previos, se diseñó este estudio con el objetivo de metaanalizar la eficacia de la Anfotericina B y la Rifampicina en el tratamiento de la leishmaniasis cutánea.
Métodos
Tipo de estudio: Revisión sistemática de la literatura con metanálisis.
Protocolo de búsqueda y selección de los estudios según las etapas de identificación, tamización, elección e inclusión consignadas en la guía PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses) [15]
Búsqueda e identificación de los estudios: se emplearon los términos Amphotericin B y Rifampicin en conjunción (booleano &) con la palabra clave Cutaneous Leishmaniasis y sus equivalentes en español y portugués. La búsqueda se realizó en las bases de datos PubMed, OVID, ScienceDirect, Embase, Wiley, Web of Science, Scielo y Lilacs. No se limitó la temporalidad de las publicaciones.
Criterios de inclusión: los estudios identificados fueron tamizados con la lectura de los resúmenes y aplicando los siguientes criterios de inclusión, i) artículos originales, ii) con los términos de búsqueda en título, resumen y/o palabras clave y iii) que fuesen ensayos clínicos controlados.
Criterios de exclusión: Una vez concluida la tamización se realizó la lectura completa de los artículos elegibles y se aplicaron los siguientes criterios de exclusión, i) investigaciones que no estaban disponibles para su revisión completa ii) publicaciones que sólo presentaran el registro del ensayo clínico sin los resultados, iii) estudios en los que se perdieron los pacientes que recibirían Anfotericina B o Rifampicina, iv) aquellos que no presentaron los resultados de los dos grupos de tratamiento v) investigaciones que tomaran como único criterio de curación la reducción del tamaño de la lesión y vi) los manuscritos en los que no era explícito la eficacia del tratamiento.
Recolección de la información: El protocolo fue aplicado por dos investigadores de forma independiente para garantizar la reproducibilidad de la selección de la información, las discrepancias se resolvieron por consenso y referencia a un tercero. Para la eliminación de los duplicados los artículos fueron exportados a los gestores de referencias Zotero y EndnoteWeb; Se utilizaron ambos administradores de referencias debido a que utilizados en conjunto se incrementa su sensibilidad. La información se extrajo en una base de datos diseñada en Excel que contenía las variables año de publicación, país, número de pacientes, si hubo cegamiento, cálculo de tamaño de la muestra, aleatorización, la descripción de los criterios de inclusión y exclusión de cada ensayo clínico, el tiempo de seguimiento posterior al tratamiento, especie de Leishmania causante de la infección, la presentación clínica de la Leishmania, los criterios de curación, el número de pacientes perdidos, la edad de los pacientes, el promedio del número de lesiones, la dosis de los tratamientos, los efectos secundarios y el número de pacientes que curaron y no curaron con cada tratamiento. La base de datos se diligenció por duplicado para garantizar la reproducibilidad de la extracción de la información, la cual se evaluó con coeficientes de correlación intraclase para las variables cuantitativas y el cálculo del índice de kappa para las variables cualitativas; en todos el estadístico fue 1,0.
Análisis de la información: Con la frecuencia de curación y no curación desagregada por tratamiento, se realizó un metaanálisis para riesgos relativos utilizando el modelo de efectos aleatorios dada la heterogeneidad de los resultados individuales. El grado de heterogeneidad se evaluó con la prueba Q (Ji cuadrado) de DerSimonian y Laird, el sesgo de publicación se evaluó a través de los estadísticos de Egger y de Begg; se realizó el análisis de sensibilidad con el método analítico para evidenciar los cambios en los riesgos relativos por la sustracción de cada estudio individual. Como resultado total del metanálisis se calcularon los riesgos relativos con sus intervalos de confianza para evidenciar diferencias en los tratamientos en cada estudio y la diferencia global con sus respectivos intervalos de confianza. Todos los análisis se realizaron en el software EPIDAT versión 3.1.
Resultados
En la búsqueda inicial se identificaron 9.825 estudios en Anfotericina B y 5.807 en Rifampicina de los cuales se metanalizaron seis ensayos clínicos que cumplieron el protocolo, tres que evaluaron Anfotericina B en comparación con antimoniales pentavalentes y tres que compararon la eficacia de la Rifampicina contra un placebo (Figura 1).
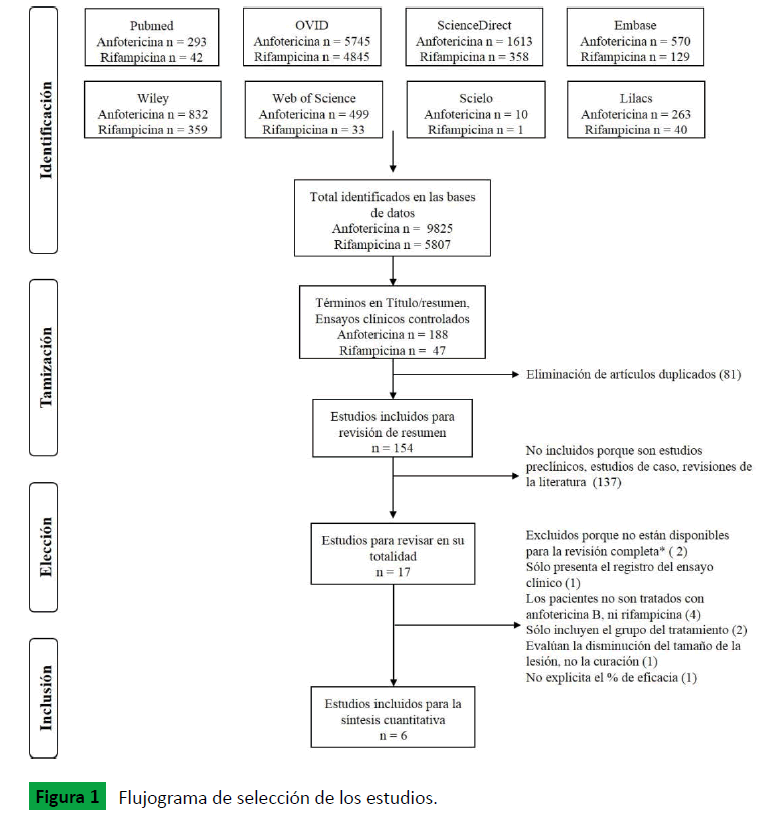
Figura 1: Flujograma de selección de los estudios.
En la Tabla 1 se presenta una descripción de los estudios según año, lugar, especie y características metodológicas; la mayoría se desarrollaron en Asia, con bajos tamaños de muestra, sin cegamiento en los ensayos que evaluaron Anfotericina B y con seguimientos entre 1,5 y 12 meses.
| Autor |
Motta et al. [7] |
Layegh et al. [16] |
Solomon et al. [11] |
Kochar et al. [8] |
Jaffar et al. [17] |
Kochar et al. [18] |
| Año |
2012 |
2011 |
2013 |
2006 |
2006 |
2000 |
| Tratamiento |
Anfotericina liposomal |
Rifampicina |
| Comparador |
Antomoniales pentavalentes |
Placebo |
| País |
Brasil |
Irán |
Israel |
India |
Arabia Saudí |
India |
| N |
35 |
110 |
68 |
50 |
62 |
50 |
| Especie |
No reportada |
L. tropica, L. major |
L.(V) braziliensis |
L. tropica |
No reportada |
L. tropica |
| Cegamiento |
No |
No |
No |
Sí, doble |
Sí |
Sí, doble |
| Criterio de inclusión |
Sin tratamiento previo, ≤ 6 lesiones<2 años de duración |
Lesiones<6 meses de duración, Sin tratamiento previo o>3 meses sin tratamiento |
Viaje reciente a las américas, clínica compatible y demostración de amastigotes |
Diagnóstico confirmado por demostración de amastigotes |
Diagnóstico confirmado por demostración de amastigotes |
Diagnóstico confirmado por demostración de amastigotes |
| Criterio de exclusión |
Tratamiento previo, enfermedad de base, no permiten diagnóstico |
Embarazo, lactancia, otro tratamiento, enfermedad de base |
Forma mucosa de la enfermedad |
No están explícitos |
No están explícitos |
No están explícitos |
| Cálculo de n |
Sí |
Sí |
No |
No |
No |
No |
| Aleatorio |
Sí |
Sí |
No |
Sí |
Sí |
Sí |
| Seguimiento |
12 meses |
6 meses |
29 meses |
1,5 meses |
3 meses |
1,5 meses |
| Criterio curación |
Re-epitelización a los 90 días |
No es explícito |
Re-epitelización a los 90 días |
Desaparición de la lesión o hipopigmentación reversible |
Reducción marcada del tamaño, curación completa y pigmentación |
Desaparición de la lesión o hipopigmentación reversible |
Tabla 1: Descripción de los estudios según año, lugar, especie, características metodológicas.
En los estudios que evaluaron Anfotericina B la edad media osciló entre 20 y 29 años, los pacientes incluidos presentaban una media inferior a dos lesiones, con bajos efectos adversos y diferentes dosis; en los ensayos con Rifampicina se hallaron unas características similares, aunque con deficiencias en el reporte de los efectos adversos (Tabla 2).
| Grupo 1 |
Motta [7] |
Layegh [16] |
Solomon [11] |
Kochar [8] |
Jaffar [17] |
Kochar [18] |
| Incluidos/perdidos |
16/0 |
50/11 |
34/0 |
25-Feb |
46/12 |
25-Feb |
| Edad (Años) |
Media 29 |
Media 20,5 |
Media 25,7 |
Rango 16 a 60 |
Media 20 |
Media 29,5 |
| Media del # de lesiones |
1,4 |
1,9 |
1,6 |
1,7 |
Sin dato |
2,9 |
| Dosis |
Liposomal AmB 1,5 mg/kg/día I.V. x 5 días |
Liposomal AmB 3-7 gotas/12/h I.D. x 56 días |
Liposomal AmB 3 mg/kg I.V X 6 días* |
Rifampicina** 1200 mg/día x 42 días |
Rifampicina 10 mg/kg/día x 28 a 42 días |
Rifampicina 1200 mg/día x 42 días |
| Efectos secundarios (n) |
Cambios en creatinina (1) |
Prurito (5) |
Dificultad para respirar (2), toxicidad renal (2) |
Sin dato |
Sin dato |
Sin dato |
| Grupo 2 |
|
| incluidos/perdidos |
19/0 |
60/23 |
34/0 |
25-Apr |
16-Sep |
25-Feb |
| Edad (años) |
Media 32 |
Media 25,3 |
Media24,4 |
Rango 16 a 70 |
Media 20 |
Media 26,9 |
| Lesiones (Media) |
2,3 |
1,4 |
2 |
1,6 |
Sin dato |
2,1 |
| Dosis |
Antimonio 20mg/Kg/día I.V. x 20 días |
Antimonio 1-2 ml/I.D. x semana x 56 días |
Antimonio 20 mg/kg I.V x 21 días |
Placebo |
Placebo |
Placebo |
| Efectos secundarios (n) |
Mialgia (8), artralgia (4), taquicardia (1), cefalea (1), alteración en creatinina (3), úrea (1), transaminasas (1), bilirrubina (1), amilasa (1) |
Eritema y edema (7) |
Efectos importantes (22) no los describen |
Sin dato |
Sin dato |
Sin dato |
Tabla 2: Descripción de los grupos de estudio y análisis de seguridad.
En los 89 pacientes tratados con Anfotericina B se halló una eficacia del 66,3% (IC95%=55,9-76,7), la cual resultó estadísticamente similar a la reportada en los 90 pacientes tratados con antimoniales (75,6% IC95%=66,1-85,0) y a los 80 tratados con Rifampicina (67,5% IC95%=56,6-78,4) (Tabla 3).
| Autor |
Tratamiento: Anfotericina B Liposomal |
Control: Antimonial |
| Eficacia %(n/N) |
IC 95% |
Eficacia %(n/N) |
IC 95% |
| Motta et al. [7] |
50 (8/16) |
24,6-75,4 |
100 (19/19) |
82,3-100 |
| Layegh et al. [16] |
56,4 (22/39) |
39,6-73,2 |
67,6 (25/37) |
51,1-84,0 |
| Solomon et al. [11] |
85,3 (29/34) |
68,9-95,0 |
70,6 (24/34) |
53,8-87,4 |
| Total |
66,3 (59/89) |
55,9-76,7 |
75,6 (68/90) |
66,1-85,0 |
| |
Tratamiento: Rifampicina |
Control: Placebo |
| Kochar et al. [8] |
65,6 (16/23) |
47,1-86,8 |
14,3 (7/10) |
3,0-36,3 |
| Jaffaret al. [17] |
61,8 (21/34) |
44,0-79,6 |
42,9 (13/16) |
9,9-81,6 |
| Kochar et al. [18] |
73,9 (17/23) |
51,6-89,8 |
4,3 (6/7) |
0,1-22,0 |
| Total |
67,5 (54/80) |
56,6-78,4 |
13,7 (26/33) |
3,3-24,1 |
Tabla 3: Eficacia de los tratamientos y controles comparados en los estudios.
Los metanálisis bajo un modelo de efectos aleatorios demostraron que la Anfotericina B presenta una eficacia estadísticamente similar a la reportada en los antimoniales y que la Rifampicina es tres veces más eficaz que el placebo (Tabla 4). Los metanálisis se realizaron bajo un modelo de efectos aleatorios dada la presencia de heterogeneidad entre los estudios (Vp Prueba de Dersimonian y Laird's=0,000; Coeficiente RI o proporción de varianza total debida a la varianza entre estudios=0,81 en Anfotericina By 0,72 en Rifampicina; además no se halló sesgo de publicación (Vp Prueba de Begg Estadístico Z=0,296).
| Anfotericina B Liposomal/Antimonios |
| Metanálisis |
Análisis de sensibilidad |
| Estudio |
RR (IC 95%) |
% Peso |
RR (IC 95%) |
Cambio relativo |
| Motta et al. [7] |
0,50 (0,31;0,82) |
28,88 |
1,02 (0,71;1,47) |
24,13 |
| Layegh et al. [16] |
0,83 (0,58;1,19) |
33,88 |
0,80 (0,33;1,89) |
-3,49 |
| Solomon et al.[11] |
1,20 (0,94;1,56) |
37,24 |
0,66 (0,40;1,10) |
-19,51 |
| Efectos fijos |
0,95 (0,78;1,15) |
|
|
|
| Efectos aleatorios |
0,83 (0,51;1,32) |
|
|
|
| Rifampicina/Placebo |
| Kochar et al. [8] |
17,0 (2,46;117,4) |
23,20 |
2,55 (0,77;8,38) |
-36,26 |
| Jaffar et al. [17] |
1,44 (0,59; 3,53) |
40,08 |
6,97 (2,30;21,10) |
74,40 |
| Kochar et al. [18] |
4,87 (1,65;14,37) |
36,72 |
4,24 (0,38;46,71) |
6,14 |
| Efectos fijos |
2,95 (1,54; 5,66) |
|
|
|
| Efectos aleatorios |
3,99 (1,12;14,24) |
|
|
|
Tabla 4: Metanálisis para anfotericina Liposomal y rifampicina, y análisis de sensibilidad.
Discusión
Este metanálisis demostró que la Anfotericina B puede presentar una eficacia terapéutica similar a los antimoniales pentavalentes, mientras que la Rifampicina es tres veces más eficaz que el placebo para el tratamiento de la leishmaniasis cutánea, principalmente en países asiáticos. Esto resulta relevante para orientar estudios posteriores en otras regiones, particularmente América en donde se encuentran algunos los países con alta ocurrencia de la enfermedad como Brasil, Colombia y Perú [19].
En los pacientes tratados con Anfotericina B se halló una eficacia del 66,3% (IC95%=55,9-76,7), baja frecuencia de efectos adversos y con una alta heterogeneidad en las dosis usadas. En reportes previos se ha indicado que esta alternativa es eficaz principalmente para leishmaniasis cutánea causada por L (V) braziliensis, una de las especies con mayores dificultades para el tratamiento y con reportes más bajos de eficacia; incluso en algunos estudios se ha reportado que los antimoniales pentavalentes sólo presentan una eficacia del 75% para esta especie [20,21].
Un punto crítico del tratamiento con Anfotericina B radica en las dosis indicadas para garantizar su eficacia en leishmaniasis; en este sentido, se han documentado que para la presentación liposomal de este medicamento dosis en un rango tan amplio como 1.5-5.0 mg/kg/día por 5 o 10 días, lo que equivale a una dosis total que oscila entre 7.5 y 50.0 mg/kg; esta última dosis permitiría una mayor eficacia, aunque los resultados no podrían generalizarse a pacientes con lesiones grandes o más de tres, en quienes se podría registrar una menor curación [11].
En el estudio de Motta optaron por la dosis más baja posible de Anfotericina B Liposomal sustentado en tres factores: evidencia previa que mostraba eficacia en bajas dosis del tratamiento para la forma visceral, evidencia clínica que indica cómo la forma cutánea puede tener una mejor respuesta terapéutica y la necesidad de disponer de un medicamento económicamente asequible, máxime al tener presente que la Anfotericina B Liposomal es costosa y la enfermedad se presenta en escenarios de pobreza donde el costo y la duración de los tratamientos son obstáculos importantes para su control [11]. Finalmente, varios autores han indicado la necesidad de establecer la dosis y duración óptimas del tratamiento con estudios adicionales [22].
Por otra parte, el uso de Rifampicina reportó una eficacia del 67,5, lo cual resultó 3 veces mayor al uso de placebo y estadísticamente similar a la Anfotericina B Liposomal y a los antimoniales en el metanálisis de efectos mixtos. Este medicamento ha registrado una eficacia favorable con la ventaja de presentar mejores resultados de seguridad, incluso mayores a la Anfotericina B en todas sus presentaciones. En el estudio de Jaffar se recomienda el uso de 10 mg/kg/día/6 semanas y para niños la misma dosis por una o dos semanas menos [22].
Al igual que otros tratamientos que se han explorado para la leishmaniasis cutánea, la recomendación de la Rifampicina es controversial por el desconocimiento de su eficacia en especies diferentes a las incluidas en este metanálisis y por la dosis y duración del tratamiento. A pesar de que los resultados de eficacia resultan satisfactorios, esta opción terapéutica presenta una limitación crassa en relación con la duración de su aplicación (superior a un mes), ya que podría derivar en una baja adherencia [8,18].
Finalmente, vale precisar que la Rifampicina actúa bloqueando la síntesis de RNA mediante la inhibición de la polimerasa, constituye un medicamente que generalmente es bien tolerado por los pacientes, sus principales efectos adversos se relacionan con alteración hepática y gastrointestinal y en comparación con otras opciones terapéuticas resulta menos costoso, no requiere monitoreo y puede resultar más seguro [8,18].
Las principales limitaciones del estudio se relacionan con el bajo número de estudios y sujetos incluidos en los ensayos clínicos, lo que deriva en un bajo poder estadístico de los análisis, particularmente las pruebas para evaluar sesgo de publicación con menos de 5 estudios pueden redundar en un alto error β con lo cual no se detectarían sesgos que realmente si existen. Esto implicaría que los estudios con una alta eficacia se publican más fácilmente, mientras que los ensayos clínicos con resultados desfavorables no se publicarían.
Sumado a lo anterior, se debe tener presente que los estudios incluidos presentaron baja calidad metodológica, pocos estudios se desarrollaron en América (una de las regiones con mayor ocurrencia de leishmaniasis cutánea), sin informes de eficacia por especie y en algunos casos con seguimientos muy cortos; todo ello redunda en un bajo grado de recomendación del uso de estos medicamentos y limitaciones en la posibilidad de extrapolar los resultados a otros lugares.
Conclusión
A pesar de los resultados favorables de la eficacia terapéutica de ambos medicamentos es necesario desarrollar estudios en cada país para evaluar sus efectos en condiciones epidemiológicas, clínicas y parasitológicas específicas, dada la baja calidad metodológica, el reducido número de investigaciones y la elevada heterogeneidad de los estudios analizados.
17607
References
- Reithinger R, Dujardin J, Louzir H, Pirmez C, Alexander B, et al. (2007) Cutaneous leishmaniasis. Lancet Infect Dis 7: 581-596.
- Singh S, Sivakumar R (2004) Challenges and new discoveries in the treatment of leishmaniasis. J Infect Chemother 10: 307-315.
- Organización Panamericana de la Salud (2013) Leishmaniasis en las Américas: recomendaciones para el tratamiento. Washington, D.C.
- Ranawaka R, Weerakoon H, Opathella N (2011) Liquid nitrogen cryotherapy on Leishmania donovani cutaneous leishmaniasis. J Dermatolog Treat 22: 241-245.
- Lai A Fat E, Vrede A, Soetosenojo RM, Lai A Fat R (2002) Pentamidine, the drug of choice for the treatment of cutaneous leishmaniasis in Surinam. Int J Dermatol 41: 796-800.
- Salmanpour R, Handjani F, Nouhpisheh M (2001) Comparative study of the efficacy of oral ketoconazole with intra-lesional meglumine antimoniate (Glucantime) for the treatment of cutaneous leishmaniasis. J Dermatolog Treat 12: 159-162.
- Motta J, Sampaio R (2012) A pilot study comparing low-dose liposomal amphotericin B with N-methyl glucamine for the treatment of American cutaneous leishmaniasis JEADV 26: 331-335.
- Kochar D, Saini G, Kochar S, Sirohia P, Bumbb R, et al. (2006) A double blind, randomised placebo controlled trial of rifampicin with omeprazole in the treatment of human cutaneous leishmaniasis J Vect Borne Dis 43: 161-167.
- López L, Catalina L, Cardona J (2016) Sistematización de estudios clínicos sobre la eficacia de tratamientos para la leishmaniasis cutánea 1980-2015. Arch de Medi 12.
- López L, Palacio M, Cardona J (2016) Eficacia de los azoles en el tratamiento de la leishmaniasis cutánea. Arch de Medi 12.
- Solomon M, Pavlotzky F, Barzilai A, Schwartz E (2013) Liposomal amphotericin B in comparison to sodium stibogluconate for Leishmania braziliensis cutaneous leishmaniasis in travelers. J Am Acad Dermatol 68: 284-289.
- El-On J, Pearlman E, Schnur L, Greenblatt C (1983) Chemotherapeutic activity of rifampicin on leishmanial amastigotes and promastigotes in vitro. Isr J Med Sci 19: 240-245.
- Tuon F, Amato V, Graf M, Siqueira A, Nicodemo A, Amato V (2008) Treatment of New World cutaneous leishmaniasis: a systematic review with a meta-analysis. Int J Dermatol 47: 109-124.
- Olliario P, Vaillant M, Arana B, Grogl M, Modabber F, et al. (2013) Methodology of clinical trials aimed at assessing interventions for cutaneous leishmaniasis. PLoS Negl Trop Dis 7: e2130.
- Urrutia G, Bonfill X (2010) Declaración PRISMA: Una propuesta para mejorar la publicación de revisiones sistemáticas y Meta análisis. Med Clin 135: 507-511.
- Layegh P, Rajabi O, Jafari M, Emamgholi TMP, Moghiman T, et al. (2011) Efficacy of topical liposomal amphotericin b versus intralesional meglumine antimoniate (glucantime) in the treatment o fcutaneous leishmaniasis. J Parasitol Res 2011: 656523.
- Jaffar H (2006) Rifampicin in cutaneous leishmaniasis a therapeutic trial in Saudi Arabia. J Pakistan Association of Dermatologists 16: 4-9.
- Kochar D, Aseri S, Sharma B, Bumb R, Mehta R, et al. (2000) The role of rifampicin in the management of cutaneous leishmaniasis. QJM 93: 733-737.
- Alvar J, Vélez I, Bern C, Herrero M, Desjeux P, et al. (2012) Leishmaniasis Worldwide and Global Estimates of Its Incidence. PLoS ONE 7: 1-12.
- Scope A, Trau H, Anders G, Barzilai A, Confino Y, et al. (2003) Experience with New World cutaneous leishmaniasis in travelers. J Am Acad Dermatol 49: 672-678.
- Herwaldt B, Berman J (1992) Recommendations for treating leishmaniasis with sodium stibogluconate (Pentostam) and review of pertinent clinical studies. Am J Trop Med Hyg 46: 296-306.
- Devlin R, Parsonnet J, Klaus S (2005) Treatment of relapsed cutaneous Leishmania (Viannia) braziliensis infection with liposomal amphotericin B. Infect Dis Clin Pract 13: 84-86.






