Introducción
”...nos empezamos a cuestionar si nuestra actual concepción de la circulación es completamente correcta. Por lo que se refiere a la parte venosa de la circulación, pienso que nuestra concepción actual es incorrecta”. Herlihy [1]
“Parece increíble que el gran complejo funcional de las venas no fuera reconocido como un sistema hasta 1940... En las últimas cuatro décadas del siglo XIX, nuestro conocimiento de las venas vertebrales evolucionó, para después caer en el olvido”.Batson [2]
En el siglo XVI ya se conocía la existencia tanto del sistema venoso craneal como del sistema venoso vertebral (VVS), pero no fue hasta 1819, cuando Breschet [3] realizó detallados dibujos que ilustraban las múltiples anastomosis de las venas craneales y vertebrales, que representaban con precisión la conexión anatómica entre el sistema venoso intracraneal y el VVS (Figura 1). En la actualidad se reconoce la existencia de una notable continuidad anatómica y funcional entre las venas, los senos y plexos venosos del cerebro y de la espina. Este artículo propone el término “sistema venoso cerebroespinal” (CSVS) para enfatizar dicha continuidad, que además se caracteriza por la inexistencia de válvulas en las venas de dicho sistema.
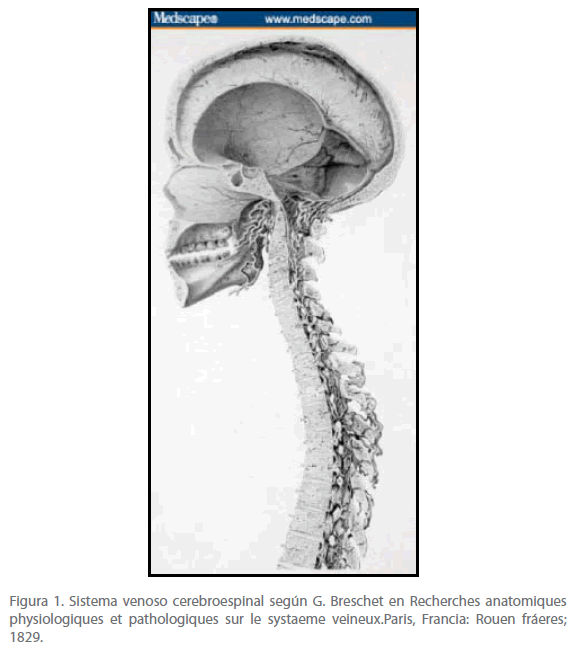
Figura 1. Sistema venoso cerebroespinal según G. Breschet en Recherches anatomiques physiologiques et pathologiques sur le systaeme veineux.Paris, Francia: Rouen fráeres; 1829.
La importancia de dicho sistema venoso se ignoró hasta el trabajo seminal de Batson [2] en 1940, y frecuentemente no se reconoce a pesar de la gran cantidad de estudios que lo confirman. [4-8] En una serie de experimentos con cadáveres humanos y monos vivos, y gracias a moldes vasculares mediante la técnica de corrosión, disecciones anatómicas e inyecciones de contrastes radio opacos observados en radiografías fijas o en serie [9-14], Batson demostró la continuidad del CSVS desde la pelvis al cráneo, y estableció que el CSVS proporciona una ruta directa vascular para la propagación de tumores, infecciones o embolias desde la pelvis o la espina dorsal al cerebro. Los estudios radiográficos funcionales de Batson definen muchas de las características fisiológicas de este sistema venoso único, incluido el hecho crítico de que las venas del CSVS carecen de válvulas, y por lo tanto permiten el flujo bidireccional. En 1947, Herlihy [1] señaló la importancia de este descubrimiento singular de la existencia de un sistema venoso principal que no seguía el paradigma del flujo circular de Harvey [15] con respecto a la circulación sanguínea. Si bien los descubrimientos de Batson no son ampliamente conocidos, están corroborados por estudios posteriores con una variedad de modalidades visuales, incluidas angiografías, moldes con la técnica de la corrosión, ultrasonidos, tomografías (TC) y venografías de resonancia magnética (RM). La continuidad funcional del sistema craneal y venoso vertebral proporciona una explicación directa de patrones recurrentes y bien conocidos de metástasis, infecciones y embolización.
Anatomía del CSVS
“En breve, las venas vertebrales constituyen un sistema plexiforme carente de válvulas con un patrón longitudinal. Son paralelas y se comunican con la vena cava superior e inferior. El plexo se extiende por toda la longitud de la columna vertebral y se une con el terminal craneal en los senos durales”. Batson [2]
El sistema venoso intracraneal, incluidos los senos durales se conoce desde hace tiempo, pero fue Breschet [3] quien representó, del modo más claro y preciso, las múltiples y directas interconexiones entre los senos venosos craneales y el plexo venoso vertebral (figura 1). [16]
Las finas paredes del plexo venoso vertebral requieren métodos especiales para conservar su arquitectura si están destinadas al examen postmortem. Aunque se demostrara primero mediante disección, algunos métodos más modernos de inyección [5,17,18] e imágenes de rayos X [6-8,19-23], además de las técnicas tomográficas y de resonancia magnética [24-27] han establecido y afirmado tanto la anatomía como la anastomosis de dicho sistema venoso, que es único. Es más, las venas epidurales también se conocen como “venas meningoraquídeas” [2,6].
Los plexos venosos vertebrales: las venas internas, externas y basivertebrales
Bock corroboró la detallada descripción anatómica del VVS de Breschet, [4] realizando disecciones, estudios de moldes de corrosión y siguiendo los métodos de inyección de Batson [2,9,10,12-14] en cadáveres humanos y monos vivos. También repitió estudios angiográficos en humanos, como los de Anderson. [28] Dichos estudios han demostrado que el plexo venoso vertebral consta de un rico sistema de venas, anastomizado e interconectado, que discurren por toda la longitud del canal vertebral. Por motivos descriptivos, Groen y su equipo [29] separaron el plexo venoso vertebral en tres divisiones que se comunican entre sí: los plexos venosos internos, anteriores y posteriores que yacen dentro del canal espinal pero fuera de la duramadre; los plexos venosos externos, anteriores y posteriores, que rodean la columna vertebral, y las venas basivertebrales, que discurren horizontalmente dentro de las vértebras. Tanto el plexo venoso interno como el externo discurren longitudinalmente a lo largo de toda la espalda, desde el sacro hasta el encéfalo. Clemens [5] utilizó moldes corrosivos e inyecciones de Araldito para demostrar cómo se comunican libremente los plexos venosos internos y externos, hecho que también demostró Vogelsang [7] mediante venografías interóseas de la espina dorsal. Groen y equipo [17] utilizaron una técnica perfeccionada de inyección de Araldito y confirmaron el hecho de que todas las divisiones del VVS, es decir, los plexos internos y externos y las venas basivertebrales, se comunican libremente, y que todas las divisiones del sistema carecen de válvulas. El plexo venoso interno vertebral se comunica con las venas intraespinales y radiculares, y también lo hace libremente con el plexo venoso externo mediante las venas intervertebrales (figura 2). [10,23,29,30]
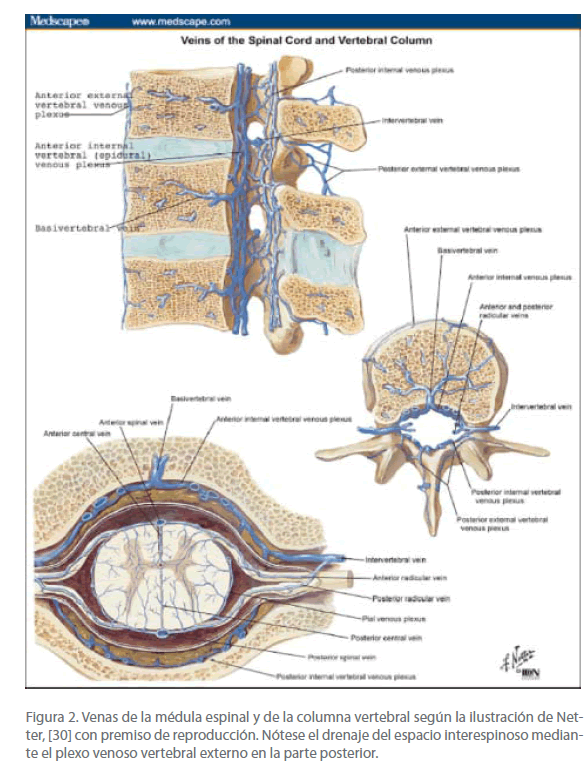
Figura 2. Venas de la médula espinal y de la columna vertebral según la ilustración de Netter, [30] con premiso de reproducción. Nótese el drenaje del espacio interespinoso mediante el plexo venoso vertebral externo en la parte posterior.
Interconexión de los sistemas venosos de la espina dorsal y del cerebro
“Cuando se aumentó la masa de la inyección hasta un total de 200cc, el material entró hasta la base del cráneo y penetró en la cavidad craneal”. Batson [2]
Ha habido muchos investigadores que han confirmado la anastomosis anatómica entre los plexos venosos vertebrales y el sistema venoso intracraneal, que Breschet ilustrara por vez primera [3]. En particular, los estudios de inyecciones de Batson [2,9,10,12-14] y las investigaciones angiográficas de Anderson [28] demostraron que es posible visualizar los senos venosos craneales si se inyecta una sustancia dentro del VVS. Las investigaciones más recientes detallan descubrimientos idénticos y establecen una conexión funcional directa entre el plexo venoso vertebral y el sistema venoso intracraneal, incluido el seno cavernoso suboccipital, las venas condilares y el plexo hipogloso [17,18,25,31,32]. Groen y equipo, que ya habían confirmado la libre comunicación entre el VVS y el sistema venoso intracraneal [17], también encontraron Araldito distribuido en los senos craneales (seno sagital superior, confluens sinuum, seno sigmoideo, seno cavernosos y el plexus basilaris), y en las principales venas corticales del cerebro y del cerebelo, después de inyectar un contraste dentro del VVS.
Comunicación entre el sistema venoso intracraneal y las venas del cuello cabelludo, el cráneo y la cara
“En todo el cráneo, se anastomizan ricamente las venas del cerebro, las venas de la meninge (los senos venosos), y las mismas venas de los huesos del cráneo (las venas diploicas), así como las venas de diversos plexos extracraneales”. Batson [2]
“Se aprecian, en menor medida, las venas faciales y su notable anastomosis con el sistema venoso intracraneal”. Osborn [33]
Las angiografías han demostrado la comunicación entre las venas faciales, oftálmicas y orbitales, así como las venas cerebrales internas, [33] lo que confirma los estudios de Batson [10,11], en los que se utilizaron tanto las técnicas de inyección como los moldes de corrosión. Por otra parte, las venas en los senos cavernosos (los compartimentos sellares laterales) forman parte del CSVS. [2,18,28,29]Parkinson [34,35] describió el plexo venoso vertebral como parte del compartimento del neroeje de la duramadre externa, que se extiende desde la espina al compartimento sellar lateral (seno cavernoso) de las venas orbitales. Debido a las anastomosis del CSVS con las venas del cráneo, el cuello cabelludo, y la cara, y la posibilidad del flujo bidireccional, Zenker y Kubik [36] han especulado que una de las funciones fisiológicas normales de dichas anastomosis es el enfriamiento del cerebro y de la médula espinal. Puesto que todo el sistema interconectado carece de válvulas, la sangre puede fluir en cualquier dirección, bien hacia o desde el cerebro, las venas oftálmicas, los senos cavernosos, la médula espinal o las vértebras.
Comunicación de los plexos venosos vertebrales y las venas de la pared posterior y toracoabdominal
“Estas venas vertebrales tienen múltiples y ricas comunicaciones con las venas en el canal espinal, las venas alrededor de la columna vertebral y las que están dentro de los huesos de la columna. Este sistema se comunica con las venas segmentales (intercostales) de la pared toracoabdominal (incluidas las de los senos), y con las venas del sistema ácigos.” Batson [2] “Las estructuras posteriores a los procesos trasversales de las vertebras drenan la sangre a las venas postvertebrales que carecen de válvulas”. Batson [12]
Del mismo modo que el sistema venoso intracraneal se comunica con las venas superficiales del cuello cabelludo, la cabeza, y la cara, el VVS se comunica libremente con otras venas superficiales y carentes de válvulas en la espalda y en la pared toracoabdominal. [12,17]Batson [2,10,12] inyectó un contraste radio opaco en las venas subcutáneas del pecho en cadáveres humanos con el fin de mostrar el flujo al VVS y los senos durales del cráneo, incluidos el seno transversal y el seno longitudinal superior. El plexo venoso vertebral externo se conecta directamente con las venas que revisten los elementos espinodorsales posteriores, las venas que drenan el espacio interespinoso y las venas que drenan los músculos dorsales profundos (figura 2). [5,7,14,29,30]
Anastomosis del VVS con los sistemas ácigos, pulmonar y de la vena cava
Por otra parte, mediante la anastomosis, el plexo venoso vertebral se comunica con el sistema venoso sistémico, incluido el sistema ácigos de las venas (y, por lo tanto, con la vena bronquial posterior y las venas pleurales parietales), las venas renales siniestras y suprarrenales, el sistema venoso portal, y las venas cavas inferior y superior, proporcionando así un sistema venoso que no solo circunvala pero también comunica con el sistema venoso sistémico que consta de válvulas. [12,17,29]
Comunicación entre los plexos venosos vertebrales y las venas pélvicas, prostáticas y sacrales
“Después de haber inyectado un total de 200cc del diodrasto en la vena dorsal profunda del pene, se obtuvieron películas del cráneo...hay una acumulación del medio opaco en el seno sagital, además de que el confluens sinumm....y muchas otras venas cerebrales superiores están llenas, el seno directo está bien lleno...se observan claramente la vena cerebral principal, los senos petróseos y una porción del plexo basilar de las venas.” Anderson [28]
En la parte posterior, el plexo venoso vertebral se comunica libremente con las venas prostáticas y el plexo venoso sacreo. [2,17,29]
En resumen, las múltiples investigaciones anatómicas han confirmado que el CSVS es un sistema venoso interconectado y carente de válvulas, que corre desde la pelvis al cráneo, y dentro del cual el drenaje venoso del cerebro, la médula espinal y las vértebras se mezclan entre sí. Como Batson [14] confirmara “las venas durales craneales son el terminus más superior de las venas vertebrales”. El CSVS conecta tanto con el sistema venoso sistémico profundo, que consta de válvulas, incluida la vena cava inferior y superior, y con las venas superficiales y carentes de válvulas de la cara, la cabeza, la espalda y la pared toracoabdominal. Las ricas anastomosis y las notables conexiones funcionales entre el sistema venoso craneal y el VVS apoyan la denominación de “CSVS” que recibe dicho sistema.
Fisiología
Los cuatro sistemas de fluidos que comunican entre los compartimentos intra y extracraneales
A modo de concepto, se pueden dividir los sistemas de fluido que comunican los compartimentos intra y extracraneales en 4 categorías: el líquido cefalorraquídeo (CSF), las arterias, el sistema venoso de la yugular, y el VVS. Según la hipótesis de Monroe-Kellie, la suma del volumen de los diversos componentes de la cavidad intracraneal, es decir, la sangre, el cerebro y el CSF) siempre permanece constante. [37] Los cambios en la distribución intra y extracraneal del CSF son limitados porque la duramadre carece de distensibilidad. Por consiguiente, puesto que los contenidos intracraneales no son comprimibles bajo condiciones fisiológicas, las alteraciones en el volumen sanguíneo arterial del cráneo tienen que compensarse con cambios opuestos correspondientes en el volumen venoso craneal. Ya que el flujo sanguíneo craneal es continuo, el influjo arterial craneal a ser equivalente al eflujo venoso craneal. No obstante, el sistema venoso yugular tiene dificultad para realizar la tarea por sí mismo, puesto que tiende a colapsar con cambios en la postura, y actúa como un resistor Starling. [37,38] Por lo tanto, entra en juego el notable papel fisiológico del VVS con respecto al índice del flujo venoso de (y hacia) el cerebro.
Flujo venoso procedente del cerebro
“...tenemos razón al considerar que las venas vertebrales son, por encima de todo, la vía accesoria más importante para el retorno venoso proveniente del cráneo.” Herlihy [1]
“Estos estudios demuestran que, en la posición supina, el plexo venoso vertebral es una notable vía de salida fundamental para las venas cerebrales, mientras que en la posición erecta parece ser la principal vía de salida para el flujo sanguíneo cerebral”. Epstein et al. [20]
“...el plexo venoso vertebral proporciona una de las mayores compensaciones circulatorias que permite que las personas se mantengan conscientes mientras están sentadas o de pie”. Eckenhofft19]
El sistema venoso yugular se reconoce generalmente como la principal vía para el eflujo venoso desde el cerebro. No obstante, el sistema venoso yugular tiene importantes limitaciones en el flujo debido a los cambios en la postura. [38,39] En 1966, Eckenhoff [40] postuló que el plexo venoso vertebral podría proporcionar una ruta significativa para el eflujo venoso desde el cerebro. En 1970, Epstein y su equipo [20] proporcionaron evidencia científica para apoyar tal afirmación, al demostrar que cuando se inyectaba el sino sagital con un medio de contraste en monos Rhesus en la posición erecta, el VVS era la principal vía para el eflujo venoso desde el cerebro, y el VVS seguía siendo la vía de salida venosa fundamental incluso en la posición supina. Sugirieron que el plexo venoso vertebral puede actuar como un sifón, pues facilita el flujo sanguíneo por el cerebro cuando el cuerpo está levantado. Por lo tanto, el CSVS puede compensar las limitaciones inherentes del flujo en el sistema venoso yugular. Los neurocientíficos han demostrado que, cuando la persona está de pie, el flujo venoso desde el cerebro sucede predominantemente a través del CSVS. [19-21,38,41-44]
Valdueza y su equipo [45] utilizaron sonografías dúplex en color para medir el flujo de salida venoso en el cerebro de 23 voluntarios humanos, y descubrieron que el flujo yugular interno había disminuido de 700ml/minuto en la posición supina a 70ml/minuto cuando la elevación era de 90°. También encontraron un aumento paralelo en el flujo venoso vertebral, de 40ml/minuto cuando la elevación era de 0° a 210ml/minuto cuando eran 90°, mientras que el resto del flujo sin medir probablemente estaba pasando a través del plexo venoso interno vertebral, y no se podía medir por el método de Doppler.
Schreiber y su equipo [46] también investigaron el drenaje sanguíneo venoso en el cerebro humano mediante ultrasonido dúplex en color. En su primera investigación con humanos sanos, declararon que el total del flujo sanguíneo venoso en posición de descanso era 766 ± 226 ml/minuto en la posición supina, pasando la mayoría del flujo a través de las venas yugulares internas (720 ± 232 ml/minuto) y una pequeña cantidad de flujo(47 ± 33mL/ minuto) a través de las venas vertebrales. [46] En un estudio posterior, descubrieron que, en la posición supina, el 6% de los voluntarios humanos sanos presentaban predominantemente un patrón para el drenaje venoso cerebral que no era yugular. [41] Gisolf y su equipo [38] usaron el método Doppler para medir el flujo sanguíneo en el cerebro, así como ultrasonido para medir el área trasversal de la vena yugular interna en voluntarios humanos sanos que estaban en la posición supina o erecta, tanto antes como durante la maniobra de Valsalva. Los cálculos sugirieron que el flujo venoso en el cerebro depende de la postura y de la presión central en el sistema venoso. Cuando los voluntarios se ponían de pie, y sin que hubiera un aumento en la presión venosa central provocado por una maniobra de Valsava, las venas yugulares se colapsaban y el eflujo venoso del cerebro discurría por el VVS. La maniobra de Valsalva, con el incremento correspondiente en la presión venosa central, abre las venas yugulares y permite el flujo por dicho sistema. En la posición supina, las venas yugulares se abren, la zona trasversal del lumen se ensancha, y las venas yugulares internas son la principal vía de salida de las venas desde el cráneo. [38] Los cálculos de Gisolf correspondían con el estudio de Valdueza, que afirmaba una reducción considerable del flujo yugular interno incluso a 15° de elevación desde la posición horizontal. Zippel y su equipo, [47] utilizaron moldes con la técnica de corrosión, así como fluorcospias para estudiar el CSVS en las serpientes, y concluyeron que el CSVS es importante para mantener el suministro de sangre cerebral en las serpientes que trepan, además de otros animales que se levantan. Según todos estos estudios en humanos y otros vertebrados, las anastomosis entre las porciones craneales y vertebrales del CSVS parecen servir un papel fundamental a la hora de proporcionar control homeostático de la presión sanguínea al sistema venoso intracraneal, según sean los cambios en la postura.
Flujo venoso retrógrado y bidireccional en el CSVS
“...un vasto sistema intercomunicativo de venas que, según las infecciones anatómicas, los experimentos en animales, y la simple lógica, constituye de modo constante y fisiológico un lugar de frecuente retroceso del flujo. Durante dichos retrocesos existe una vía que sube y baja por la espalda, que no afecta ni al corazón ni a los pulmones”. Batson [2] “El sistema venoso vertebral nos lo proporciona la Naturaleza para equilibrar la presión sanguínea, redistribuir la sangre y, cuando surgen situaciones patológicas de cualquiera de las dos venas cavas, actuar como una vía alternativa para la continuación de la circulación...debemos reconocer que el sistema venoso consta de cinco estratos, de los cuales los dos principales son los sistemas caval y vertebral... Quisiera llamar la atención sobre la acumulación de venas vertebrales ... Dentro y fuera de este flujo fluye la sangre, similar al modo en que se describía antes en el sentido de ‘flujo y reflujo’”. Herlihy [1]
“...debido a la ausencia de válvulas, el flujo de vuelta procedente del plexo venoso vertebral interno hacia el sistema venoso cerebral discurre bajo condiciones fisiológicas”. Groen [29]
La característica fundamental que distingue el CSVS del sistema venoso sistémico o caval es la falta de válvulas en las venas. En 1940, Batson [2] demostró, mediante una angiografía, que el VVS estaba unido al sistema venoso craneal, y que el flujo podía retroceder del VVS hacia el cerebro gracias a la ausencia de válvulas. De igual modo, los experimentos de Anderson [28] en los humanos demostraron que el contraste que se inyectó dentro del VVS llegaba a los senos venosos intracraneales y a las venas cerebrales internas de manera retrógrada. Al confirmar Groen y su equipo [17] la ausencia de válvulas y la conexión del plexo venoso vertebral con los senos craneales, las venas craneales subcutáneas, las venas intercostales, y el plexo venoso sacral, demostraron “la existencia de una amplia comunicación del sistema venoso vertebral con las venas intracraneales, intratorácicas e intraabdominales”. Posteriormente, los estudios angiográficos de Lasjaunias y Barenstein [23] verificaron el flujo retrógrado hacia las venas radiculares, y mostraron la posibilidad de que el flujo retrógrado discurriera hacia la raíz del sistema nervioso, la espina dorsal y los grupos vertebrales.
Según el modelo matemático de Gisolf [38], también se podía anticipar que gracias al aumento en la presión sanguínea del sistema venoso central, el flujo sanguíneo en las venas discurriría de la parte posterior o caudal al cráneo a través del VVS, que es exactamente lo que Batson [2,13] había postulado más de medio siglo antes. Por lo tanto, el flujo retrógrado y bidireccional es una característica inherente de todos los elementos del CSVS, debido a la carencia de válvulas en las venas.
La posibilidad de que el flujo sea retrógrado y bidireccional es una distinción fundamental entre el CSVS y el sistema venoso sistémico, y es de tal importancia que Herlihy [1] dividió los sistemas venosos del cuerpo humano en dos partes principales, siendo una de ellas la estructura aquí conocida como CSVS. La distinción enfatiza el hecho de que el CSVS es un sistema venoso en el que el flujo puede ser bidireccional, pero no para devolver la sangre al corazón, característica que es esencial a sus funciones fisiológicas tanto en un estado saludable como patológico.
La bidireccionalidad es un concepto esencial que se opone a la noción prevalente de que el sistema circulatorio es circular y unidireccional. Fue Andrea Cesalpino (1519-1603) quien, antes de Harvey, describió la moción circular de la sangre por en el circuito sistémico, y que Harvey corroboró en 1628 con su estudio seminal de Motu Cordis . [15] En este estudio, Harvey describe la importancia que las válvulas venosas tienen al permitir el flujo de la sangre venoso en el sistema caval solo en la dirección del corazón, y afirmó que “la sangre en los animales discurre continuamente en un círculo”. Esta última afirmación, tan precisa al describir el flujo sanguíneo en la circulación sistémica, es esencialmente errónea por lo referente al CSVS, que en vez de formar parte del sistema circular, unidireccional del circuito cava aórtico es, tal y como Helihy [1] lo afirma, un sistema “de flujo y reflujo” que es predominantemente lineal y bidireccional.
La afirmación sobre el flujo y el reflujo explica muchos aspectos tales como la enorme e inusual capacidad del sistema venoso (200- 1000ml); [1,2,37] Por contraste, el volumen total del CSF es 150 ml [48]); la inexistencia de válvulas; las variaciones en el flujo dentro del sistema con los cambios en las posturas; [19-21,26,37,38,41-46] y la posibilidad de que células tumorales, las embolias, y las infecciones discurran en ambas direcciones por el sistema, tanto hacia el cerebro como saliendo del mismo. Este sistema, carente de válvulas y basado en la relación flujo-reflujo, permite que el CSVS proporcione un control homeostático de la presión sanguínea para la circulación cerebral, ya que el CSVS funciona, tal y como Batson [9,12,14] y Epstein su equipo [20] lo describieron, como un “lago venoso” de gran capacidad, del que puede salir o entrar la sangre desde o en el cerebro, según las variaciones en la postura y la presión dentro de la caja torácica y el abdomen.
El sistema venoso: un sistema único, bidireccional, carente de válvulas, y que conecta el cerebro, los senos cavernosos, los ojos, la espina dorsal, la médula espinal y la pelvis
Históricamente, solo se han identificado dos porciones de todo el CSVS. Por ejemplo, se reconoce ampliamente que las venas prostáticas se conectan directamente con el VVS, lo que proporciona una vía anatómica para la propagación del carcinoma de la próstata en la espina dorsal. [49-51] No obstante, tal y como lo explica Parkinson [34,35], generalmente no se acepta que el seno cavernoso y los vasos orbitales dentro del mismo estén conectados con el VVS. El CSVS proporciona una ruta anatómica directa de la pelvis a los ojos y el cerebro, y viceversa, una ruta con numerosos anastomosis a la circulación sistémica de las venas, que incluye la circulación venoso de los pulmones, las venas renales(más concretamente la vena renal siniestra [1]), y las venas de los senos. [2,14,52] Por lo tanto, es razonable conceptualizar que el CSVS es un sistema venoso carente de válvulas que conecta los ojos, el cerebro, la espina dorsal y la pelvis con los enlaces a las venas subcutáneas de la cara, el espacio periespinal y la musculatura de la espina dorsal.
Correlaciones clínicas
A parte de la evidencia clínica, que incluye los moldes de corrosión, los estudios fluroscópicos y de las inyecciones radiográficas, los estudios de ultrasonido, angiografías, las TC, y las IRM, existe evidencia adicional y experimental que apoya los conceptos previamente debatidos con respecto al CSVS. Dicha evidencia se encuentra en 3 áreas predominantes: los patrones de metástasis, de infecciones y de embolización.
El CSVS como ruta para facilitar la metástasis desde y hacia el cerebro y la espina
“Los practicantes de la medicina y otros patólogos antes se contentaban con proponer que las células tumorosas evitaban de algún modo la función filtrante de los capilares pulmonares, y por lo tanto entraban en la circulación sistémica de las arterias. Hay que reconocer que tal explicación no tomaba en cuenta la ausencia de lesiones pulmonares obvias, ni el hecho de que hubiera solamente un brote de metástasis y que el mismo estuviera en un lugar inesperado. Fue precisamente Batson quien llegara a resolver dicho enigma cuando descubrió la estructura y la función del sistema venoso vertebral”. Hussey [53]
“Podía apreciar que, dentro de las venas vertebrales y las comunicaciones dentro de la pelvis, había un paralelismo con el patrón de distribución del carcinoma metastásico de la próstata. Los patólogos se empezaron a dar cuenta de que la metástasis podía originarse por las venas. Dichas venas proporcionaban el único patrón anatómico que coincidía con la distribución de las metástasis de la próstata”. Batson [12] El CSVS proporciona una ruta directa anatómica entre el cerebro, los ojos, la espina dorsal y los órganos pélvicos. Los patrones de la metástasis proporcionan evidencia adicional sobre el flujo retrógrado dentro del CSVS, y sobre la comunicación libre entre todos los elementos del CSVS, incluidos el cerebro, las venas faciales, los senos cavernosos, las venas oftálmicas y la espina dorsal.
La metástasis en dirección retrógrada craneal a través del CSVS
Nishijima y su equipo [49] inyectaron una suspensión de células tumorosas en las venas de la cola de ratones con oclusión de la vena caval, lo que ocasionó el crecimiento de un tumor metastásico reproductible en la región lumbar de la columna vertebral. Por entonces, los investigadores atribuyeron la metástasis al paso de las células tumorales a través del VVS. [50] En general, el 90% de las metástasis cancerígenas de la próstata se han atribuido directamente al pasaje por el VVS a la espina lumbar [51,54,55] Por otra parte, se ha identificado la metástasis del cáncer de próstata a la base del cráneo y el cerebro, probablemente a través del VVS; del mismo modo la propagación leptomeningea es bien conocida [55].
Existen otros ejemplos de posible propagación de las células tumorales en la dirección craneal retrógrada dentro del CSVS, incluido un informe de Ryan y su equipo, [52] quienes describieron la metástasis al seno cavernoso como una presentación preliminar del un carcinoma metastásico del pecho. El caso de un melanoma maligno que se propagaba al seno etmoidal [56] puede ilustrar la anastomosis libre entre el CSVS y los plexos venosos de la nariz y los senos nasales que Batson demostró anteriormente [11]. Raumond y Balaa [57] describieron a un paciente que presentaba una masa cerebral que se revelaba mediante biopsia como un tumor carcinoide ileal, sin que hubiera evidencia de metástasis ósea, pulmonar o hepática, y que sugería que la metástasis se había extendido mediante a través del CSVS. Isaka y su equipo [58] informaron sobre la existencia de un carcinoma neuroendocrino de células pequeñas en una metástasis de la vejiga al lóbulo frontal izquierdo. Sakata y su equipo [59] informaron sobre 7 casos de metástasis cerebral proveniente de carcinomas del esófago, todos sin evidencia de participación pulmonar, y siendo CSVS una posible ruta para la metástasis.
La metástasis y la dirección anterógrada a través del CSVS
Las células tumorales también pueden transmitirse mediante el CSVS en la dirección caudal, o anterógrada. Por ejemplo, recientemente Zhu y su equipo [60] han identificado una metástasis en la equina cauda y el seno cavernoso de un carcinoma de células escamosas en la cara. Durante un período de 5 años, el paciente desarrolló neuropatías trigéminas sucesivas, síndrome del seno cavernoso derecho, parálisis facial derecha e izquierda, seguido de debilitamiento de las extremidades inferiores en el lado izquierdo. Las IRM confirmaron una metástasis del seno cavernoso, orbital y la cauda equina, mientras que la biopsia de la masa del seno cavernoso confirmó el carcinoma metastásico de las células escamosas. Zorlu y su equipo [61] identificaron metástasis en la dermatofibrosarcoma protuberans de la frente al seno cavernoso. Ambos casos corresponden a la propagación anterógrada del tumor a través de las venas faciales al seno cavernoso y después al CSVS. Rochkind y su equipo [62] escribieron sobre una serie sucesiva de 30 pacientes con metástasis extracraneal a partir de un meduloblastoma con revisión literaria*, y documentaron un índice de 7,1%, siendo el hueso el lugar más frecuente para la metástasis (77%). Debatieron las posibles rutas de la metástasis, incluida la invasión de tumores de las venas durales, y expusieron 2 casos de metástasis intramedular en la médula espinal. Más recientemente, Barai y su equipo [63] presentaron el caso de un hombre de 21 años con dolor en la cadera y en la parte inferior de la espalda, y con un historial de 3 meses con dificultades para caminar. Las IRM del cerebro revelaron un meduloblastoma cerebral, que se confirmó con una biopsia cerebral. La IRM de la espina lumbar y la cadera desveló una metástasis de todas las vértebras lumbares y de ambas caderas, y una biopsia basada en una TC de las vertebras L3 mostró un meduloblastoma metastásico*. [63] También recientemente, Rajagopalan y su equipo [64]describieron un glioblastoma multiforme del cerebro, que se propagó a la médula ósea de la espina lumbar.
La carcinomatosis leptomeningea y el CSVS
La extensión hematogénea es probablemente el mecanismo más conocido que subyace el desarrollo de las metástasis leptomeningea, bien sea mediante el sedimento arterial o por acceso hematógeno venoso a través del CSVS. [65] Como Batson lo describiera inicialmente, [2] los tumores pélvicos pueden alcanzar el CSVS mediante el plexo venoso pélvico, que carece de válvulas, y que se anastomiza libremente con el VVS. Tal mecanismo podría explicar la ruta de la metástasis en algunos casos de carcinomatosis de la meninge que se originan a partir de tumores intrapélvicos, incluidos el cáncer cervical [66-69] y el de vejiga. [58,70-72] Sugimori y su equipo [73] identificaron un caso de metástasis leptomeningea proveniente de un adenocarcinoma de la vejiga, con metástasis en el girus frontal medio derecho, el girus temporal superior y los lóbulos parietales y frontales.
La metástasis de la médula espinal interna y el CSVS
Se ha identificado casos de metástasis de la médula espinal interna proveniente de carcinomas del pulmón y del pecho, melanomas, carcinomas de las células renales, tumores colorrectales, carcinomas cervicales, linfomas y carcinomas de los ovarios [74]. Van der Kuip y su equipo [75] demostraron que el reflux venosos dentro del VVS es un fenómeno fisiológico, por lo que la metástasis en la médula espinal puede expandirse a través del CSVS, con probabilidad de que sea gracias al flujo retrógrado (reflejo venoso) que penetra las venas intraespinales. La metástasis concurrente del cerebro y en la médula espinal interna, como se identificó a partir del carcinoma del pecho, [76] puede explicarse a partir de la expansión del tumor a través del CSVS. Existen otros muchos casos de metástasis de tumores que pueden representar ocurrencias de células tumorosas transportadas mediante el CSVS [77-91].
Transmisión de las infecciones mediante el sistema venoso carente de válvulas
Batson [12] mencionó la posibilidad de que las infecciones pudieran diseminarse a través del CSVS. Tras una intervención quirúrgica en la próstata, la osteomielitis vertebral pude originarse por la transmisión de la infección a través del CSVS. [92,93] La sinusitis bacterial se puede extender al CSVS mediante el seno cavernoso y después entrar en el cráneo, ocasionando meningitis, empiema bajo la duramadre, absceso intracerebral, abscesos epidurales, o trombosis del seno sagital superior. [94-98] Frecuentemente, la trombosis séptica de los senos venosos durales incluye los senos cavernosos. [99] Se ha reconocido que las infecciones cutáneas alrededor de los dientes, en la cavidad oral o en la órbita se extienden al seno cavernoso. [100-107] Tales pacientes pueden presentar diplopia u otros síntomas de neuropatía craneal. [108] Los abscesos al cerebro pueden extenderse de una fuente espinal o de otra fuente remota. [109] Las infecciones parásitas que están lejos de la cabeza y el cuello pueden también extenderse al cerebro mediante el CSVS, incluidas la esquitosomiasis y la esparganosis. [110,111]
La embolización a través del CSVS
Las embolias del aire, infecciones o coágulos pueden transmitirse al cerebro desde la espina dorsal o la pelvis a través del CSVS. [112,113] El embolismo aéreo cerebral de origen venoso puede tener consecuencias devastadoras. Tales complicaciones pueden surgir en ausencia de defectos septales intracardiacos, y pueden ser un peligro notable en los procedimientos neuroquirúrgicos que se lleven a cabo cuando el paciente está sentado. [114,116] El embolismo venoso vertebral se ha identificado como una complicación de la colonoscopia [117] y puede surgir tras la intervención quirúrgica en la espina. [118-120] La irrigación intraoperativa de los lugares quirúrgicos de la espina dorsal con peróxido de hidrógeno puede ser particularmente peligrosa debido al embolismo aéreo venoso que se propaga a través del CSVS. [121,122] Algunas complicaciones de la vetebroplastia percutánea y la kifoplasita pueden surgir debido a una cementización de la embolia a través del CSVS, [29] incluidas las embolias de cementización cerebral, [29] cementización pulmonar, [123] y varios dolores y ciática ocasionados por la extrusión de cemento al canal de la espina. [124] Además, las embolias intracraneales y pulmonares durante la hemiaroplatia de la cadera pueden propagarse mediante el CSVS. [125]
Conclusión
El CSVS discurre desde la cabeza a la pelvis y consta de un grupo de venas y plexos venosos que se comunican libremente gracias a la inexistencia de válvulas. La primera de dos divisiones de este sistema, conocidas como las venas intracraneales, comprenden las venas corticales, los senos durales, los senos cavernosos y las venas oftálmicas. La segunda división principal, el VVS, incluye los plexos venosos vertebrales, que discurren por toda la longitud de la espina dorsal. Las venas intracraneales se anastomizan con el VVS en la región suboccipital.
Caudalmente, el CSVS se comunica libremente con las venas sacrales y pélvicas, así como con el plexo venoso prostático. El CSVS constituye un sistema venoso carente de válvulas, único y de gran capacidad, en el que el flujo es bidireccional. También tiene un papel importante en la regulación de la presión intracraneal que cambia según la postura, y la circulación venosa desde el cerebro. Por otra parte, el CSVS proporciona una ruta directa vascular para la propagación de los tumores, las infecciones o las embolias entre los diferentes componentes de cada dirección. Los neurólogos, neurocirujanos, los cirujanos de la espina dorsal y los oncólogos en particular, tienen la responsabilidad de conocer profundamente el CSVS.
831
References
- Herlihy WF. Revision of the venous system: the role of the vertebral veins. Med J Aust. 1947;1:661-672.
- Batson OV. The function of the vertebral veins and their role in the spread of metastases. Ann Surg. 1940;112:138-149.
- Brescet G. Recherches anatomiques physiologiques et pathologiques sur le systaeme veineux. Paris, France: Rouen fraeres; 1829.
- Clemens HJ. Die Venensysteme der menschlichen Wirbseaule; Morphologie und funktionelle Bedeutung. Berlin, Germany: De Gruyter; 1961.
- Dilenge D, Perey B. An angiographic study of the meningorachidian venous system. Radiology. 1973;108:333-337.
- Vogelsang H. Intraosseous Spinal Venography. Amsterdam, The Netherlands: Excerpta Medica; 1970.
- Braun JP, Tournade A. Venous drainage in the craniocervical region. Neuroradiology. 1977;13:155-158.
- Batson OV. The vertebral vein system as a mechanism for the spread of metastases. Am J Roentgenol Radium Ther. 1942;48: 715-718.
- Batson OV. The role of the vertebral veins in metastatic processes. Ann Intern Med. 1942;16:38-45.
- Batson OV. The venous networks of the nasal mucosa. Ann Otol Rhinol Laryngol. 1954;63:571-580.
- Batson OV. The vertebral vein system. Caldwell lecture, 1956. Am J Roentgenol Radium Ther Nucl Med. 1957;78:195-212.
- Batson OV. The Valsalva maneuver and the vertebral vein system. Angiology. 1960;11:443-447.
- Batson OV. The vertebral system of veins as a means for cancer dissemination. Prog Clin Cancer. 1967;3:1-18.
- Harvey W. Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus. 1628.
- Breschet G. Plate 5. In: Recherches anatomiques physiologiques et pathologiques sur le systaeme veineux. Paris, France: Rouen fraeres; 1829.
- Groen RJ, Groenewegen HJ, van Alphen HA, et al. Morphology of the human internal vertebral venous plexus: a cadaver study after intravenous Araldite CY 221 injection. Anat Rec. 1997;249:285-294.
- Arnautovic KI, al-Mefty O, Pait TG, et al. The suboccipital cavernous sinus. J Neurosurg. 1997;86:252-262.
- Eckenhoff JE. The physiologic significance of the vertebral venous plexus. Surg Gynecol Obstet. 1970;131:72-78.
- Epstein HM, Linde HW, Crampton AR, et al. The vertebral venous plexus as a major cerebral venous outflow tract. Anesthesiology. 1970;32:332-337.
- Eckenhoff JE. The vertebral venous plexus. Can Anaesth Soc J. 1971;18:487- 495.
- Meijenhorst GC. Lumbar epidural double-catheter venography with metrizamide (Amipaque). Diagn Imaging.1979;48:244-252.
- Lasjaunias PL, Berenstein A. Surgical Neuroangiography. Berlin, Germany: Springer-Verlag; 1987.
- Takahashi M, Sakamoto Y, Miyawaki M, et al. MR visualization and clinical significance of the anterior longitudinal epidural venous plexus in cervical extraaxial lesions. Comput Med Imaging Graph. 1988;12:169-175.
- Caruso RD, Rosenbaum AE, Chang JK, et al. Craniocervical junction venous anatomy on enhanced MR images: the suboccipital cavernous sinus. AJNR Am J Neuroradiol. 1999;20:1127-1131.
- San Millan Ruiz D, Gailloud P, Rufenacht DA, et al. The craniocervical venous system in relation to cerebral venous drainage. AJNR Am J Neuroradiol. 2002;23:1500-1508.
- Morikawa M, Sato S, Numaguchi Y, et al. Spinal epidural venous plexus: its MR enhancement patterns and their clinical significance. Radiat Med. 1996;14:221- 227.
- Anderson R. Diodrast studies of the vertebral and cranial venous systems to show their probable role in cerebral metastases. J Neurosurg. 1951;8:411 -422.
- Groen RJ, du Toit DF, Phillips FM, et al. Anatomical and pathological considerations in percutaneous vertebroplasty and kyphoplasty: a reappraisal of the vertebral venous system. Spine. 2004;29:1465-1471.
- Netter F. A compilation of paintings on the normal and pathologic anatomy of the nervous system. Netter (Ciba) Collection of Medical Illustrations. Vol. 1. CIBA; 1953.
- Takahashi S, Sakuma I, Omachi K, et al. Craniocervical junction venous anatomy around the suboccipital cavernous sinus: evaluation by MR imaging. Eur Radiol. 2005;15:1694-1700.
- Zouaoui A, Hidden G. The cervical vertebral venous plexus and anastomoses with the cranial venous sinuses [in French]. Bull Assoc Anat (Nancy). 1987;71:7- 13.
- Osborn AGO. Craniofacial venous plexuses: angiographic study. AJR Am J Roentgenol. 1981;136:139-143.
- Parkinson D. Extradural neural axis compartment. J Neurosurg. 2000;92:585- 588.
- Parkinson D. History of the extradural neural axis compartment. Surg Neurol. 2000;54:422-431.
- Zenker W, Kubik S. Brain cooling in humans -- anatomical considerations. Anat Embryol (Berl). 1996;193:1 -13.
- Schaller B. Physiology of cerebral venous blood flow: from experimental data in animals to normal function in humans. Brain Res Brain Res Rev. 2004;46:243- 260.
- Gisolf J, van Lieshout JJ, van Heusden K, et al. Human cerebral venous outflow pathway depends on posture and central venous pressure. J Physiol. 2004;560(pt1):317-327.
- Toung TJ, Aizawa H, Traystman RJ. Effects of positive end-expiratory pressure ventilation on cerebral venous pressure with head elevation in dogs. J Appl Physiol. 2000;88:655-661.
- Eckenhoff JE. Circulatory control in the surgical patient. Ann R Coll Surg Engl. 1966;39:67-83.
- Doepp F, Schreiber SJ, von Munster T, et al. How does the blood leave the brain? A systematic ultrasound analysis of cerebral venous drainage patterns. Neuroradiology. 2004;46:565-570.
- Grevy V, Escuret E. The cerebral venous outflow tract [in French]. Ann Fr Anesth Reanim. 1998;17:144-148.
- Hoffmann O, Klingebiel R, Braun JS, et al. Diagnostic pitfall: atypical cerebral venous drainage via the vertebral venous system. AJNR Am J Neuroradiol. 2002;23:408-411.
- Hoffmann O, Weih M, von Munster T, et al. Blood flow velocities in the vertebral veins of healthy subjects: a duplex sonographic study. J Neuroimaging. 1999;9:198-200.
- Valdueza JM, von Munster T, Hoffman O, et al. Postural dependency of the cerebral venous outflow. Lancet.2000;355:200-201.
- Schreiber SJ, Lurtzing F, Gotze R, et al. Extrajugular pathways of human cerebral venous blood drainage assessed by duplex ultrasound. J Appl Physiol. 2003;94:1802-1805.
- Zippel KC, Lillywhite HB, Mladinich CR. New vascular system in reptiles: anatomy and postural hemodynamics of the vertebral venous plexus in snakes. J Morphol. 2001;250:173-184.
- Hocking G, Wildsmith JA. Intrathecal drug spread. Br J Anaesth. 2004;93:568- 578.
- Nishijima Y, Uchida K, Koiso K, et al. Clinical significance of the vertebral vein in prostate cancer metastasis. Adv Exp Med Biol. 1992;324:93-100.
- Nishijima Y, Koiso K, Nemoto R. The role of the vertebral veins in the dissemination of prostate carcinoma [in Japanese]. Nippon Hinyokika Gakkai Zasshi. 1995;86:927-932.
- Geldof AA. Models for cancer skeletal metastasis: a reappraisal of Batson’s plexus. Anticancer Res. 1997;17:1535-1539.
- Ryan MW, Rassekh CH, Chaljub G. Metastatic breast carcinoma presenting as cavernous sinus syndrome. Ann Otol Rhinol Laryngol. 1996;105:666-668.
- Hussey HH. Editorial: the vertebral venous system. JAMA. 1976;235:2524.
- Bubendorf L, Schopfer A, Wagner U, et al. Metastatic patterns of prostate cancer: an autopsy study of 1,589 patients. Hum Pathol. 2000;31:578-583.
- Benjamin R. Neurologic complications of prostate cancer. Am Fam Physician. 2002;65:1834-1840.
- Bizon JG, Newman RK. Metastatic melanoma to the ethmoid sinus. Arch Otolaryngol Head Neck Surg. 1986;112:664-667.
- Raymond PL, Balaa MA. Diplopia and diarrhea: ileal carcinoid metastatic to the central nervous system. Am J Gastroenterol. 1992;87:240-243.
- Isaka T, Maruno M, Sato M, et al. Brain metastasis from small-cell neuroendocrine carcinoma of the urinary bladder: a case report. Brain Tumor Pathol. 2002;19:117-122.
- Sakata R, Ohiwa Y, Shinmura F, et al. Intracerebral metastasis of esophageal carcinoma-- a case report and review of literature [in Japanese]. No Shinkei Geka. 1985;13:647-651.
- Zhu JJ, Padillo O, Duff J, et al. Cavernous sinus and leptomeningeal metastases arising from a squamous cell carcinoma of the face: case report. Neurosurgery. 2004;54:492-498.
- Zorlu F, Yildiz F, Ertoy D, et al. Dermatofibrosarcoma protuberans metastasizing to cavernous sinuses and lungs: a case report. Jpn J Clin Oncol. 2001;31:557- 561.
- Rochkind S, Blatt I, Sadeh M, et al. Extracranial metastases of medulloblastoma in adults: literature review. J Neurol Neurosurg Psychiatry. 1991;54:80-86.
- Barai S, Bandopadhayaya GP, Julka PK, et al. Cerebellar medulloblastoma presenting with skeletal metastasis. J Postgrad Med. 2004;50:110-112.
- Rajagopalan V, Kamar FG, Thayaparan R, et al. Bone marrow metastases from glioblastoma multiforme -- a case report and review of the literature. J Neurooncol. 2005;72:157-161.
- Maroldi R, Ambrosi C, Farina D. Metastatic disease of the brain: extra-axial metastases (skull, dura, leptomeningeal) and tumour spread. Eur Radiol. 2005;15:617-626.
- Aboulafia DM, Taylor LP, Crane RD, et al. Carcinomatous meningitis complicating cervical cancer: a clinicopathologic study and literature review. Gynecol Oncol. 1996;60:313-318.
- Weithman AM, Morrison G, Ingram EA. Meningeal metastasis of squamouscell carcinoma of the uterine cervix: case report and review of the literature. Diagn Cytopathol. 1987;3:170-172.
- Kumar S, Nair S, Alexander M. Carcinomatous meningitis occurring prior to a diagnosis of large cell neuroendocrine carcinoma of the uterine cervix. J Postgrad Med. 2004;50:311-312.
- Wuntkal R, Maheshwari A, Kerkar RA, et al. Carcinoma of uterine cervix primarily presenting as carcinomatous meningitis: a case report. Aust N Z J Obstet Gynaecol. 2004;44:268-269.
- Bruna J, Rojas-Marcos I, Martinez-Yelamos S, et al. Meningeal carcinomatosis as the first manifestation of a transitional cell carcinoma of the bladder. J Neurooncol. 2003;63:63-67.
- Cozzarini C, Reni M, Mangili F, et al. Meningeal carcinomatosis from transitional cell carcinoma of the bladder: report of two cases and review of the literature. Cancer Invest. 1999;17:402-407.
- Juan Vidal O, de Paz Arias L, Catala Barcelo J, et al. Meningeal carcinomatosis as first manifestation of carcinoma of the bladder: report of 2 cases [in Spanish]. An Med Interna. 2000;17:425-428.
- Sugimori K, Kobayashi K, Hayashi M, et al. Leptomeningeal carcinomatosis from urinary bladder adenocarcinoma: a clinicopathological case study. Neuropathology. 2005;25:89-94.
- Rastelli F, Benedetti G, Di Tommaso L, et al. Intramedullary spinal metastasis from ovarian cancer. Lancet Oncol. 2005;6:123-125.
- van der Kuip M, Hoogland PV, Groen RJ. Human radicular veins: regulation of venous reflux in the absence of valves. Anat Rec. 1999;254:173-180.
- Kosmas C, Koumpou M, Nikolaou M, et al. Intramedullary spinal cord metastases in breast cancer: report of four cases and review of the literature. J Neurooncol. 2005;71:67-72.
- Queiroz Lde S, Facure NO, Facure JJ, et al. Pituitary carcinoma with liver metastases and Cushing syndrome. Report of a case. Arch Pathol. 1975;99:32-35.
- Castaldo JE, Bernat JL, Meier FA, et al. Intracranial metastases due to prostatic carcinoma. Cancer. 1983;52:1739-1747.
- Reynard M, Brinkley JR Jr. Cavernous sinus syndrome caused by rhabdomyosarcoma. Ann Ophthalmol. 1983;15:94-97.
- Post MJ, Mendez DR, Kline LB, et al. Metastatic disease to the cavernous sinus: clinical syndrome and CT diagnosis. J Comput Assist Tomogr. 1985;9:115-120.
- Merimsky O, Inbar M, Groswasser-Reider I, et al. Sphenoid and cavernous sinuses involvement as first site of metastasis from a fallopian tube carcinoma. Case report. Tumori. 1993;79:444-446.
- Agarwal P, Sharma K, Gupta RK, et al. Acute bilateral ophthalmoplegia secondary to metastatic prostatic carcinoma. Demonstration on magnetic resonance imaging. J Neuroophthalmol. 1995;15:45-47.
- Aung TH, Po YC, Wong WK. Hepatocellular carcinoma with metastasis to the skull base, pituitary gland, sphenoid sinus, and cavernous sinus. Hong Kong Med J. 2002;8:48-51.
- Kalcioglu MT, Oncel S, Miman MC, et al. A case of Ewing’s sarcoma in the mandible and the skull base. Kulak Burun Bogaz Ihtis Derg. 2003;11:144-147.
- Akiyama K, Numaga J, Kagaya F, et al. Case of optic nerve involvement in metastasis of a gastrointestinal stromal tumor. Jpn J Ophthalmol. 2004;48:166-168.
- Fassett DR, Couldwell WT. Metastases to the pituitary gland. Neurosurg Focus. 2004;16:E8.
- Harkness KA, Manford MR. Metastatic malignant melanoma presenting as a cavernous sinus syndrome. J Neurol. 2004;251:224-225.
- Kokkoris CP. Leptomeningeal carcinomatosis. How does cancer reach the pia-arachnoid? Cancer. 1983;51:154-160.
- Sgouras ND, Gamatsi IE, Porfyris EA, et al. An unusual presentation of a metastatic hypernephroma to the frontonasal region. Ann Plast Surg. 1995;34:653- 656.
- Shuto T, Fujino H, Inomori S, et al. Glioblastoma multiforme with liver metastasis -- case report [in Japanese]. No To Shinkei. 1995;47:772-777.
- Fuentes S, Metellus P, Bouvier C, et al. Metastatic meningioma to the first thoracic vertebral body. A case report and review of the literature [in French]. Neurochirurgie. 2002;48:53-56.
- De Feo E. Osteomyelitis of the spine following prostatic surgery. Radiology. 1954;62:396-401.
- Liming RW, Youngs FJ. Metastatic vertebral osteomyelitis following prostatic surgery. Radiology. 1956;67:92-94.
- Younis RT, Lazar RH, Anand VK. Intracranial complications of sinusitis: a 15- year review of 39 cases. Ear Nose Throat J. 2002;81:636-638, 640-642, 644.
- Durand B, Poje C, Dias M. Sinusitis-associated epidural abscess presenting as posterior scalp abscess -- a case report. Int J Pediatr Otorhinolaryngol. 1998;43:147-151.
- Jones NS, Walker JL, Bassi S, et al. The intracranial complications of rhinosinusitis: can they be prevented? Laryngoscope. 2002;112:59-63.
- Eustis HS, Mafee MF, Walton C, et al. MR imaging and CT of orbital infections and complications in acute rhinosinusitis. Radiol Clin North Am. 1998;36:1165- 1183, xi.
- Fountas KN, Duwayri Y, Kapsalaki E, et al. Epidural intracranial abscess as a complication of frontal sinusitis: case report and review of the literature. South Med J. 2004;97:279-282; quiz 283.
- Southwick FS, Richardson, EP Jr, Swartz MN. Septic thrombosis of the dural venous sinuses. Medicine (Baltimore). 1986;65:82-106.
- Sanchez TG, Cahali MB, Murakami MS, et al. Septic thrombosis of orbital vessels due to cutaneous nasal infection. Am J Rhinol. 1997;11:429-433.
- Fiandaca MS, Spector RH, Hartmann TM, et al. Unilateral septic cavernous sinus thrombosis. A case report with digital orbital venographic documentation. J Clin Neuroophthalmol. 1986;6:35-38.
- Martin-Hirsch DP, Habashi S, Hinton AH, et al. Orbital cellulitis. Arch Emerg Med. 1992;9:143-148.
- Harbour RC, Trobe JD, Ballinger WE. Septic cavernous sinus thrombosis associated with gingivitis and parapharyngeal abscess. Arch Ophthalmol. 1984;102:94-97.
- Hytonen M, Atula T, Pitkaranta A. Complications of acute sinusitis in children. Acta Otolaryngol Suppl. 2000;543:154-157.
- de-Vicente-Rodriguez JC. Maxillofacial cellulitis. Med Oral Patol Oral Cir Bucal. 2004;9(suppl):133-138; 126-133.
- Jimenez Y, Bagan JV, Murillo J, et al. Odontogenic infections. Complications. Systemic manifestations. Med Oral Patol Oral Cir Bucal. 2004;9(suppl):143-147; 139-143.
- Tovilla-Canales JL, Nava A, Tovilla y Pomar JL. Orbital and periorbital infections. Curr Opin Ophthalmol. 2001;12:335-341.
- Weisberger EC, Dedo HH. Cranial neuropathies in sinus disease. Laryngoscope. 1977;87:357-363.
- Theophilo F, et al. Brain abscess in childhood. Childs Nerv Syst. 1985;1:324- 328.
- Scrimgeour EM, Gajdusek DC. Involvement of the central nervous system in Schistosoma mansoni and S. haematobium infection. A review. Brain. 1985;108(pt4):1023-1038.
- Kudesia S, Indira DB, Sarala D, et al. Sparganosis of brain and spinal cord: unusual tapeworm infestation (report of two cases). Clin Neurol Neurosurg. 1998;100:148-152.
- Wack JP, Dubuque T, Wyatt JP. The role of the vertebral venous plexus in the dissemination of labeled emboli. AMA Arch Pathol. 1958;65:675-680.
- Kuo TH, Lee KS, Lieu AS, et al. Massive intracerebral air embolism associated with meningitis and lumbar spondylitis: case report. Surg Neurol. 2004;62:362- 365; discussion 365.
- Marquez J, Sladen A, Gendell H, et al. Paradoxical cerebral air embolism without an intracardiac septal defect. Case report. J Neurosurg. 1981;55:997-1000.
- Gale T, Leslie K. Anaesthesia for neurosurgery in the sitting position. J Clin Neurosci. 2004;11:693-696.
- Mammoto T, Hayashi Y, Ohnishi Y, et al. Incidence of venous and paradoxical air embolism in neurosurgical patients in the sitting position: detection by transesophageal echocardiography. Acta Anaesthesiol Scand. 1998;42:643-647.
- Chorost MI, Wu JT, Webb H, et al. Vertebral venous air embolism: an unusual complication following colonoscopy: report of a case. Dis Colon Rectum. 2003;46:1138-1140.
- Albin MS. Venous air embolism and lumbar disk surgery. JAMA. 1978;240:1713.
- Albin MS, Ritter RR, Pruett CE, et al. Venous air embolism during lumbar laminectomy in the prone position: report of three cases. Anesth Analg. 1991;73:346-349.
- Wasnick JD, Vassallo SA, Hoffman WJ, et al. Venous air embolism and cervical microdiscectomy. Anesth Analg. 1995;81:1287-1288.
- Despond O, Fiset P. Oxygen venous embolism after the use of hydrogen peroxide during lumbar discectomy. Can J Anaesth. 1997;44:410-413.
- Lopez LM, Traves N, Napal M. Fatal gas embolism during corrective surgery for scoliosis using the posterior approach [in Spanish]. Rev Esp Anestesiol Reanim. 1999;46:267-270.
- Padovani B, Kasriel O, Brunner P, et al. Pulmonary embolism caused by acrylic cement: a rare complication of percutaneous vertebroplasty. AJNR Am J Neuroradiol. 1999;20:375-377.
- Harrington KD. Major neurological complications following percutaneous vertebroplasty with polymethylmethacrylate: a case report. J Bone Joint Surg Am. 2001;83-A:1070-1073.
- Narimatsu E, Kawamata M, Hase M, et al. Severe paradoxical intracranial embolism and pulmonary emboli during hip hemiarthroplasty. Br J Anaesth. 2003;91:911-913.







