Review Article - (2022) Volume 18, Issue 6
Enfermedad Renal Diabetica: Estado del Arte
Michel Pérez Marrugo,
Gabriel Padilla Vega,
Luis Francisco Saray Ricardo,
Jacome,
Emerson García Ballesteros,
Jose Mejía Barrera,
Jorge Saavedra Ruiz and
Alejandro Nuñez Ospino
Residente de medicina interna, universidad libre, Colombia
*Correspondence:
Sivia Calvo Prada, Residente de medicina interna, universidad libre,
Colombia,
Tel: +573242742314,
Email:
Received: 27-May-2022, Manuscript No. ipadm-22-12820;
Editor assigned: 30-May-2022, Pre QC No. ipadm-22-12820(PQ);
Reviewed: 13-Jun-2022, QC No. ipadm-22-12820;
Revised: 21-Jun-2022, Manuscript No. ipadm-22-12820(R);
Published:
28-Jun-2022, DOI: 10.36648/1698-9465.22.18.1544
Abstract
La ERD es una de las complicaciones microvasculares que más impactan en el pronóstico de los pacientes con diabetes mellitus y la principal causa de enfermedad renal terminal. La incidencia de la ERD se ha duplicado en la última década debido al aumento de casos de diabetes tipo 2, En la actualidad se estima que cerca del 25-35 % de quienes son diagnosticados con diabetes tipo 2 ya tienen complicaciones microvasculares. Conocer los aspectos fisiopatológicos involucrados y las nuevas alternativas terapéuticas probablemente se traduzca en una mejor atención y tratamiento adecuado para estos pacientes con disminución en la morbilidad y mortalidad.
Keywords
Diabetes; Enfermedad Renal Crónica; Proteinuria
Diagnóstico
Para el diagnóstico se requiere el antecedente de diabetes
confirmado y establecer la presencia de enfermedad renal, lo
cual se basa en dos parámetros: La TFG y la albuminuria (Figura
2) [34,35].
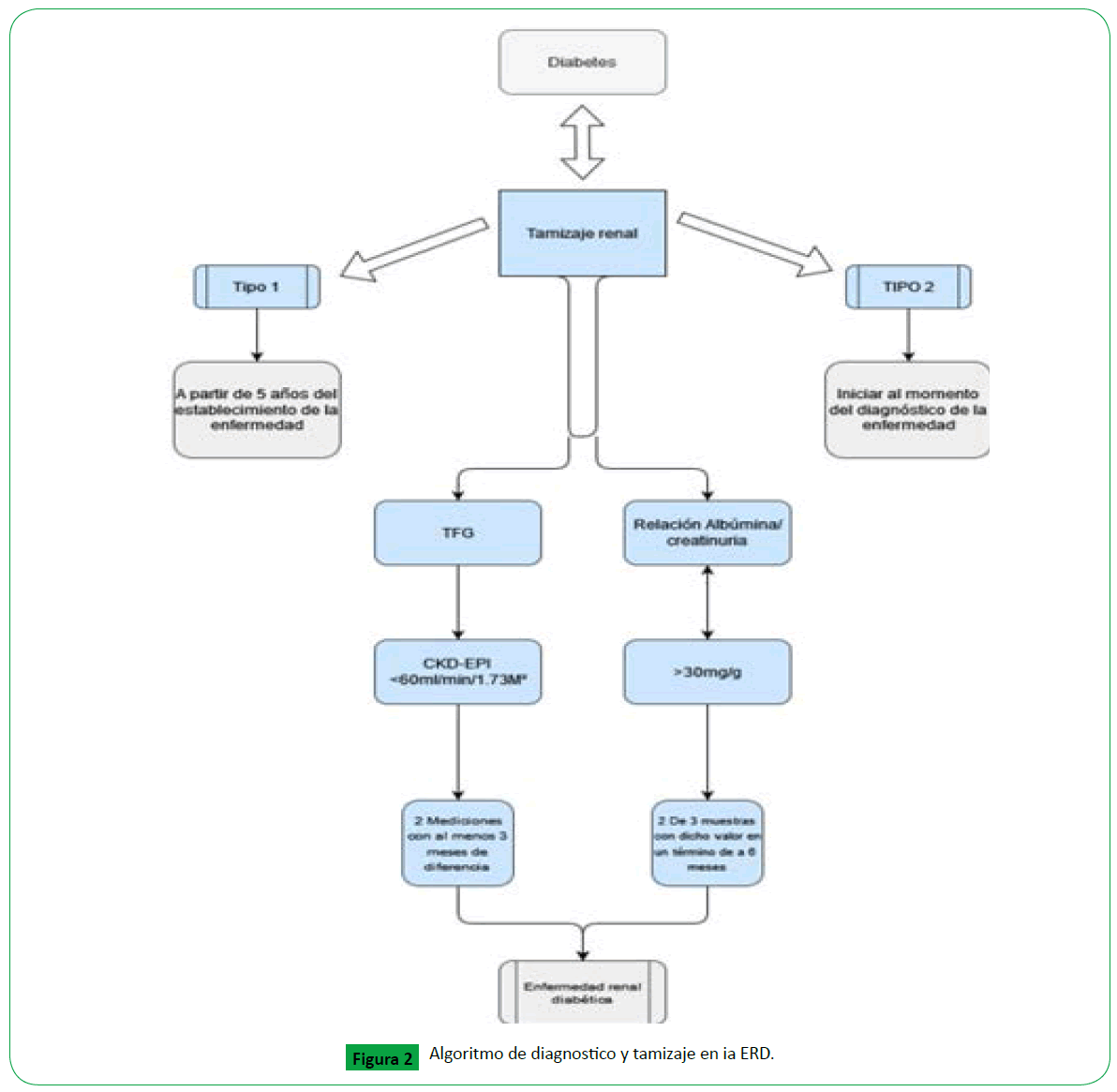
Figura 2. Algoritmo de diagnostico y tamizaje en ia ERD.
Clásicamente la prueba estándar para establecer la albuminuria
como marcador de daño renal ha sido la medición de la excreción
urinaria de albumina de 24 horas, sin embargo, actualmente se
utiliza con mayor frecuencia la relación Albumina-Creatinuria
en una muestra aleatoria de orina, se establece que el rango
significativo es de 30mg/g o superior, dicho valor debe ser
comprobado en al menos 2 de 3 muestras en un periodo de
tiempo de 3 a 6 meses, dado que condiciones fisiológicas como
el ejercicio e hidratación inadecuada, o patológicas como
infecciones del tracto urinario e insuficiencia cardiaca congestiva
podrían transitoriamente alterar dichos valores, derivando en
imprecisiones diagnosticas [34,36,37].
El tamizaje de la albuminuria debe iniciarse al momento del
diagnóstico en diabéticos tipo II y se recomienda a los 5 años
en pacientes con diabetes mellitus tipo I, realizando mediciones
anualmente [38].
La TFG es el otro parámetro para establecer daño renal, la cual
debe ser calculada con las fórmulas validadas a partir del nivel
de creatinina sérica siendo la ecuación del grupo Chronic Kidney
Disease Epidemiology Collaboration (CKD-EPI) la recomendada
actualmente, niveles de TFG persistentemente menores de
60ml/min/1.73 m2 se consideran significativos, para lo cual se
requieren dos mediciones de la TFG con un intervalo de tiempo
de al menos 3 meses [38].
Referencias
- Thomas B. The global burden of diabetic kidney disease: time trends and gender gaps. Curr Diab Rep 2019; 19:1133-6.
Indexed at, Google Scholar, Cross ref
- Umanath K, Lewis JB. Update on diabetic nephropathy: core curriculum 2018.
Am J Kidney Dis 2018; 71:884-95.
Indexed at, Google Scholar, Cross ref
- Vergara Arana A, Martinez Castelao A, Gorriz Teruel JL, de Alvaro Moreno F, Navarro Gonzalez J, Soler Romeo MJ. Enfermedad Renal Diabética: Albuminuria y Progresión.
Google Scholar
- IDF Diabetes Atlas | Tenth Edition.
- Sagoo MK, Gnudi L. Diabetic Nephropathy: An Overview. Methods Mol Biol 2020; 2067:3-7.
Indexed at, Google Scholar, Cross ref
- Alicic RZ, Rooney MT, Tuttle KR. Diabetic Kidney Disease: Challenges, Progress, and Possibilities. Clin J Am Soc Nephrol 2017; 12:2032-45.
Indexed at, Google Scholar, Cross ref
- Kazancioglu R. Risk factors for chronic kidney disease: an update. Kidney Int Suppl 2013; 3:368-71.
Indexed at, Google Scholar, Cross ref
- Caramori ML, Parks A, Mauer M. Renal lesions predict progression of diabetic nephropathy in type 1 diabetes. J Am Soc Nephrol 2013; 24:1175-81.
Indexed at, Google Scholar, Cross ref
- Pohl MA, Blumenthal S, Cordonnier DJ, De Alvaro F, De ferrari G, Eisner G, et al. Independent and additive impact of blood pressure control and angiotensin II receptor blockade on renal outcomes in the irbesartan diabetic nephropathy trial: clinical implications and limitations. J Am Soc Nephrol 2005; 16:3027-37.
Indexed at, Google Scholar, Cross ref
- Navarro Gonzalez J, Mora Fernández C, Martinez Castelao A, Gorriz Teruel JL, Soler Romeo MJ, de Alvaro Moreno F. Enfermedad renal diabética: etiopatogenia y fisiopatología.
- Sugahara M, Pak WLW, Tanaka T, Tang SCW, Nangaku M. Update on diagnosis, pathophysiology, and management of diabetic kidney disease. Nephrology 2021; 26:491-500.
Indexed at, Google Scholar, Cross ref
- Matoba K, Takeda Y, Nagai Y, Yokota T, Utsunomiya K, Nishimura R. Targeting Redox Imbalance as an Approach for Diabetic Kidney Disease. Biomedicines 2020; 8:40.
Indexed at, Google Scholar, Cross ref
- Cheng YS, Chao J, Chen C, Lv LL, Han YC, Liu BC. The PKCß-p66shc-NADPH oxidase pathway plays a crucial role in diabetic nephropathy. J Pharm Pharmacol 2019; 71:338-47.
Indexed at, Google Scholar, Cross ref
- Pérez-Morales GG, Getino-Melián MA, Domínguez-Pimentel V, Navarro-González JF. Inflammation in Diabetic Kidney Disease. Nephron 2019; 143:12-6.
Indexed at, Google Scholar, Cross ref
- Kohan DE, Barton M. Endothelin and Endothelin Antagonists in Chronic Kidney Disease. Kidney Int 2014; 86:896-904.
Indexed at, Google Scholar, Cross ref
- Schneider JG, Tilly N, Hierl T, Sommer U, Hamann A, Dugi K, et al. Elevated plasma endothelin-1 levels in diabetes mellitus. Am J Hypertens 2002; 15:967-72.
Indexed at, Google Scholar, Cross ref
- Palm F, Cederberg J, Hansell P, Liss P, Carlsson PO. Reactive oxygen species cause diabetes-induced decrease in renal oxygen tension. Diabetologia 2003; 46:1153-60.
Indexed at, Google Scholar, Cross ref
- Nangaku M. Chronic hypoxia and tubulointerstitial injury: a final common pathway to end-stage renal failure. J Am Soc Nephrol 2006; 17:17-25.
Indexed at, Google Scholar, Cross ref
- Rosenberger C, Khamaisi M, Abassi Z, Shilo V, Weksler-Zangen S, Goldfarb M, et al. Adaptation to hypoxia in the diabetic rat kidney. Kidney Int 2008; 73:34-42.
Indexed at, Google Scholar, Cross ref
- Navarro-González JF, Mora-Fernández C. The role of inflammatory cytokines in diabetic nephropathy. J Am Soc Nephrol 2008; 19:433-42.
Indexed at, Google Scholar, Cross ref
- Yaribeygi H, Atkin SL, Sahebkar A. Interleukin-18 and diabetic nephropathy: A review. J Cell Physiol 2019; 234:5674-82.
Indexed at, Google Scholar, Cross ref
- Navarro JF, Mora-Fernández C. The role of TNF-alpha in diabetic nephropathy: pathogenic and therapeutic implications. Cytokine Growth Factor Rev 2006; 17:441-50.
Indexed at, Google Scholar, Cross ref
- Chen YL, Qiao YC, Xu Y, Ling W, Pan YH, Huang YC, et al. Serum TNF-a concentrations in type 2 diabetes mellitus patients and diabetic nephropathy patients: A systematic review and meta-analysis. Immunol Lett 2017; 186:52-8.
Indexed at, Google Scholar, Cross ref
- Tang SCW, Yiu WH. Innate immunity in diabetic kidney disease. Nat Rev Nephrol 2020; 16:206-22.
Indexed at, Google Scholar, Cross ref
- Alicic RZ, Johnson EJ, Tuttle KR. Inflammatory Mechanisms as New Biomarkers and Therapeutic Targets for Diabetic Kidney Disease. Adv Chronic Kidney Dis 2018; 25:181-91.
Indexed at, Google Scholar, Cross ref
- Gurley SB, Coffman TM. The renin-angiotensin system and diabetic nephropathy. Semin Nephrol 2007; 27:144-52.
Indexed at, Google Scholar, Cross ref
- Lin YC, Chang YH, Yang SY, Wu KD, Chu TS. Update of pathophysiology and management of diabetic kidney disease. J Formos Med Assoc 2018; 117:662-75.
Indexed at, Google Scholar, Cross ref
- Ritz E, Tomaschitz A. Aldosterone, a vasculotoxic agent--novel functions for an old hormone. Nephrol Dial Transplant 2009; 24:2302-5.
Indexed at, Google Scholar, Cross ref
- Kume S, Koya D. Autophagy: A Novel Therapeutic Target for Diabetic Nephropathy. Diabetes Metab J 2015; 39:451-60.
Indexed at, Google Scholar, Cross ref
- Tagawa A, Yasuda M, Kume S, Yamahara K, Nakazawa J, Chin-Kanasaki M, et al. Impaired Podocyte Autophagy Exacerbates Proteinuria in Diabetic Nephropathy. Diabetes 2016; 65:755-67.
Indexed at, Google Scholar, Cross ref
- Kim WY, Nam SA, Song HC, Ko JS, Park SH, Kim HL, et al. The role of autophagy in unilateral ureteral obstruction rat model. Nephrology (Carlton) 2012; 17:148-59.
Indexed at, Google Scholar, Cross ref
- Kato M, Natarajan R. Diabetic nephropathy--emerging epigenetic mechanisms. Nat Rev Nephrol 2014; 10:517-30. Indexed at, Google Scholar, Cross ref
- Kato M, Natarajan R. Epigenetics and epigenomics in diabetic kidney disease and metabolic memory. Nat Rev Nephrol 2019; 15:327-45.
Indexed at, Google Scholar, Cross ref
- Bonner R, Albajrami O, Hudspeth J, Upadhyay A. Diabetic Kidney Disease. Prim Care 2020; 47:645-59.
Indexed at, Cross ref
- Rico Fontalvo JE. Guía de práctica clínica para la enfermedad renal diabética. Revista Colombiana de Nefrología 2021; 8.
Google Scholar
- Andrassy KM. Comments on KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2013; 84:622-3.
Indexed at, Google Scholar, Cross ref
- American Diabetes Association. 11. Microvascular Complications and Foot Care: Standards of Medical Care in Diabetes-2019. Diabetes Care 2019; 42:S124-38.
Indexed at, Cross ref
- National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 Update. Am J Kidney Dis 2012; 60:850-86.
Indexed at, Google Scholar, Cross ref
- KDIGO 2022. Clinical Practice guideline for diabetes management in chronic kidney disease. 2022.
Google Scholar
- Xia J, Wang L, Ma Z, Zhong L, Wang Y, Gao Y, et al. Cigarette smoking and chronic kidney disease in the general population: a systematic review and meta-analysis of prospective cohort studies. Nephrol Dial Transplant 2017; 32:475-87.
Indexed at, Google Scholar, Cross ref
- Amaral LS de B, Souza CS, Lima HN, Soares T de J. Influence of exercise training on diabetic kidney disease: A brief physiological approach. Exp Biol Med (Maywood) 2020; 245:1142-54.
Indexed at, Google Scholar, Cross ref
- Colberg SR, Sigal RJ, Yardley JE, Riddell MC, Dunstan DW, Dempsey PC, et al. Physical Activity/Exercise and Diabetes: A Position Statement of the American Diabetes Association. Diabetes Care 2016; 39:2065-79.
Indexed at, Google Scholar, Cross ref
- Ko GJ, Kalantar-Zadeh K, Goldstein-Fuchs J, Rhee CM. Dietary Approaches in the Management of Diabetic Patients with Kidney Disease. Nutrients 2017;9:824.
Indexed at, Google Scholar, Cross ref
- Onyenwenyi C, Ricardo AC. Impact of Lifestyle Modification on Diabetic Kidney Disease. Curr Diab Rep 2015; 15:60.
Indexed at, Google Scholar, Cross ref
- Docherty NG, Canney AL, le Roux CW. Weight loss interventions and progression of diabetic kidney disease. Curr Diab Rep 2015; 15:55.
Indexed at, Google Scholar, Cross ref
- Perkovic V, Heerspink HL, Chalmers J, Woodward M, Jun M, Li Q, et al. Intensive glucose control improves kidney outcomes in patients with type 2 diabetes. Kidney Int 2013; 83:517-23.
Indexed at, Google Scholar, Cross ref
- American Diabetes Association. 6. Glycemic Targets: Standards of Medical Care in Diabetes-2018. Diabetes Care 2018; 41:S55-64.
Indexed at, Google Scholar, Cross ref
- Qaseem A, Wilt TJ, Kansagara D, Horwitch C, Barry MJ, Forciea MA. Hemoglobin A1c Targets for Glycemic Control With Pharmacologic Therapy for Nonpregnant Adults With Type 2 Diabetes Mellitus: A Guidance Statement Update From the American College of Physicians. Ann Intern Med 2018; 168:569-76.
Indexed at, Google Scholar, Cross ref
- McGrath K, Edi R. Diabetic Kidney Disease: Diagnosis, Treatment, and Prevention. Am Fam Physician 2019; 99:751-9.
Indexed at
- Kawanami D, Takashi Y, Tanabe M. Significance of Metformin Use in Diabetic Kidney Disease. Int J Mol Sci 2020; 21:E4239.
Indexed at, Google Scholar, Cross ref
- Inzucchi SE, Lipska KJ, Mayo H, Bailey CJ, McGuire DK. Metformin in patients with type 2 diabetes and kidney disease: a systematic review. JAMA 2014; 312:2668-75.
Indexed at, Google Scholar, Cross ref
- Hung SC, Chang YK, Liu JS, Kuo KL, Chen YH, Hsu CC, et al. Metformin use and mortality in patients with advanced chronic kidney disease: national, retrospective, observational, cohort study. Lancet Diabetes Endocrinol 2015; 3:605-14.
Indexed at, Google Scholar, Cross ref
- Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373:2117-28.
Indexed at, Google Scholar, Cross ref
- Fioretto P, Zambon A, Rossato M, Busetto L, Vettor R. SGLT2 Inhibitors and the Diabetic Kidney. Diabetes Care 2016; 39:S165-171.
Indexed at, Google Scholar, Cross ref
- DeFronzo RA, Reeves WB, Awad AS. Pathophysiology of diabetic kidney disease: impact of SGLT2 inhibitors. Nat Rev Nephrol 2021; 17:319-34.
Indexed at, Google Scholar, Cross ref
- Peters AL, Buschur EO, Buse JB, Cohan P, Diner JC, Hirsch IB. Euglycemic Diabetic Ketoacidosis: A Potential Complication of Treatment With Sodium-Glucose Cotransporter 2 Inhibition. Diabetes Care 2015; 38:1687-93.
Indexed at, Google Scholar, Cross ref
- Thong KY, Yadagiri M, Barnes DJ, Morris DS, Chowdhury TA, Chuah LL, et al. Clinical risk factors predicting genital fungal infections with sodium-glucose cotransporter 2 inhibitor treatment: The ABCD nationwide dapagliflozin audit. Prim Care Diabetes 2018; 12:45-50.
Indexed at, Google Scholar, Cross ref
- Perkovic V, Jardine MJ, Neal B, Bompoint S, Heerspink HJL, Charytan DM, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019; 380:2295-306.
Indexed at, Google Scholar, Cross ref
- Heerspink HJL, Stefánsson BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020; 383:1436-46.
Indexed at, Google Scholar, Cross ref
- Lo KB, Gul F, Ram P, Kluger AY, Tecson KM, McCullough PA, et al. The Effects of SGLT2 Inhibitors on Cardiovascular and Renal Outcomes in Diabetic Patients: A Systematic Review and Meta-Analysis. Cardiorenal Med 2020; 10:1-10.
Indexed at, Google Scholar, Cross ref
- Mallik R, Chowdhury TA. Pharmacotherapy to delay the progression of diabetic kidney disease in people with type 2 diabetes: past, present and future. Ther Adv Endocrinol Metab 2022; 13:20420188221081601.
Indexed at, Google Scholar, Cross ref
- Rojano Toimil A, Ciudin A. GLP-1 Receptor Agonists in Diabetic Kidney Disease: From Physiology to Clinical Outcomes. J Clin Med 2021; 10:3955.
Indexed at, Google Scholar, Cross ref
- Nauck MA, Meier JJ. The incretin effect in healthy individuals and those with type 2 diabetes: physiology, pathophysiology, and response to therapeutic interventions. Lancet Diabetes Endocrinol 2016; 4:525-36.
Indexed at, Google Scholar, Cross ref
- Holman RR, Bethel MA, Mentz RJ, Thompson VP, Lokhnygina Y, Buse JB, et al. Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2017; 377:1228-39.
Indexed at, Google Scholar, Cross ref
- Gerstein HC, Colhoun HM, Dagenais GR, Diaz R, Lakshmanan M, Pais P, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 2019; 394:121-30.
Indexed at, Google Scholar, Cross ref
- Mann JFE, Ørsted DD, Brown-Frandsen K, Marso SP, Poulter NR, Rasmussen S, et al. Liraglutide and Renal Outcomes in Type 2 Diabetes. N Engl J Med 2017; 377:839-48.
Indexed at, Google Scholar, Cross ref
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2016; 375:1834-44.
Indexed at, Google Scholar, Cross ref
- Kristensen SL, Rørth R, Jhund PS, Docherty KF, Sattar N, Preiss D, et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol 2019; 7:776-85.
Indexed at, Google Scholar, Cross ref
- Nauck MA, Meier JJ, Cavender MA, Abd El Aziz M, Drucker DJ. Cardiovascular Actions and Clinical Outcomes With Glucagon-Like Peptide-1 Receptor Agonists and Dipeptidyl Peptidase-4 Inhibitors. Circulation 2017; 136:849-70.
Indexed at, Google Scholar, Cross ref
- Retnakaran R, Cull CA, Thorne KI, Adler AI, Holman RR, UKPDS Study Group. Risk factors for renal dysfunction in type 2 diabetes: U.K. Prospective Diabetes Study 74. Diabetes 2006; 55:1832-9.
Indexed at, Google Scholar, Cross ref
- SPRINT Research Group, Wright JT, Williamson JD, Whelton PK, Snyder JK, Sink KM, et al. A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med 2015; 373:2103-16.
Indexed at, Cross ref
- ACCORD Study Group, Cushman WC, Evans GW, Byington RP, Goff DC, Grimm RH, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med 2010; 362:1575-85.
Indexed at, Google Scholar, Cross ref
- American Diabetes Association. 10. Cardiovascular Disease and Risk Management: Standards of Medical Care in Diabetes-2019. Diabetes Care 2019; 42:S103-23.
Indexed at, Cross ref
- Taler SJ, Agarwal R, Bakris GL, Flynn JT, Nilsson PM, Rahman M, et al. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for management of blood pressure in CKD. Am J Kidney Dis 2013; 62:201-13.
Indexed at, Google Scholar, Cross ref
- Lv J, Perkovic V, Foote CV, Craig ME, Craig JC, Strippoli GFM. Antihypertensive agents for preventing diabetic kidney disease. Cochrane Database Syst Rev 2012; 12:CD004136.
Indexed at, Google Scholar, Cross ref
- Haller H, Ito S, Izzo JL, Januszewicz A, Katayama S, Menne J, et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med 2011; 364:907-17.
Indexed at, Google Scholar, Cross ref
- Bangalore S, Fakheri R, Toklu B, Messerli FH. Diabetes mellitus as a compelling indication for use of renin angiotensin system blockers: systematic review and meta-analysis of randomized trials. BMJ 2016; 352:i438.
Indexed at, Google Scholar, Cross ref
- de Galan BE, Perkovic V, Ninomiya T, Pillai A, Patel A, Cass A, et al. Lowering blood pressure reduces renal events in type 2 diabetes. J Am Soc Nephrol 2009; 20:883-92.
Indexed at, Google Scholar, Cross ref
- Diabetes Control and Complications Trial Research Group, Nathan DM, Genuth S, Lachin J, Cleary P, Crofford O, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329:977-86.
Indexed at, Google Scholar, Cross ref
- de Zeeuw D, Remuzzi G, Parving HH, Keane WF, Zhang Z, Shahinfar S, et al. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL. Kidney Int 2004; 65:2309-20.
Indexed at, Google Scholar, Cross ref
- Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving HH, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345:861-9.
Indexed at, Google Scholar, Cross ref
- Lewis EJ, Hunsicker LG, Clarke WR, Berl T, Pohl MA, Lewis JB, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345:851-60.
Indexed at, Google Scholar, Cross ref
- ONTARGET Investigators, Yusuf S, Teo KK, Pogue J, Dyal L, Copland I, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358:1547-59.
Indexed at, Cross ref
- Frimodt-Møller M, Persson F, Rossing P. Mitigating risk of aldosterone in diabetic kidney disease. Curr Opin Nephrol Hypertens 2020; 29:145-51.
Indexed at, Google Scholar, Cross ref
- Agarwal R, Kolkhof P, Bakris G, Bauersachs J, Haller H, Wada T, et al. Steroidal and non-steroidal mineralocorticoid receptor antagonists in cardiorenal medicine. Eur Heart J 2021; 42:152-61.
Indexed at, Google Scholar, Cross ref
- Bakris GL, Agarwal R, Chan JC, Cooper ME, Gansevoort RT, Haller H, et al. Effect of Finerenone on Albuminuria in Patients With Diabetic Nephropathy: A Randomized Clinical Trial. JAMA 2015; 314:884-94.
Indexed at, Google Scholar, Cross ref
- Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, et al. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med 2020; 383:2219-29.
Indexed at, Google Scholar, Cross ref
- Pitt B, Filippatos G, Agarwal R, Anker SD, Bakris GL, Rossing P, et al. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. N Engl J Med 2021; 385:2252-63.
Indexed at, Google Scholar, Cross ref
Conclusiones
La ERD es una complicación microvascular de la diabetes
mellitus que conduce a aumento del riesgo cardiovascular con
gran impacto en la morbimortalidad del paciente diabético, su
prevalencia está en ascenso producto del aumento progresivo de
los casos de diabetes mellitus principalmente tipo 2, actualmente
se reconoce la ERD como una enfermedad con mecanismos
fisiopatológicos dinámicos y diversos que se producen de forma
simultánea y no siempre lineal, donde los marcadores que
definen la presencia de la enfermedad son la TFG y la albuminuria,
sin embargo, a futuro se espera que con mejor entendimiento
de la fisiopatología se desarrollen marcadores incluso más
tempranos. Los tratamientos actuales pueden enlentecer
el curso de la enfermedad, pero no frenarlo por completo,
establecer pautas individualizadas acorde al perfil del paciente
y sus comorbilidades iniciando por modificaciones en el estilo de
vida, establecer terapias recomendadas de primera línea hasta
intervenciones guiadas a objetivos específicos, impactando en
el RCV, SRAA, control glucémico y PA, ha sido el abordaje más
recomendado. La terapia con un IECA o ARA II, continúa siendo
el patrón de oro en cuanto al bloqueo del eje SRAA. La reducción
del riesgo cardiovascular es una de las metas más importantes
en estos pacientes, las terapias innovadoras más relevantes son
los SGLT2i, y AR-GLP1, dos grupos de fármacos prometedores,
siendo agentes con muy buen perfil de seguridad, que además
de aportar a las metas de control glicémico, han mostrado
impactar favorablemente en los estudios disponibles en tanto
desenlaces cardiovasculares como renales. Finerenone, un ARM
no esteroideo, constituye otra de las opciones terapéuticas
que han mostrado evidencia tanto en desenlaces renales como
cardiovasculares. Es necesario que se sigan realizando estudios
para comprender mejor la fisiopatología, que nos permitan
establecer terapéuticas novedosas que provean beneficios
cardiovasculares y renales en pro de mejorar el pronóstico,
prevención y manejo de la ERD a futuro.
Finerenone
Dentro de las terapias prometedoras encontramos un ARM
no esteroideo llamado Finerenone, el único de su clase que ha
mostrado beneficios cardiovasculares y renales en dos estudios pivótales, en especial se debe tener precaución dado el riesgo
de desarrollo de hiperkalemia con este fármaco sin embargo en
caso de presentarse podría ser manejada con pausas de 72 horas
de la medicación dado su vida media corta de acción y en caso de
no mejorar con dicha medida, establecer otras estrategias [85].
En el estudio FIDELIO-DKD (Finerenone in reducing kidney failure
and disease progression in diabetic kidney disease) ha mostrado
resultados promisorios, Finerenone logró el objetivo primario
(insuficiencia renal, una disminución sostenida de por lo menos
el 40 % de la TFG con respecto al valor basal o la muerte por
causas renales) en el 17,8% de los pacientes en comparación con
21,1% en placebo (HR: 0,82, IC: 073 a 0,93, p = 0,001) [86,87].
En el estudio FIGARO-DKD, la terapia con finerenone mejoró
resultados cardiovasculares en comparación con el placebo en
pacientes con diabetes tipo 2 que cursaban con ERC Grado 2-4
con albuminuria moderadamente elevada o ERC Grado 1 y 2 con
albuminuria severamente elevada, Por lo tanto, la finerenone
puede representar una importante opción terapéutica en
ERD, recomendándose actualmente su uso en el contexto de
albuminuria persistente pese al uso de un IECA o ARA II, en
pacientes con potasio normal [39,88].
Bloqueo Del Sistema Renina Angiotensina Aldosterona
ERD. El beneficio del bloqueo del SRAA en la ERD es independiente
del efecto que ejerce sobre la PA, probablemente se deba en
mayor medida a una reducción de la presión intraglomerular, el
deterioro de la ultrafiltración y albuminuria resultantes. Debido a
que la reducción de la albuminuria se asocia con una progresión más
lenta de la ERD y mejores resultados cardiovasculares, el control
de la albuminuria es un objetivo importante del tratamiento de la
ERD. Además, los inhibidores de SRAA mejoran el estrés oxidativo, la
inflamación y la fibrosis inducidos por la angiotensina [71,78].
Los IECA y los ARA II son los agentes de mayor evidencia y
recomendación de uso. Múltiples ensayos clínicos aleatorizados
con IECA y ARA II han demostrado el beneficio en la reducción
del riesgo de duplicación de la creatinina sérica y los desenlaces
compuestos de mortalidad y ERT [79-81].
El estudio Diabetes Control and Complications Trial Research
Group (DCCT), evidenció que captopril independiente de su
efecto sobre la PA, redujo el riesgo de duplicación de los niveles
de creatinina sérica un 48% en 3 años en individuos con DM tipo
1 y niveles elevados de albuminuria [79].
En los estudios RENAAL (losartan) e IDNT (irbesartan) se
evidenció que independientemente de su efecto sobre la PA,
el uso de estos ARA II mostró una reducción importante en el
desenlace compuesto de duplicación de la creatinina sérica basal,
mortalidad o fracaso renal en un 16% y 20% respectivamente
durante 3 años aproximadamente [80,82].
No se ha recomendado el uso combinado de IECA+ARA II dado
que estudios como el ONTARGET (Telmisartán + Ramipril) han
mostrado que, si bien producen niveles más bajos de PA y de
albuminuria, no producen beneficio adicional a largo plazo con
relación a la monoterapia y en contraposición aumentaron
significativamente el riesgo de eventos adversos asociados como
hiperkalemia e hipotensión [83].
Los Antagonistas Del Receptor Mineralocorticoide (ARM)
disminuyen la albuminuria, sin embargo, carecen de evidencia
con respecto a la prevención del desarrollo de ERT, sus
efectos adversos más comunes como la hiperkalemia han sido
prevenidos en estudios a largo plazo sobre la ERD, las estrategias
para los ensayos clínicos incluyen el uso de quelantes de potasio,
inhibidores de la aldosterona sintasa y antagonista del receptor
mineralocorticoide no esteroideos [84].
Hipertensión Arterial
El control de la PA en individuos con ERD ha mostrado ser
fundamental en el retraso de la progresión de la enfermedad y
disminución de la mortalidad cardiovascular, en el estudio UK
Prospective Diabetes Study (UKPDS) se evidenció una disminución
del riesgo de aparición de complicaciones microvasculares hasta
un 37% en pacientes que fueron tratados con una meta de tensión
arterial < 150/85 mmHg en comparación con aquellos que fueron
tratados con meta de <180/105mmHg además que se observó
por cada aumento de 10mmHg un incremento del 15% en el
riesgo de desarrollo de Enfermedad Renal Crónica (ERC) Grado
3 evidenciado bien sea por el establecimiento de albuminuria o
una duplicación de los niveles de creatinina sérica [61,70].
Las metas de presión arterial han sido controvertidas en el
tiempo, el estudio The Systolic Blood Pressure Intervention Trial
(SPRINT) en 2015 demostró que, en pacientes con alto riesgo
cardiovascular, una disminución de los niveles de presión arterial
sistólica (PAS) < 120 vs <140, se asoció a mejoría en la mortalidad
cardiovascular y por todas las causas sin embargo estos resultados
no podrían ser extrapolados a la población diabética ya que dicha
población fue excluida del studio [71].
El estudio The ACCORD-Blood pressure se propuso investigar
el efecto del control estricto de la PA sobre los desenlaces
cardiovasculares particularmente en pacientes diabéticos con
alto riesgo de enfermedad cardiovascular.
Los resultados mostraron que los objetivos de PA más bajos
(presión arterial sistólica <120 vs <140) se asociaron con un
menor riesgo de progresión de la proteinuria y accidente
cerebrovascular durante el seguimiento a 5 años, pero sin
beneficio para los eventos cardiovasculares fatales y no fatales
combinados. Los eventos adversos graves debidos a la terapia
antihipertensiva fueron más frecuentes en el grupo hipotensor
(3,3 % frente a 1,3 %) [72].
El tratamiento inicial de la hipertensión en pacientes con diabetes
debe incluir cambios del estilo de vida, esto incluye la restricción
de sodio en la dieta (menos de 2300 mg por día), pérdida de peso
en caso de sobrepeso u obesidad, aumento de la actividad física,
moderar el consumo de alcohol y cesación del Tabaco [73].
Actualmente el JNC 8 (Eighth Joint National Committee) y las
guías KDOQI recomiendan metas de PA < 140/90 en el paciente
diabético independientemente de la presencia de ERC, siempre y
cuando no exista proteinuria, en presencia de proteinuria dicho
parámetro se vuelve más estricto siendo la meta <130/80 [74].
Los agentes de elección para control de la presión arterial en el
paciente con ERD son los inhibidores de La Enzima Convertidora
De Angiotensina (IECA) y los antagonistas de los receptores de
angiotensina II (ARA II) [75-77], los diuréticos tiazídicos y calcio antagonistas aparecen como agentes de segunda línea en caso
de no obtención de metas de PA con el IECA o ARA II en, ya que
parecen mostrar efectos cardioprotectores, sin embargo no
parecen tener el mismo grado de beneficio sobre la progresión
de la ERD [77].
Agonistas Del Receptor Del Péptido Similar Al Glucagón 1
(AR-GLP-1)
Son una hormona incretina que estimula la secreción de insulina
en respuesta a la ingesta de alimentos y sus análogos se utilizan
para tratar la diabetes tipo 2 [62,63].
Hacen parte de los agentes con potencial para prevenir la ERD, sin
embargo no todos los pertenecientes a su grupo han demostrado
dicho beneficio, los análogos incretina miméticos de exendina-4
como exenatide/lixisenatide no han demostrado resultados
favorables en desenlaces cardiovasculares [64], mientras que los
AR-GLP1 humano como liraglutida, dulaglutida y semaglutida si
han mostrado beneficios [65,66].
En los ensayos LEADER y SUSTAIN-6, el tratamiento con liraglutida
y semaglutida respectivamente se asoció con una tasa más baja
de eventos cardiovasculares importantes o muerte [66,67] En
el ensayo REWIND el tratamiento con dulaglutida vs placebo en
9901 participantes donde solo el 31% de los participantes tenían
enfermedad cardiovascular previamente establecida, dulaglutida
mostró una reducción de los 3p-MACE en aproximadamente un
12%, independientemente de la preexistencia de enfermedad
cardiovascular aterosclerótica. Un metaanálisis de siete grandes
ensayos clínicos de AR-GLP1 con 56 004 pacientes mostró
una reducción del 12 % en 3p-MACE. Los desenlaces renales
compuestos se redujeron en un 17 % para todos los AR-GLP1,
principalmente debido a una reducción en la macroalbuminuria
[65,68].
Los beneficios cardiovasculares y renales que proveen los fármacos
AR-GLP1 pueden estar relacionados con sus efectos directos
sobre la presión arterial, la glucosa y el peso corporal, también
mejoran la disfunción endotelial y la inflamación. Inicialmente,
pueden causar una caída en la TFG, que generalmente se estanca.
Actualmente se recomienda su uso en pacientes con diabetes
tipo 2 que no consigan metas de control glucémico o persistan con albuminuria pese al manejo con terapia de primera línea
(Metformin + SLGTi) o como sustituto en el caso de que no esté
disponible o esté contraindicado el uso de dichas terapias. Se
aconseja el uso de fármacos de acción prolongada, iniciando con
dosis bajas, subiendo escalonadamente la dosis a fin de evitar la
intolerancia gastrointestinal, debe evitarse la combinación con
los inhibidores de la dipeptidil peptidasa 4 (iDPP-4) [39,69].
SGLT-2i
Los SGLT-2i Previenen la reabsorción de glucosa filtrada a nivel
tubular renal, lo cual desencadena glucosuria disminuyendo
los niveles de glicemia. Proveen efectos nefro protectores y
disminuyen RCV en los pacientes con ERD independientemente
de su efecto hipoglucemiante [53]. Aún no está del todo claro
el mecanismo por el cual producen dicho efecto, La hipótesis
principal se centra en la excreción urinaria de sodio causada por
la inhibición de la reabsorción de sodio y Glucosa en el túbulo
proximal. Aumentando la concentración de sodio en la mácula
densa, activando la retroalimentación tubuloglomerular que
conduciría a Vasoconstricción de las arteriolas aferentes y en
reducción de la presión intraglomerular [54,55].
Respecto a los efectos adversos asociados a la terapia con SGLT-
2i, lo más frecuente son las infecciones del tracto urogenital,
siendo la infección micótica genital la más frecuente, sobre todo
en fases tempranas del tratamiento, las infecciones urinarias son
menos usuales, con menos frecuencia aun, puede presentarse
cetoacidosis normo glucémica, educar al paciente para que evite
dietas cetogénicas, suspender el uso durante enfermedad aguda,
o previo a cirugías podría disminuir los riesgos asociados [56,57].
En el estudio CREDENCE, que comparó canaglifozina vs placebo en
4401 pacientes albuminuricos con diabetes tipo 2 y enfermedad
renal, incluyeron pacientes con TFG > 30ml/min/ 1.73m2, y
relación albumina/creatinuria media de 927mg/g. Canaglifozina
evidenció una disminución 34% del riesgo compuesto de duplicar
la creatinina sérica basal, enfermedad renal terminal o muerte
por causas renales. (HR 0.66 (0.53–0.81); p < 0.001). Además, la
canaglifozina redujo tres desenlaces adversos cardiovasculares
mayores (3p-MACE) en un 20% (HR 0,80 (0,67-0,95); p < 0,01) y
hHF en un 39% (HR 0,61 (0,47-90,8); p < 0,001) [58].
El estudio DAPA-CKD Incluyó pacientes con ERC no diabética,
en pacientes con TFG 25-75ml/min/1.73 m2, y albuminuria,
dapagliflozina demostró una reducción del 44% en el desenlace
renal compuesto, en la duplicación de los niveles séricos basales
de creatinina, ERT, o mortalidad por causas renales (HR 0,56
(0,45-0,68); p<0,001) [59].
Un metaanálisis confirma los efectos favorables de SGLT2i en
el desenlace renal compuesto de duplicación de creatinina
sérica basal (40% de disminución de la TFG), inicio de Terapia
De Reemplazo Renal (TRR) o muerte de causas renales (RR 0,63
(0,56-0,71) incluso en presencia de enfermedad cardiovascular o
múltiples factores de riesgo (RR 0,67 (0,59-0,76) [60].
Basado en estos resultados, actualmente se avala el uso de
canaglifozina, empaglifozina y dapagliflozina como agentes de
prevención de riesgo cardiovascular y nefro protectores en el
contexto de enfermedad renal diabética, recomendando su inicio
en pacientes diabéticos tipo II con TFG>20ml/min/1.73 m2 y han
sido sugeridos como terapia de primera línea en las guías KDIGO
2022 [39,61].
Metformina
La metformina es un hipoglucemiante oral perteneciente al
grupo de las biguanidas, considerado agente de primera línea en
pacientes con diabetes tipo 2, que posee estudios experimentales
que han demostrado atenuar la ERD interviniendo en mecanismos
inflamatorios, estrés oxidativo y fibrosis. En los ensayos clínicos el
uso de metformina se ha asociado a disminución de la mortalidad,
enfermedad cardiovascular y progresión a ERT, sin embargo, su uso
debe ser monitorizado y establecido con precaución debido al riesgo
incrementado de acidosis láctica [50]. En general no se recomienda
el uso de metformina en pacientes con ERC avanzada, debido a que
se ha observado un aumento de la mortalidad en estos pacientes,
actualmente se recomienda su uso en pacientes diabéticos tipo 2
que presenten TFG ≥30 ml/min/1.73 m2, ajustando la dosis acorde a
la función renal, siendo junto con los SGLT-2i la terapia farmacológica
de primera línea [50-52].
Agentes Hipoglucemiantes
La terapia farmacológica de primera línea actual en la ERD está
constituida en pacientes diabéticos tipo 2 por la metformina
en asociación a un SGLT2i (inhibidores del cotransportador
Sodio glucosa 2), siempre que no exista contraindicación para
la administración de los mismos, ya que son fármacos que impactan tanto en el control metabólico como en los desenlaces
renales y cardiovasculares, la adición y selección de otros
hipoglucemiantes cuando no se obtengan metas de control
metabólico, debe ser establecida de acuerdo a múltiples factores
como la disponibilidad local de los fármacos, costos asociados,
preferencia del paciente, comorbilidades, niveles de TFG, siendo
de preferencia por la evidencia actual los AR-GLP1 [39].
Hiperglicemia
En el paciente con ERD el control de la glicemia cobra un
papel fundamental en la prevención del establecimiento de la
enfermedad. El ensayo Action in Diabetes and Vascular Disease:
Preterax and Diamicron Modified Release Controlled Evaluation
(ADVANCE) mostró que el control intensivo de la glucosa puede
reducir el desarrollo de microalbuminuria y macroalbuminuria
[47].
La asociación americana de la diabetes (ADA) sugiere individualizar
las metas de control glicémico de acorde con el perfil del paciente
de acuerdo con su edad, comorbilidades y expectativa de vida,
sugiriendo expectativas de control más estrictas ( HbA-1c < 6.5%)
en el paciente joven sin comorbilidades y con buena expectativa
de vida, en contraposición metas más laxas (HbA-1c < 8%) deben
ser consideradas en el paciente anciano con enfermedad de larga
data, complicaciones macro y microvasculares y expectativa de
vida más corta [48-50].
Las guías de manejo de KDIGO sugieren como meta para pacientes
diabéticos una HbA-1c menor que 7% con el objetivo de disminuir
y retrasar la aparición de complicaciones microvasculares,
sin embargo, aclaran que en pacientes con riesgo elevado de
hipoglucemia, dicha meta no debe ser tan estricta, aceptando
valores por encima de 7% pero menor que 8% [39].
Tratamiento
El tratamiento tiene como objetivo evitar las complicaciones
asociadas a la ERD, disminuyendo la progresión de la enfermedad
y el Riesgo Cardio Vascular (RCV), lo cual comprende un adecuado
control de la glicemia, presión arterial, RCV y bloqueo del SRAA
(Figura 3) [2].

Figura 3. Resumen de aspectos esenciales del tratamiento de la ERD.
Manejo No Farmacológico de la ERD
E Recientemente las guías KDIGO recomiendan un abordaje
holístico que inicia con la promoción de estilos de vida saludables,
estos incluyen una dieta saludable, actividad física, cesación del
tabaco y control del peso [39].
El consumo de tabaco sigue siendo una de las principales causas
de muerte en todo el mundo y un factor de riesgo conocido para
desarrollar ERC. Estudios recientes también subrayan el vínculo
entre ser fumador pasivo y el desarrollo de la enfermedad; La
cesación del consumo del tabaco debería ser recomendada a
todos los pacientes con ERD, evitar la exposición pasiva al humo
del tabaco es otra intervención aconsejable en estos pacientes
[30-41].
Las rutinas de ejercicio regular mejoran la homeostasis glicémica,
atenúan el estrés oxidativo, optimizan la función endotelial,
modulan la inflamación y el SRAA. Han sido consideradas
estrategia clave en la obtención de metas del control metabólico
y prevención de complicaciones asociadas a la diabetes mellitus,
mejorando la calidad de vida de los pacientes así como también
tienen el potencial de prevenir y atenuar el desarrollo de la ERD
[42]. En general se recomiendan rutinas de ejercicio regular, de
intensidad moderada, con duración de al menos 150 minutos/
semana, evitando la inactividad por 2 días consecutivos, deben
contener idealmente tanto ejercicios aeróbicos como de
resistencia en pacientes adultos con diabetes tipo 2 [43].
Los cambios dietarios en la ERD recomendados por la Nutrition
Kidney Foundation- KDOQI (NKF-KDOQI) comprenden una
ingesta de calorías de 30-35 Kcal/kg/día, dando preponderancia
a alimentos como cereales integrales, fibras, frutas, vegetales,
y evitando la ingesta de azucares refinados. Recomiendan una
ingesta de sodio menor que 1.5-2.3 gr/día, la cantidad optima
de consumo de grasas no está aun clara del todo en la ERD, sin
embargo, se ha recomendado reducir el consumo de grasas
trans y de ácidos grasos saturados, en estos últimos la pauta
es <7% del total de calorías diarias, se ha evidenciado que el
consumo de ácidos grasos poliinsaturados y monoinsaturados
tendrían un efecto protector en la atenuación de la inflamación
y disfunción endotelial y mejorarían el control de la tensión
arterial y los lípidos. Respecto al consumo de proteínas en la
ERD la recomendación ha sido establecer la ingesta de acuerdo con el grado de compromiso renal de los pacientes, en general
se recomienda en pacientes con enfermedad renal Grado I-IV
metas de 0.8/kg/día, por el contrario, en aquellos que están en
ERT manejados con terapia de reemplazo renal se consideran
apropiados aportes >1.2 g/kg/día [44].
La obesidad es un factor de riesgo para múltiples condiciones
de salud incluyendo hipertensión, enfermedad cardiovascular,
apnea obstructiva del sueño y osteoartritis, clásicamente el
Índice De Masa Corporal (IMC) ha sido la medida utilizada
para medir esta condición sin embargo evidencia reciente
sugiere que la acumulación de grasa en la cintura u obesidad
central se comportaría también como un factor de riesgo
independientemente del valor del IMC. Es sabido que en la
obesidad se presentan cambios en la estructura y fisiología renal,
dentro de las estructurales encontramos glomerulomegalia,
expansión mesangial, esclerosis y anormalidades en los
podocitos, incluso una forma específica de glomeruloesclerosis
focal segmentaria, dentro de las funcionales se presentan
hiperfiltración y proteinuria. Dado que tanto la ERD como la
obesidad comparten características en cuanto a las alteraciones
anatómicas y fisiológicas, se considera que su asociación podría
tener efectos sumatorios. Actualmente se recomendaría a todos
los pacientes con obesidad y ERD a perder peso, en especial a
aquellos que están en grados no avanzados de enfermedad (I-III)
[45,46].
Genética Y Epigenética
Recientemente la genética y epigenética han captado gran interés
dado que evidencias recientes muestran que desempeñan un
papel relevante en la fisiopatología de la ERD. Dentro de las
modificaciones epigenéticas destaca la metilación del DNA,
los ARN no codificantes, modificaciones postransduccionales
de las histonas, los cuales se ha demostrado que se detonan
por la hiperglucemia, hipoxia, inflamación y mediadores como
citoquinas [32].
Dichas modificaciones determinan que las células del individuo
adquieran memoria metabólica de tal manera que aunque
el paciente obtenga un adecuado control con intervenciones
medicas como una dieta adecuada, control del peso y de glicemia
con fármacos o insulinoterapia, muchos pacientes continúan
experimentando numerosas complicaciones asociadas a la ERD,
lo que sugiere la existencia de un "recuerdo" de la exposición
previa a la hiperglicemia en las células diana, lo que conduce a la
persistencia de sus efectos perjudiciales durante mucho tiempo
después de que se haya establecido el control glucémico. Por
tanto, una de las dianas actuales de abordaje y manejo está
encaminada en el desarrollo de marcadores epigenéticos y
terapias de modificación [33].
Autofagia Desregulada
Estudios recientes han demostrado que la autofagia desregulada
también juega un papel patogénico importante en la ERD. La autofagia es la degradación celular de macromoléculas y
orgánulos para preservar la homeostasis celular. La autofagia
tiene dos funciones fisiológicas principales; una es reciclar los
recursos intracelulares de acuerdo con los requerimientos de
nutrientes, otra es la eliminación de proteínas y orgánulos
dañados bajo diversas condiciones de estrés [29,30]. La
importancia de la autofagia en la patogenia de la ERD se
destacó en un estudio que utilizó ratones con deficiencia de
autofagia específica de podocitos, que mostró una disminución
de podocitos y proteinuria masiva después de una dieta rica en
grasas [31].
Sistema Renina Angiotensina Aldosterona
La activación e hiperactividad del Sistema Renina Angiotensina
Aldosterona (SRAA) también juegan un papel clave en el
deterioro de la ERD, ya que existen múltiples ensayos clínicos
y modelos animales donde se demuestra que la inhibición de
dicho sistema retrasa la progresión del daño renal en la ERD, se
sabe además que la Angiotensina II y el factor de crecimiento
transformante (TFG-B1) promueven el desarrollo de fibrosis
renal y atrofia tubular renal, inducen a hipoxemia crónica y
promueven deterioro de la microcirculación [26,27]. También
se cree que la aldosterona desempeña un papel importante en
la fisiopatología de la ERD al regular la expresión génica y otros
mecanismos, incluida la regulación al alza de los factores de
crecimiento proescleroticos, como el inhibidor del activador del
plasminógeno 1 (PAI-1) y el TGF-B, y promueve la infiltración de
macrófagos y la consiguiente fibrosis renal [27,28].
Factores Inflamatorios
La hipoxia renal y la inflamación son también factores esenciales
en el desarrollo de la ERD, se sabe que la hipoxia es el resultado
de un balance inadecuado entre los requerimientos y aportes
de oxígeno; en la diabetes y la hiperglucemia se aumenta el
gasto energético de las células tubulares que derivan en un
aumento de la actividad del cotransportador de Sodio-glucosa e
hiperfiltración glomerular [17].
Pese a que surge un aumento en el consumo de oxígeno, el
suministro de oxígeno se encuentra disminuida en la ERD
debido a causas multifactoriales, entre los que destacan la pérdida de capilares peritubulares y la fibrosis intersticial [18].
Existen estudios basados en resonancia magnética con imagen
de contraste dependientes de nivel de oxígeno en modelos
animales que han mostrado que el nivel bajo de oxigenación a
nivel de la corteza renal fue un factor predictor independiente de
disminución de la función renal [19].
La inflamación cumple un rol determinante en el desarrollo de
la ERD por diversos mecanismos fisiopatológicos; se ha descrito
la relación independiente entre la Proteína C Reactiva (PCR)
y la albuminuria en los pacientes diabéticos, en dicho proceso
destaca el papel de múltiples citoquinas inflamatorias como
detonantes del daño renal en la ERD [20].
La IL-1 se asocia a un aumento en la expresión y asimilación de
factores quimiotácticos y adhesinas en las células del endotelio
y el mesangio, además de fallas en la regulación en la síntesis
del ácido hialurónico en el epitelio tubular y en el aumento
de la permeabilidad del endotelio, así como alteraciones
hemodinámicas intraglomerulares [20,21].
Por su parte la IL-6 Se asocia con cambios en la permeabilidad
endotelial, proliferación de células mesangiales y aumento
de la expresión de fibronectina. La expresión renal de IL-6
se correlaciona directamente con la gravedad y los cambios
estructurales de la hipertrofia renal y la lesión glomerular en la
ERD [20,21].
En cuanto a la IL-18, esta molécula se asocia con un aumento
de la albuminuria y cambios en este parámetro durante la
enfermedad renal, lo que sugiere que niveles elevados de esta
citoquina pueden ser un predictor de disfunción renal temprana
en pacientes diabéticos normoalbuminúricos [20,21].
Dentro de los mediadores inflamatorios también se destaca el
TNFa, dicha molécula tiene actividades biológicas que pueden
estar relacionadas con la lesión renal en pacientes diabéticos:
citotoxicidad directa a las células renales, inducción de apoptosis,
alteración de la hemodinámica intrarrenal, aumento de la permeabilidad endotelial o inducción de estrés oxidativo. En
modelos experimentales de DM, los niveles renales de TNFa están
elevados, lo que se asocia con hipertrofia renal e hiperfiltración,
alteraciones iniciales en el desarrollo de la ERD [22,23].
Por último se destaca el factor de transcripción nuclear kappa B
(NF-Kb) el cual ha sido identificado como pieza clave en las vías
inflamatorias que intervienen en la ERD, dicho factor se encuentra
en forma inactivada en las células residentes sin embargo antes
estímulos desencadenados por la hiperglicemia, AGEs, Estrés
mecánico, proteinuria, angiotensina II, producen su activación,
una vez activado desempeña un rol central en la activación
y reclutamiento de citoquinas, quimioquinas y moléculas de
adhesion [24,25].
Factores Metabólicos
La hiperglucemia activa rutas metabólicas que generan especies
reactivas de oxígeno (ROS), como son la ruta de los polioles, la
ruta de la hexosamina, la ruta de la Protein Kinasa C (PKC) y la
ruta de los Productos Finales De Glicación Avanzada (AGE). Las
ROS oxidan macromoléculas importantes, incluyendo proteínas,
lípidos y ácidos nucleicos, que en última instancia conducen a
daño tisular [11,12].
En la diabetes se encuentra alterada la función mitocondrial lo
cual también conlleva a incremento en los niveles de ROS por
retroalimentación positiva de enzimas prooxidantes como la
Nicotinamida Adenina Dinucleótido Fosfato (NADPH). Dicha
acumulación de ROS y superóxidos se considera el principal
desencadenante de los eventos que derivan en las complicaciones
en la diabetes mellitus incluyendo la ERD [13].
Por otro lado, la resistencia a la insulina, los niveles elevados
de glucemia y el aumento de los niveles de insulina en sangre,
provocan de forma independiente disfunción endotelial al
promover varios mecanismos intracelulares, como una mayor
producción de especies reactivas de oxígeno (ROS), Proteína
Quinasa C (PKC) y Producto Final De Glicación Avanzada (AGE)
induciendo señalización proinflamatoria [14].
Las interacciones de los mediadores producidos por las células
endoteliales se interrumpen y tienden a desequilibrarse, entre
estos mediadores, la endotelina-1 (ET-1) es el péptido vasoactivo
más potente producido por las células endoteliales para
regular la homeostasis vascular. En las células endoteliales, la
hiperinsulinemia compensatoria aumenta la secreción de ET-1, lo
que provoca vasoconstricción y disfunción vascular. En el riñón,
la activación del receptor de la endotelina A se asocia además
de vasoconstricción con daño de los podocitos, estrés oxidativo,
inflamación y fibrosis [15,16].
Factores Hemodinámicos
Dentro de los factores hemodinámicos tenemos el aumento de la
presión intraglomerular e hiperfiltración, los cuales se presentan
en las primeras etapas de la diabetes y contribuyen al desarrollo
y progresión de la ERD, La ultrafiltración puede explicarse en
parte por una retroalimentación tubuloglomerular no regulada.
En la hiperglucemia, la hiperfiltración de glucosa incrementa la
reabsorción tubular renal de glucosa y sodio en el túbulo proximal, lo que resulta en una distribución reducida de sodio a la mácula
densa tubular distal, esto produce a una importante disminución
de la resistencia de las arteriolas aferentes y consecuentemente
a aumento de la presión en el glomérulo [11].
El aumento de la presión del glomérulo produce estrés mecánico
sobre la pared capilar, lo que ocasiona la glomeruloesclerosis
y destrucción de capilares peritubulares, también incrementa
la filtración de proteínas hacia la luz tubular lo cual provoca la
producción de factores proinflamatorios y profibróticos que
derivan en daño renal [11].
Fisiopatología
La ERD ha sido explicada tradicionalmente como el resultado entre
la sumatoria y relación de factores hemodinámicos y metabólicos
(Figura 1), sin embargo, actualmente se sabe que en su desarrollo
intervienen una compleja red de eventos determinantes del
daño renal, dentro de estos: factores de susceptibilidad (género,
raza, edad, historia familiar y genética), de progresión (dieta,
obesidad, hipertensión arterial) y el elemento iniciador que es la
hiperglicemia [10].
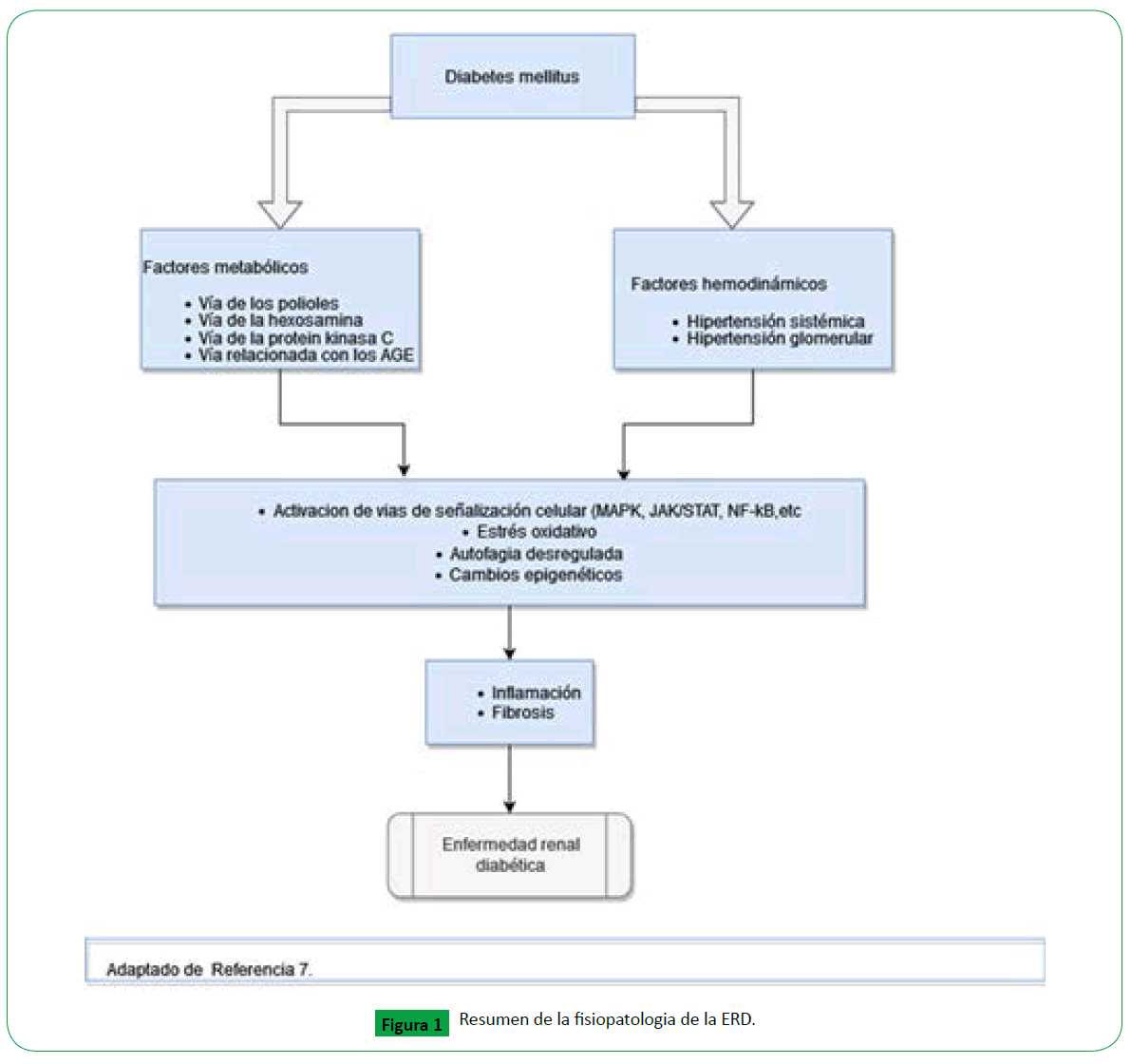
Figura 1. Resumen de la fisiopatologia de la ERD.
Factores de Riesgo
Los factores de riesgo para la ERD se clasifican conceptualmente
en factores de susceptibilidad, de iniciación y progresión (Tabla 1),
dentro de los que destacan la hiperglucemia y la hipertensión
[6,7].
| Factores de riesgo para ERD |
| Factor de riesgo |
Susceptibilidad |
Iniciacion |
Progresion |
| Demograficos |
|
|
|
| Mayor edad |
+ |
- |
- |
| Sexo masculino |
+ |
- |
- |
| Razo/Etnia (Negros, Indios, Hispanos, etc) |
+ |
- |
+ |
| Hereditarios |
|
|
|
| Historia familiar de ERD |
+ |
- |
- |
| Enfermedad renal genetica |
- |
+ |
- |
| Condiciones sistemicas |
|
|
|
| Hiperglicemia |
+ |
+ |
+ |
| Obesidad |
+ |
+ |
+ |
| Hipertension |
+ |
- |
+ |
| Injuria renal |
|
|
|
| Lesion renal aguda |
- |
+ |
+ |
| Tabaquismo |
+ |
- |
+ |
| Factores dietarios |
|
|
|
| Atla ingesta de proteinas |
+ |
- |
+ |
Table 1. Factores de riesgo para ERD.
En paciente normoalbuminúricos con diabetes tipo 1, un
mal control glicémico se ha comportado como predictor
independiente de progresión al desarrollo de albuminuria y o ERT
[6,8]. Un control inadecuado de la presión arterial (PAS >140) en
el paciente con diabetes tipo 2 se ha asociado ampliamente con
riesgo más alto de mortalidad y de desarrollar ERT [9].
Epidemiologia
La federación internacional de la diabetes estimó una prevalencia
global de la diabetes en adultos de 20-79 años en el año 2021
de un 10.5%, para el 2030 proyecta un aumento hasta 11.3% y
para el 2040 de hasta un 12.2%. Se estima que 240 millones de
personas tienen diabetes no diagnosticada a nivel mundial, esto
significa que casi uno de cada dos adultos con diabetes no sabe
que la padece [4].
La ERD es una de las complicaciones microvasculares que más
impactan en el pronóstico de los pacientes con diabetes mellitus
y la principal causa de enfermedad renal terminal. La incidencia
de la ERD se ha duplicado en la última década debido al aumento
de casos de diabetes tipo 2, En la actualidad se estima que cerca
del 25-35 % de quienes son diagnosticados con diabetes tipo 2 ya
tienen complicaciones microvasculares [5].
La mortalidad por todas las causas en personas con ERD es
aproximadamente 30 veces mayor que en pacientes diabéticos
que no la padecen; la gran mayoría de los pacientes con ERD
mueren por enfermedad cardiovascular antes de desarrollar
enfermedad renal terminal [5].
Introducción
La Enfermedad Renal Diabética (ERD) es una complicación
microvascular que se presenta en la diabetes tipo 1 y tipo 2, la
cual aumenta la morbimortalidad en comparación con aquellos
que no la desarrollan, con frecuencia esta condición avanza hasta
enfermedad renal terminal (ERT), con necesidad de terapia de
reemplazo renal [1].
La Nefropatía Diabética (ND) Tradicionalmente se consideraba
como una serie de etapas secuenciales, iniciando con hiperfiltración
e hipertrofia glomerular, seguido de albuminuria, que derivan en un
deterioro de la función renal. Actualmente la ND hace referencia a la lesión microangiopática producida por la diabetes mellitus,
con compromiso principalmente del glomérulo, caracterizada por
proteinuria persistente, hipertensión arterial y empeoramiento
progresivo de la Tasa de Filtración Glomerular (TFG), Se reconoce
que un grupo notable de pacientes desarrollan deterioro de la TFG
sin atravesar fases intermedias, por lo cual el paradigma actual que
define la enfermedad renal diabética es el deterioro de la función
renal. El término de uso general actual es el de Enfermedad renal
diabética, dado que es una definición más amplia que abarca los
pacientes diabéticos que presenten compromiso renal [2,3].
Un control Glicémico estricto, el tratamiento de la Presión Arterial
(PA), disminución del riesgo cardiovascular y medidas de nefro protección enfocados sobre el Sistema Renina Angiotensina
Aldosterona (SRAA) pueden retrasar la progresión y el desarrollo
de la enfermedad renal diabética [2].
Competing interests: The authors have declared that no competing interests exist.








