Case Report - (2022) Volume 18, Issue 1
Finerenone Y Su Papel En La Enfermedad Renal Diabetica. Estado Del Arte
Daza-Arnedo Rodrigo,
Rico-Fontalvo Jorge,
Aguilar-Salcedo Nataly,
Alfaro Mercedes,
Navas-Torrejano Diana,
Cardona-Blanco Maria X,
Raad-Sarabia Maria* and
Abuabara-Franco Emilio
Nefrólogo, Asociación Colombiana de Nefrología, Colombia
Medicina Interna, Universidad de Cartagena, Colombia
1Medicina Interna, Universidad del Sinú, Cartagena, Colombia
*Correspondence:
Raad-Sarabia Maria, Medicina Interna, Universidad del Sinú,
Colombia,
Tel: +57 3014566340,
Email:
Received: 29-Nov-2021, Manuscript No. IPADM-21-11806;
Editor assigned: 01-Dec-2021, Pre QC No. IPADM-21-11806(PQ);
Reviewed: 15-Dec-2021, QC No. IPADM-21-11806;
Revised: 21-Jan-2022, Manuscript No. IPADM-21-11806(R);
Published:
28-Jan-2022, DOI: 10.36648/1698-9465.22.18.1521
Abstract
La enfermedad renal diabética representa la primera causa de enfermedad renal terminal y su presencia impacta directamente en el riesgo cardiovascular y la mortalidad de los individuos con diabetes mellitus. Siendo la albuminuria el principal marcador de la ERD su reducción se ha constituido en los últimos años como uno de los objetivos terapéuticos para impactar en la evolución de la enfermedad. El finerenone, un antagonista de los receptores mineralocorticoides, se ha descrito en diversos estudios recientes como un fármaco cuyo mecanismo de acción podría contribuir a la reducción de la progresión de la ERD, disminuyendo el deterioro de la TFGe y la albuminuria con un adecuado perfil de seguridad en pacientes en todos los estadios de la enfermedad renal.
Keywords
Medinca; Finerenone; Enfermedad renal diabetic; Antagonista mineralocorticoide
Introduccion
La diabetes mellitus tipo 2 (DMT2) es uno de los principales
problemas de salud pública de Latinoamérica. Según la Federación Internacional de Diabetes, para el año 2019 se reportaron
alrededor de 32 millones de casos de pacientes diabéticos en
Centro y Suramérica con una prevalencia promedio estimada del
9,4% y una proyección a más de 49 millones de casos en el año 2045 [1]. La hiperglicemia persistente y la predisposición genética
promueven el daño microvascular que compromete órganos
diana como el riñón, los ojos y el sistema nervioso central. Una de
las complicaciones más frecuentes que presentan los pacientes
diabéticos es la enfermedad renal diabética (ERD), una patología
cuya incidencia se ha duplicado en la última década debido,
principalmente, al aumento en el número de casos de pacientes
que padecen de DMT2 (Figura 1) (Tabla 1)[2].
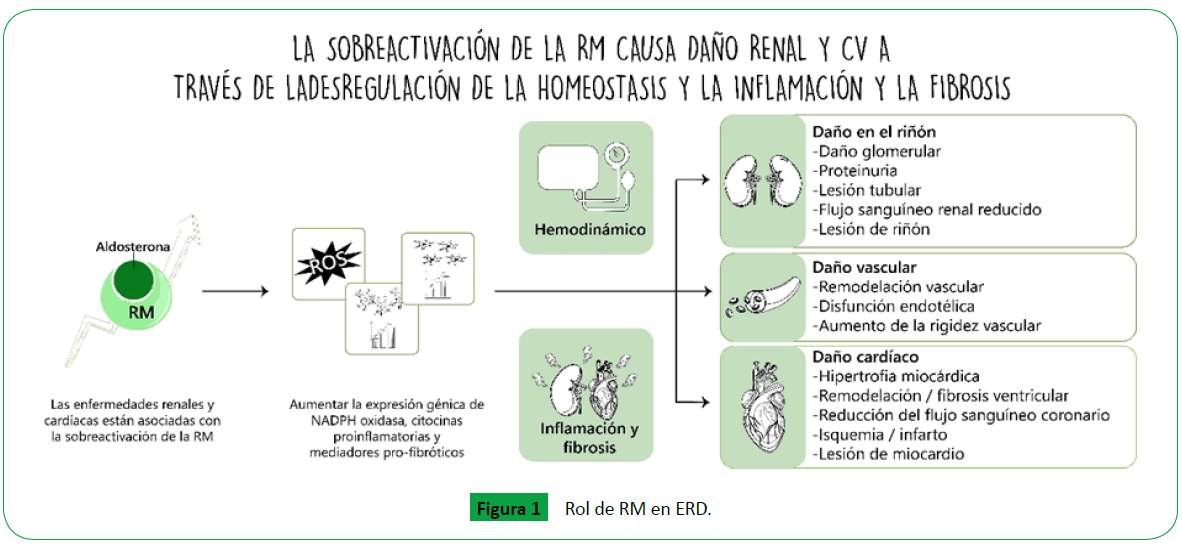
Figure 1: Rol de RM en ERD.
| Estudio |
Seguimien Medio (Meses) |
Caracteristics Linea da Base |
Intervension |
Comparador |
Hallazgos Principales |
| Diabetes Mellitus tipo I |
Collaborative Grupo de studio (1993)
N=409 |
36 |
sCr: 1.3mg/dl
HbAlc: 11.8%
Albuminuria: 2.5g/d |
Captopril |
Placebo |
Captopril ↓ tiempo para duplicar la sCr en un 43% |
| Diabetes Mellitus tipo II |
IDNT(2001)
N=1715 |
31 |
sCr: 1.3mg/dl
HbAlc: 8.1%
Albuminuria: 2.9g/d |
lrbesartan |
Amlodipino, Placebo |
lrbesartan ↓ riesgo de duplicar la sCr, muerte o progresión a insuficiencia renal en un 20% en comparación con placebo y un 23% en comparación con amlodipino |
RENAAL (2001)
N=1513 |
41 |
sCr: 1.9mg/dl
HbAlc: 8.4%
Albuminuria: 1.2g/d |
Losartan |
Placebo |
Losartan ↓ riesgo de duplicar la sCr,muerte o progresión a insuficiencia renal |
| EMPAREG (2015) N=7020 |
37 |
TFG: 82mL/min/1.73m2
HbAlc: 8.1%
40% con
micro/macroalbuminuria |
Empagliflozina |
Placebo |
Empagliflozina ↓ riesgo de incidencia o empeoramiento de la nefropatfa, progresión a macroalbuminuria, duplicación de la crs o tiempo hasta la insuficiencia renal |
CANVAS (2017)
N= 10142 |
43 |
TFG: 82mL/min/ 1.73m2
HbAlc: 8.2%
UACR: 12.3mg/g |
Canagliflozina |
Placebo |
Canagliflozina ↓ progresión de la albuminuria y riesgo de reducci6n de la TFGe, insuficiencia renal o muerte par enfermedad renal |
CREDENCE (2019)
N=4401 |
31 |
TFG: 56mL/min/ 1.73m2
HbAlc: 8.3%
UACR: 923mg/g |
Canagliflozina |
Placebo |
Canagliflozina ↓ riesgo de duplicar la sCr, insuficiencia renal o muerte par causas renales o cardiovasculares |
| LEADER (2016) N=9340 |
46 |
TFG: 80ml/min/ 1.73m2
HbAlc: 8.7%
37% con micro/macroalbuminuria |
Liraglutide |
Placebo |
Liraglutide ↓ riesgo de macroalbuminuria persistente de nueva aparición, duplicación de crs, insuficiencia renal, muerte par causas renales |
REWIND (2019)
N=9901 |
65 |
TFG: 77mL/min/ 1.73m2
HbAlc: 7.3%
35% con micro/macroalbuminuria |
Dulaglutide |
Placebo |
Dulaglutida ↓ riesgo de nueva macroalbuminuria, disminución de la TFG en un 30% e insuficiencia renal |
Tabla 1. Ensayos clínicos de diversos fármacos en ERD.
La ERD es la primera causa de enfermedad renal terminal a
nivel mundial; aproximadamente la mitad de los pacientes con
DMT2 y hasta un tercio de los pacientes con DMT1 desarrollarán
enfermedad renal crónica la cual se caracteriza por un descenso
de la tasa de filtración glomerular estimada y/o un aumento en
la albuminuria. El tratamiento estándar para la enfermedad renal
diabética se compone de un conjunto de acciones destinadas
al adecuado manejo de su etiología como el adecuado control
glicémico y el control de otros factores de riesgo como el
sobrepeso, la tensión arterial, la dislipidemia y reducción en
el consumo de alcohol y tabaco; dentro de las estrategias
farmacologías se dispone de un arsenal de medicamentos
que procuran la regulación del sistema renina-angiotensinaaldosterona
con el fin de disminuir los cambios a nivel glomerular
que llevan al deterioro de la tasa de filtración glomerular y
progresión de la albuminuria. A pesar del adecuado tratamiento,
un porcentaje no despreciable de pacientes con enfermedad
renal diabética progresan a estadios terminales con necesidad de
terapia de reemplazo renal si no mueren de forma temprana por
causas cardiovasculares por lo que es importante la búsqueda
de una terapia multimodal efectiva que disminuya el riesgo de
progresión de la enfermedad renal diabética residual.
En el presente artículo se realiza una revisión inicial de la
enfermedad renal diabética y su fisiopatología recalcando la
importancia del sistema renina-angiotensina-aldosterona para
posteriormente revisar la utilidad del finerenone como nueva
terapia en la enfermedad renal.
Enfermedad Renal Diabetica
S La enfermedad renal diabética es una complicación microvascular
de la Diabetes Mellitus que se caracteriza por la presencia de
una alteración en la función renal en exclusión de otras causas de
enfermedad renal crónica. De acuerdo con las últimas guías de la
Asociación Americana de Diabetes, el diagnóstico se basa en los
hallazgos de una TFGe disminuida <60 ml/min/1.73m2 y/o excreción
de albúmina urinaria, determinada por un Índice Albuminuria-
Creatinuria (UACR por sus siglas en inglés) aumentada ≥30 mg/g por
más de 3 meses, sin embargo, debido a la alta variabilidad biológica
entre las mediciones en la excreción de albúmina urinaria, dos de
tres muestras de UACR recolectadas dentro de un período de 3 a
6 meses deben ser anormales antes de considerar que un paciente
tiene albuminuria elevada [3,4].
La biopsia renal es la piedra angular para el diagnóstico de
nefropatía diabética, sin embargo, esta solo se lleva a cabo en
circunstancias específicas como son los casos de disminución
rápida de la TFG, la presencia de sedimento urinario activo,
signos y síntomas de otras enfermedades sistémicas, albuminuria
rápidamente progresiva, proteinuria en rango nefrótico y/o
ausencia de retinopatía diabética [5]; en el resto de los casos
basta el deterioro de tasa de filtración glomerular y la presencia
de albuminuria significativa para establecer el diagnóstico de la
enfermedad.
Fisiopatología de ERD
La hiperglicemia persistente es el principal desencadenante de la
ERD; la interacción entre los altos niveles de glucosa intracelular y
los grupos amino libres de las proteínas, lípidos y ácidos nucleicos
resulta en la formación de productos finales de la glicación
avanzada (AGE) que inducen muchos de los cambios patogénicos
en el desarrollo de la ERD [6].
La inflamación y el estrés oxidativo también se ven implicados
en el modelo fisiopatológico de la ERD aumentando la fibrosis y glomeruloesclerosis con un aumento en la expresión de los
factores proinflamatorios como proteína quimio atrayente
de monocitos-1 (MCP-1), osteopontina (OPN) y factor de
crecimiento transformante ß (TGF-ß), además, se encuentra
una sobreexpresión del receptor de mineralocorticoide y una
mayor señalización de aldosterona quien aumenta el factor
inflamatorio NF-κB provocando la estimulación de factores de
crecimiento necesarios para la diferenciación y proliferación de
fibroblastos y células epiteliales mesangiales y tubulares en el
riñón; adicionalmente la aldosterona también induce la síntesis
de citocinas profibróticas y causa estrés oxidativo en el riñón
llevando a deterioro de la TFG y aumento de la proteinuria [7].
Estrategias terapéuticas en ERD
El tratamiento de ERD se basa en evitar su progresión y detener
el deterioro de la TFG y la albuminuria para lo cual se debe tener
en cuenta inicialmente la importancia de los cambios en el estilo de vida con un énfasis en el control de los factores de riesgo
y, en segundo lugar, el uso de estrategias farmacológicas que
previenen la progresión y el daño a nivel renal.
Mantener un adecuado control glicémico es crucial para el
control de ERD y diferentes estudios han mostrado que lograr
las metas de glucosa disminuye la ocurrencia de complicaciones
microvasculares incluida la ERD; dentro de los estudios pivotales,
el estudio Diabetes Control and Complications Trial (DCCT)
demostró una reducción del 39% en la tasa de albuminuria grado
I y una reducción del 54% en la albuminuria grado II con meta de
Hemoglobina Glicada (HbA1c) <6% vs 9% en DM1 sin enfermedad
renal diabética [8], mientras que el estudio UKPDS demostró que
el control intensivo de la glicemia reduce significativamente las
complicaciones microvasculares en diabéticos tipo 2 [9].
En cuanto al manejo farmacológico, el bloqueo del Sistema
Renina-Angiotensina-Aldosterona (RAAS) es uno de los pilares del
manejo de la enfermedad renal diabética y su efecto se explica principalmente por la disminución de la presión intraglomerular
con impacto en la disminución de la lesión por hiperfiltración y de
la albuminuria, siendo este último uno de los principales objetivos
del tratamiento. Los inhibidores de la ECA o ARA II son los
fármacos de primera línea para el tratamiento de la hipertensión
arterial en pacientes con diabetes con TFGe <60 ml/min/1,73
m2 y UACR ≥300 mg/g debido a sus beneficios en la prevención
de la progresión de la ERD y su efecto antiproteinurico; ensayos
clínicos han demostrado la eficacia del tratamiento con el
bloqueo del RAAS empezando en 1993 con el Collaborative study
group en pacientes en pacientes con DMT1 [10] donde captopril
disminuyó la duplicación de la creatinina sérica en un 43%. En
pacientes con DMT2 los estudios IDNT con irbersartán frente
a amlodipino [11] y RENAAL [12] con losartán comparado con
placebo disminuyeron la progresión de la enfermedad renal en
un 20%. En el contexto de niveles más bajos de albuminuria (30-
299 mg/g), se ha demostrado que el tratamiento con inhibidores
de la ECA o ARA II reduce la progresión a albuminuria más
avanzada (≥300 mg/g) y los eventos cardiovasculares, pero no la
progresión a enfermedad renal terminal.
En cuanto a los medicamentos más recientes para el tratamiento
de la Dm2, el uso de inhibidores SGLT2 ha demostrado su efecto
cardioprotector y renoprotector independiente de su efecto en
el control de la hiperglicemia con resultados demostrados en
diferentes ensayos como el EMPAREG con empagliflozina [13]
que logró disminuir el riesgo residual (RR) para desarrollo de
nefropatía en un 39% y el riesgo de duplicación de creatinina en
44%, de igual forma el estudio CANVAS [14] con canagliflozina
redujo la progresión de albuminuria en un 27% y disminuyó el
desenlace de compuesto renal en 40%, mientras que el estudio
CREDENCE (2019) con canagliflozina, en 4.401 pacientes con
DMT2, UACR ≥300 mg/g y TFGe media de 56 ml/min/1,73
m2 con un promedio de albuminuria de más de 900 mg/día,
evaluó como desenlace principal el compuesto cardiorrenal de:
falla renal, duplicación de la creatinina sérica y muerte renal o
cardiovascular detenido tempranamente debido a la eficacia
demostrada con una reducción del riesgo del 32% para el
desarrollo de enfermedad renal terminal versus el grupo control
[15]. Por la anterior evidencia, se concluye que este grupo de
medicamentos disminuye el riesgo de empeoramiento de la
enfermedad renal, progresión de la microalbuminuria, muerte
de causas cardiovasculares y aumenta el tiempo hasta desarrollo
de enfermedad renal terminal [16].
En cuanto a los análogos de GLP1, también se ha postulado
su impacto en la disminución de la progresión de la ERD
independiente de su efecto sobre la hiperglicemia, en los
estudios LEADER con liraglutida [17], REWIND con dulaglutida
[18] y el estudio SUSTAIN-6 con semaglutida [19] se evidencio
una disminución en el riesgo de desarrollo de macroalbuminuria,
progresión a fallo renal, disminución de la TFG en un 30% y
muerte por causa renal.
Antagonista Mineralcorticoide Y Su Rol En Erd
El Sistema Renina-Angiotensina-Aldosterona (SRAA) se encuentra regulado por la secreción de renina desde la zona granular del
aparato yuxtaglomerular que se desencadena por tres principales
vías fisiológicas:
1. Estímulo simpático de los receptores β1 del aparto
yuxtaglomerular,
2. Reducción de la llegada de sodio al túbulo contorneado distal
detectado por la mácula densa y
3. Una presión de perfusión reducida en el riñón detectada por
los baroreceptores de las arteriolas aferente.
La secreción de renina se inhibe por la liberación de BNP y NTproBNP
desde el tejido cardíaco en respuesta a la distensión
de las cámaras cardíacas con el aumento del volumen
sanguíneo. El efecto enzimático de la renina produce clivaje
del angiotensinógeno a angiotensina I (ATI) quien a su vez es
convertida en angiotensina II (ATII) por la ECA producida por las
células endoteliales en los pulmones y riñón. La AT II estimula 2
diferentes receptores acoplados a proteínas G transmembrana,
regulando de esta forma la tasa de filtrado glomerular y excreción
de sodio a través de la vasoconstricción de las arteriolas aferentes
y eferentes, la liberación de aldosterona desde la corteza adrenal,
la liberación de adrenalina y ADH resultando en un aumento de
la reabsorción de sodio, excreción de potasio, elevación de la
presión hidrostática para aumento de la TFG, reabsorción desde
los túbulos colectores e incremento del volumen circulante.
La aldosterona actúa directamente sobre las bombas de Na/K/
ATP-asa de la membrana basolateral de las células principales del
riñón [20], sin embargo, los receptores de mineralocorticoides
(RM) están presentes en múltiples tejidos, incluyendo células de
músculo liso vascular y endotelial, cardiomiocitos, fibroblastos,
riñón (células mesangiales y podocitos), adipocitos, macrófagos
y cerebro (hipotálamo), activando la remodelación en respuesta
a la inflamación y daño. Esta amplia distribución explica por qué
la aldosterona ejerce múltiples efectos cardíacos, vasculares y
renales que incluyen disfunción endotelial, vasoconstricción,
natriuresis, retención de K +, activación simpática, remodelación
adversa cardiovascular (hipertrofia, fibrosis) y renal (esclerosis
glomerular y tubular) y estrés oxidativo; aumenta el estrés
vascular, la rigidez y ejerce efectos proarrítmicos, proinflamatorios
y protrombóticos [21].
Los antagonistas del receptor mineralocorticoide (ARM)
bloquean directamente el receptor inactivando la acción de la
aldosterona e impidiendo la respuesta genómica y no genómica
de la interacción con el receptor, disminuyendo así el grado de
inflamación y remodelación en el corazón y riñón (Tabla 2).
| Datos Preclínicos |
Arm Esteroides |
Finerenone |
| Espironolactona |
Esplerenona |
| Propiedades estructurales |
Plano (esteroide) |
Plano (esteroide) |
Voluminoso (no
esteroideo) |
| Potencia a MR |
Elevado |
Moderado |
Elevado |
| Selectividad a MR |
Bajo |
Moderado |
Elevado |
| Reclutamiento de cofactores |
Reclutamiento de cofactor agonista parcial |
Reclutamiento de cofactores agonistas
parciales |
Agonista inverso (es decir,inhibe la unión del
cofactor) |
| Penetración del SNC |
Sí |
sí |
No basado en datos preclínicos |
| Efectos secundarios sexuales |
Sí (ginecomastia) |
Menos de espironolactona |
Sin señalen estudios de
fase II |
| Hiperpotasemia |
Sí |
sí |
Moderadamente
aumentado |
| Distribución de tejidos |
Riñón> corazón (almenos
6 veces) |
Riñón> corazón (- 3
veces) |
Equilibrado riñón:corazón (1:1) |
| Basado en datos preclínicos y el programa ARTS fase II |
Tabla 2. Farmacocinética y farmacodinamia de ARM.
Los ARM se clasifican en selectivos o no selectivos según su
composición química; los primeros son no esteroideos, mientras
que los segundos contienen un anillo de esteroide en su composición.
Los ARM no selectivos de primera generación (espironolactona) se
utilizan para inhibir los efectos mineralocorticoides sin embargo
por su composición esteroidea también inhiben los efectos de los
andrógenos como testosterona y dihidrotestosterona llevando al
desarrollo de ginecomastia, sensibilidad mamaria y feminización, de
ahí que la espironolactona también se use en el manejo del acné
y síndrome de ovario poliquístico. Los ARM también tienen amplia
evidencia en el manejo de enfermedades cardiovasculares como por ejemplo en el campo de la falla cardíaca con FEVI reducida, la
HTA refractaria, hiperaldosteronismo, ascitis secundaria a cirrosis y
la hipocalemia.
Por su mecanismo de acción, los ARM se han propuesto
como agentes terapéuticos en los pacientes con albuminuria,
principalmente aquellos con excreción de albumina urinaria
>1 gramo/día. Diferentes ensayos clínicos y metaanálisis
evaluando la espironolactona objetivan la reducción de la
proteinuria y progresión de la enfermedad renal diabética. Sin
embargo, el efecto de la espironolactona sobre la albuminuria
es variable, con descensos del 15 al 60% en estudios que
variaron entre 4 y 52 semanas de duración, además debe
recordarse que est4e medicamento no es selectivo para RM y,
por lo tanto, su uso se ve limitado por los efectos secundarios
sexuales [22].
Por otro lado, la eplerenona es un ARM esteroideo más selectivo,
con una afinidad mínima por los receptores de progesterona y
andrógenos, lo que reduce los efectos adversos relacionados con
el eje gonadal, sin embargo, tiene una potencia 20 a 40 veces
menor que la espironolactona [23].
Los ensayos clínicos que evalúan desenlaces renales en pacientes
con ERD y uso de ARM generalmente se limitan a estudios
pequeños a corto plazo en los que se experimentaron una alta
tasa de efectos secundarios como hiperpotasemia, ginecomastia
y otros efectos secundarios relacionados con las hormonas
sexuales, como se describió anteriormente. Dados los efectos
secundarios de los ARM no selectivos actualmente se han seguido
estrategias para diseñar ARM más selectivos con el objetivo de
mejorar la relación entre eficacia y seguridad. Algunos ARM de
nueva generación son no esteroides y su estructura se basa en
una cadena principal de dihidropiridina con ausencia de actividad
sobre los canales de calcio de tipo L a nivel de musculo, de estos
medicamentos el finerenone ha mostrado resultados alentadores
en ensayos clínicos fase III y se ha posicionado en los últimos años
como un probable fármaco para obtener el beneficio terapéutico
máximo en ERD.
Farmacologia Y Farmacodinamia De Finerenone
Cada vez hay mayor evidencia que muestra como la sobre
activación del receptor de mineralocorticoides lleva a
inflamación y fibrosis, proceso clave en el desarrollo y progresión
de la enfermedad renal que a su vez se asocia a mayor riesgo
cardiovascular. Finerenone es un nuevo antagonista selectivo de
los receptores de mineralocorticoides no esteroideo con una alta
afinidad por el receptor que lleva a una reducción de la inflamación
y fibrosis en varios modelos animales. Así mismo se han llevado
a cabo estudios de Fase II para evaluación de finerenone en la
reducción de albuminuria y asociación con eventos adversos,
encontrando que este medicamento tiene un muy buen perfil de
seguridad, con menor producción de hiperkalemia comparado
con espironolactona.
Mecanismo De Acción
Espironolactona y eplerenona son antagonistas competitivos
que se unen al dominio de unión del ligando, evitando que los
receptores de mineralocorticoides adopten la conformación
activa y los vuelven transcripcionalmente inactivos, es decir,
producen un antagonismo "pasivo", sin embargo estos 2
medicamentos son incapaces de estabilizar la hélice (H12) en el
dominio de activación en el extremo C-terminal del receptor y
no puede evitar que la hélice (H12) adopte la conformación de
agonista, esto explica la actividad agonista parcial de los ARM no
selectivos y los efectos adversos asociados a su ingesta [23].
Finerenone, cuya fórmula molecular es C21H22N4O, es un potente
antagonista no esteroideo, voluminoso, potente y altamente
selectivo que se une fuertemente al RM actúando como un
antagonista pasivo al acoplarse al dominio de unión al ligando del
RM con una acomodación diferente en comparación con los ARM
esteroideos, lo que lleva a la formación de una protuberancia de
la hélice 12 en el dominio 2 en el extremo C-terminal del receptor
de mineralocorticoides. Esta protuberancia forma un complejo
ligando-receptor de mineralocorticoides inestable incapaz de reclutar factores transcripcionales, cambiando la estabilidad,
la translocación nuclear y la activación del receptor de
mineralocorticoides, llevando a una rápida degradación de este.
De esta forma, finerenone disminuye la acumulación nuclear de
receptores de mineralocorticoides de forma más eficaz que la
espironolactona, inhibe el reclutamiento de los receptores de
mineralocorticoides en las secuencias diana de ADN y suprime el
reciclaje de los receptores de mineralocorticoides [22].
Se ha demostrado in vitro que finerenone reduce la proliferación
de células de músculo liso inducida por aldosterona en una manera
dosis dependiente. En un modelo preclínico de hipertensión en
ratas no uninefrectomizadas, finerenone a dosis de 1 mg/kg
disminuyó significativamente la hipertrofia cardíaca y renal, el
daño glomerular y tubulointersticial, los niveles de pro-BNP y la
expresión de varios genes de biomarcadores de remodelación y
profibróticos renales (PAI 1, MCP-1, osteopontina, MMP-2) en
comparación con placebo, sin disminuir la presión arterial. El
finerenone se une a las glucoproteínas ácidas alfa-1, se metaboliza
a través de CYP3A4 (90%) y CYP2C8 (10%) y la eliminación
renal representa sólo el 0,57% del fármaco inalterado incluso
en individuos con insuficiencia renal [22,24]. La acumulación
renal reducida y el aclaramiento renal mínimo sugieren que
finerenone puede presentar una seguridad más favorable que
otros antagonistas de los receptores de mineralocorticoides en
pacientes con insuficiencia renal.
Efectos de finerenone sobre el potasio
Datos de ensayos de fase II con finerenone en pacientes con falla
cardíaca y DMT2 han demostrado que tiene un bajo impacto en
los niveles de potasio y que su uso no se ve limitado por menores
tasas de filtración glomerular. Se desconoce el motivo de los
efectos mínimos que tiene el finerenone en los niveles de potasio
sérico sin embargo podría estar relacionado a un modelo distinto
de interacción con el receptor de mineralocorticoides con menor
reclutamiento de cofactores, corta vida media plasmática y una distribución tisular más uniforme entre riñones y corazón a
diferencia de la eplerenona y espironolactona que se concentran
en mayor cantidad en los riñones [23,25].
El programa clínico ARTS, (Mineralocorticoid Receptor antagonist
tolerability study) [26] que incluyó más de 2000 pacientes,
diseñado para evaluar la seguridad y eficacia del finerenone
en pacientes con DMT2 y enfermedad renal diabética con o
sin falla cardíaca demostró que el finerenone se asoció con
menor ocurrencia de hiperkalemia (definida por K>5.6 mEq/l)
comparado con espironolactona con similar efectividad en la
disminución de los niveles de NT pro-BNP y de UACR en pacientes
con falla cardíaca crónica (Figura 2).
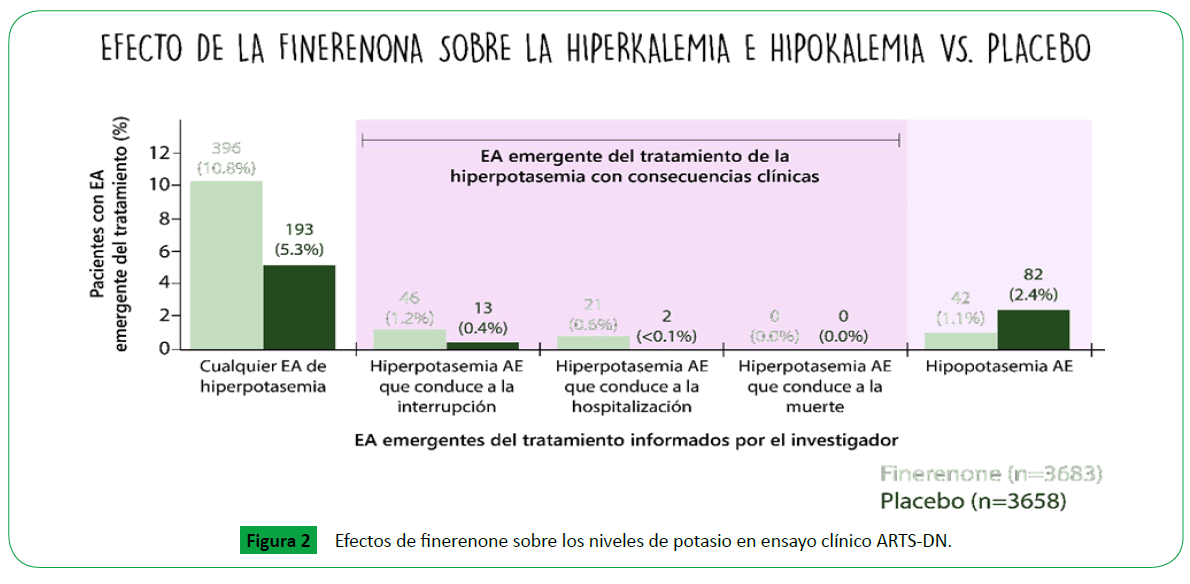
Figure 2: Efectos de finerenone sobre los niveles de potasio en ensayo clínico ARTS-DN.
En el estudio ARTS-HF (ARTS -Heart Failure) [27] ensayo fase IIb
en pacientes con hospitalización en los últimos 7 días por falla
cardíaca descompensada, el finerenone redujo los niveles de
NT proBNP similar a la eplerenona y con mayor reducción en
desenlaces como muerte por cualquier causa, hospitalización
por causa cardiovascular, descompensación de la falla cardíaca
comparado con eplerenone con menor incremento en los niveles
de potasio (K >5.6 mEq/l). Finalmente, en el estudio ARTS-DN
(ARTS Diabetic Neprhopathy) de 823 pacientes con DMT2 y
albuminuria (UACR >30 mg/g) en tratamiento con IECA o ARA II
evaluó la seguridad de la administración de finerenone en dosis
de 20 mg encontrando una reducción dosis dependiente en la
albuminuria de 25-38% comparado con placebo a los 90 días
con efecto mínimo sobre el potasio (hipercalemia 2.1% vs 0%
) y sobre las cifras tensionales sin documentarse cambios en la
Hba1c con finerenone (Figura 3 )[28].
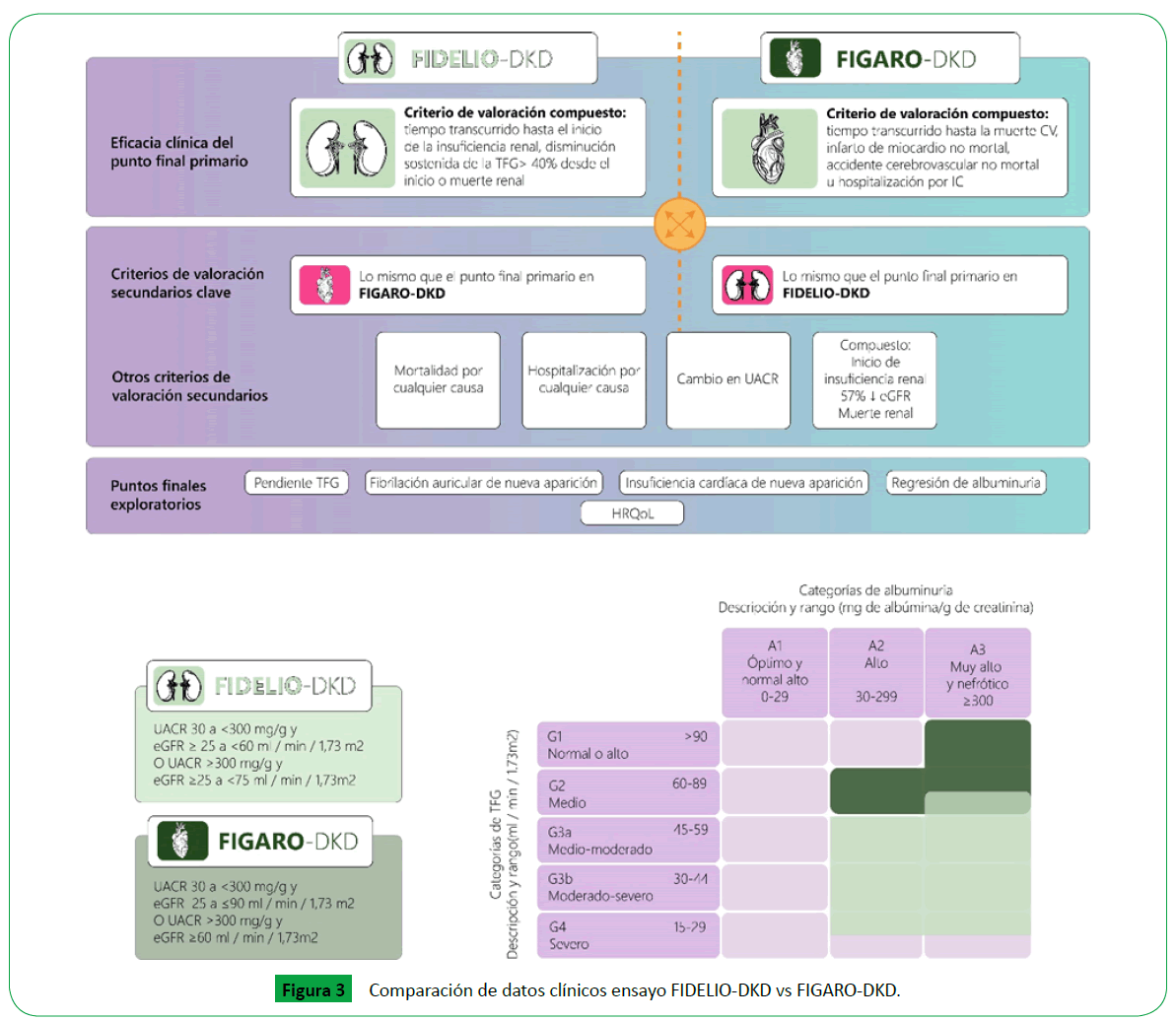
Figure 3: Comparación de datos clínicos ensayo FIDELIO-DKD vs FIGARO-DKD.
Evidencia de finerenone en erd: Fidelio-DKD y
Figaro-DKD
Los ensayos FIDELIO-DKD y FIGARO-DKD constituyen 2 grandes
estudios clínicos fase III, multicéntricos, internacionales, doble
ciego, aleatorizado, controlados por placebo (FIDELIO n= 5674 y FIGARO n=7354) que buscaban evaluar la eficacia y seguridad de
finerenone en la reducción de la progresión de la enfermedad
renal y eventos cardiovasculares mayores en pacientes con
enfermedad renal diabética y DMT2.
Los pacientes elegibles en el estudio FIDELIO y FIGARO consistían
en adultos mayores de 18 años con DMT2 y enfermedad renal
diabética en tratamiento con dosis máxima tolerada de IECA o
ARA II y niveles de potasio menor de 4.8mmol/L.
La enfermedad renal diabética fue definida por cualquiera de
los 2 siguientes criterios:
1. Albuminuria moderada, persistente (UACR 30 a < 300 mg/
gr) o TFG por CKD-EPI de 25 a 60 ml/min/1.73 m2) e historia de
nefropatía diabética o,
2. Albuminuria persistente severa (UACR 300 a 5000 mg/gr) y una
TFGe entre 25 y 75 ml/min/1.73 m2 [29].
En el estudio FIGARO los criterios de elegibilidad
variaron considerándose:
1. Albuminuria severamente elevada (UACR> 300 mg/gr) y TFGe
> 60 ml/min /1.73 m2
2. TFGe de 25 - 90 ml/min/1.73 m2 y albuminuria moderadamente
elevada, persistente (UACR< 300 mg/gr) [30].
Los pacientes fueron asignados de forma aleatoria en una
proporción de 1:1 para recibir placebo o finerenone oral en dosis
inicial de 10 mg una vez al día en caso de TFGe < 60 ml/min que
se titularía a la dosis de 20 mg/ día cada mes siempre y cuando
los niveles de potasio fueran menores de 4.8 mmol/L; caso
contrario la dosis de finerenone debía mantenerse/disminuirse
a la de 10mg OD. Aquellos con TFG >60 ml/min al momento
de la aleatorización recibían una dosis de 20 mg al día que se
disminuiría a 10mg en caso de hiperkalemia (K>4.8mmol/L); en
las visitas de seguimiento cada 4 meses hasta la culminación del estudio (2.6 años y 3.4 años respectivamente) se recomendaba
la suspensión de finerenone si los niveles de potasio se elevaban
por encima de 5.5 mmol/L.
El desenlace primario evaluado en FIDELIO-DKD es un compuesto
de tiempo hasta la ocurrencia de fallo renal, definido como el inicio
de terapia de reemplazo renal en 90 días, trasplante renal o una
tasa de filtración glomerular sostenida <15 ml/min/1.73 m2 durante
al menos 4 semanas. En el FIGARO-DKD los desenlaces primarios
y secundarios fueron los mismos del FIDELIO-DKD sin embargo,
otros desenlaces secundarios evaluados fueron mortalidad general,
reducción de albuminuria y hospitalización por cualquier causa.
En el estudio FIDELIO se encontró que los pacientes tratados
con finerenone tuvieron una incidencia más baja para el
desenlace primario renal con menor ocurrencia de disminución
de la TFGe de al menos 40% y menor tasa de muerte de causas
renales que el grupo control (17.8% vs 21.1% HR 0.82; IC 95%
0.73-0.93; p=0.001) con un NNT de 29 a 3 años para prevenir
1 evento, adicionalmente los pacientes del estudio FIDELIO
tuvieron un menor riesgo de frecuencia del desenlace secundario
cardiovascular (13% vs 14.8 HR 0.86 ; IC 95% , 0.75 a 0.99; p= 0.03)
con un NNT de 42 a 3 años. Resultados exploratorios mostraron
la asociación de finerenone con una mayor reducción de UACR
a los 4 meses comparado con placebo (HR: 0.69; 95% IC, 0.66 A
0.71) resultado que se mantuvo durante todo el estudio. Un total
de 8.9% de pacientes en el grupo de finerenone y 11.5% en el
grupo placebo desarrollaron un evento del desenlace secundario
renal que incluía fallo renal, disminución sostenida >57% de la
TFG o muerte de causa renal HR 0.76; IC 0.65 a 0.90.
La incidencia de eventos adversos que ocurrieron durante el
estudio fue similar para ambos grupos, siendo del 31.9% en el
grupo de finerenone y 34.3% en el grupo placebo. Para eventos
adversos asociados a hiperkalemia se encontró que fue 2 veces
más frecuente con finerenone que con placebo (18.3% vs 9.0%),
con una tasa de descontinuación por hiperkalemia (K>5.5 mmol/l)
mayor en el grupo de finerenone (2.3% vs 0,9%). Sin embargo,
no se reportó ningún caso de hiperkalemia fatal. La máxima
diferencia fue de 0.23 mmol/L durante todo el estudio. En cuanto
a las cifras de tensión arterial, HbA1c o peso, no se encontró un
cambio importante con el uso de finerenone vs placebo.
En el estudio FIGARO el punto primario compuesto cardiovascular
(que representa el punto secundario de eficacia en FIDELIO)
definido por la incidencia de muerte de causa cardiovascular,
IAM no fatal, ACV no fatal u hospitalización por falla cardíaca
fue significativamente más baja en el grupo de finerenone vs
placebo (12.4% vs 14.2% HR, 0.87; IC 95% 0.76 a 0.98 p=0.03) con
un NNT de 47. La incidencia de enfermedad renal terminal fue
menor con finerenone y ocurrió en 32 pacientes vs 49 en el grupo
placebo (0.9% vs 1.3%, HR 0.64, IC 0.4 a 0.955), la reducción de
la UACR también fue 32% mayor en el grupo de finerenone.
Con respecto a los eventos adversos la incidencia fue similar
en ambos grupos (31.4% vs 33.2%). Al igual que en FIDELIO,
la incidencia de hiperkalemia fue mayor con finerenone que
con placebo (10.8% vs 5.3%) observándose una diferencia en
los niveles de potasio de ambos grupos de 0.16 mmol/L que
permaneció estable durante todo el estudio, no hubo casos
de muerte y pocos llevaron a descontinuación del tratamiento (1.2% vs 0.4%), la ginecomastia fue muy poco reportada y
similar en ambos grupos. Con respecto al impacto sobre cifras
tensionales la PAS fue -3.5 mmHg al mes 4 y -2.6 mmHg al mes
24. El promedio de hemoglobina glicada fue similar en ambos
grupos durante todo el estudio.
Fidelidad
Con resultados no publicados oficialmente hasta la fecha de
redacción de esta revisión, se dieron a conocer datos preliminares
del estudio FIDELITY en el congreso de la European Society of
Cardiology 2021.
FIDELITY es un análisis preespecificado de los datos del total de
ambos estudios FIDELIO DKD y FIGARO DKD que en conjunto
abordan 13717 pacientes evaluando los desenlaces de eficacia
durante un período de seguimiento de 3 años. Se observó que
el uso de finerenone redujo de forma significativa el desenlace
primario cardiovascular (12.7% vs. 14.4%; HR 0.86 (IC95% 0.78-
0.95); p=0.0018) con un número necesario a tratar (NNT) de 46.
Para el desenlace renal, finerenone redujo el riesgo de descenso
de TFGe ≥57% en un 23% en relación con el placebo, con una
diferencia estadísticamente significativa entre los subgrupos
analizados (5.5% vs. 7.1%. HR 0.77 (IC 95% 0.67-0.88); p=0.0002)
y con un NNT=60, sin observarse una reducción estadísticamente
significativa de la mortalidad asociada a causa renal. En cuanto
a eventos adversos y ocurrencia de hiperkalemia los resultados
fueron similares en ambos grupos finerenone vs placebo con una
frecuencia de hiperkalemia de 14% para finerenone vs 6.9% (HR
0.86; IC 95%, 0.78-0.95; p=0.0018); la hiperkalemia que llevó a
suspensión del medicamento fue de 5.5% para finerenone vs
7.1% en el grupo placebo (HR 0.77; IC 95%, 0.67-0.88; p=0.0002).
El riesgo de eventos cardiovasculares y falla cardíaca aguda en
los pacientes diabéticos incrementa de forma proporcional con el
aumento de la UACR y la disminución de la TFGe < 75 ml/min/1.73
m2. Es de destacar que los resultados observados con finerenone
se presentaron en el contexto de terapia médica estándar titulada
a dosis máximas toleradas con al menos un agente bloqueador del
RAAS como IECA O ARA II y que algún porcentaje de los pacientes
recibía adicionalmente manejo con ISGLT2 o GLP1 lo que nos
permite concluir que el uso de finerenone en adición al bloqueo
del RAAS permite disminuir el efecto de escape de aldosterona
que puede existir en los pacientes diabéticos permitiendo una
reducción aún mayor de la progresión de la enfermedad renal
diabética y la albuminuria con adecuado impacto sobre el riesgo
residual y un buen perfil de seguridad incluyendo el riesgo de
hiperkalemia (IECA+ ARA II 9.2%).
En el estudio FIDELIO-DKD, finerenone mejoró resultados renales
en pacientes con enfermedad renal diabética en estadios 3 y 4 y
albuminuria severa, población de muy alto riesgo cardiovascular
mientras que en el estudio FIGARO se demostró que los pacientes
con ERD en estadios 2 a 4 con albuminuria moderadamente
elevada o ERD estadios 1 y 2 con albuminuria severamente
elevada tratados con finerenone tienen menor riesgo de
mortalidad y morbilidad cardiovascular.
Actualmente existe limitada evidencia que soporte el uso de
medicamentos para mejorar los resultados cardiorrenales en
pacientes con enfermedad renal diabética menos avanzada por lo que este estudio clínico hace aportes llamativos al respecto
y resulta una opción terapéutica atractiva en enfermedad renal
diabética con albuminuria persistente a pesar del manejo estándar
y también en aquellos pacientes con TFGe menor de 50 ml/min
y alto riesgo de hiperkalemia. Es por esto que consideramos que
finerenone es un medicamento que, a la luz de los más recientes
estudios, reduce el riesgo de progresión de la enfermedad renal
diabética, enfermedad renal terminal, albuminuria, progresión
a terapia de reemplazo renal y muerte de causas renales y que
además tiene un efecto protector cardiovascular al reducir
el riesgo de muerte de origen cardiovascular, IAM no fatal y
hospitalización por falla cardíaca.
Conclusion
La complicación microvascular más frecuente de la diabetes
mellitus es la enfermedad renal diabética que se caracteriza por
deterioro de la TFGe y/o presencia de albuminuria (UACR>30
mg/g). Dentro de sus principales mecanismos fisiopatológicos
se destaca la hiperreactividad de los receptores de
mineralocorticoides y aumento de actividad del RAAS que lleva
a un estado inflamatorio permanente con secreción de factores
de transcripción como el TGF Y NF Kb que llevan a un aumento
del estrés oxidativo y aumento de la actividad de fibroblastos
ocasionando fibrosis y daño de la membrana basal glomerular.
Mediante medidas de control de factores de riesgo y control sobre
el RAAS se ha logrado disminuir la progresión de la ERD en una
proporción de pacientes, sin embargo, el riesgo residual persiste
con un porcentaje no despreciable de pacientes que progresan en
su enfermedad renal o presentan desenlaces cardiovasculares.
Con la creación de la nueva molécula finerenone, se responde
a una necesidad insatisfecha en los pacientes con enfermedad
renal y diabetes, los estudios de fase 2 y fase 3 como el FIDELIO
DKD y el FIGARO DKD y el más reciente análisis FIDELITY han
logrado demostrar el impacto que tiene el uso de finerenone
sobre reducción de la progresión de ERD, disminución de la
albuminuria, reducción de la mortalidad y riesgo cardiovascular
con un adecuado perfil de seguridad y menor producción de
hiperkalemia en comparación con otros los ARM clásicos lo que
lo convierte en una estrategia segura y eficaz para su uso en
pacientes con ERD.
Referencias
- Castillo GA, Aroca G, Buelvas J, Buitrago AF, Carballo V, Cárdenas JM, et al. Recomendaciones para el manejo del riesgo cardiorrenal en el paciente con diabetes mellitus tipo 2. Rev Colomb Cardiol. 2020; 27:3-22.
Googlescholar, Crossref
- Rico Fontalvo JE. Guía de práctica clínica para la enfermedad renal diabética. Rev Colomb Nefrol 2021; 8:1-156.
Googlescholar, Crossref
- American Diabetes Association. 11. Microvascular complications and foot care: Standards of medical care in diabetes-2021. Diabetes Care 2021; 44:S151-67.
Indexed at, Googlescholar, Crossref
- Cheung AK, Chang TI, Cushman WC, Furth SL, Hou FF, Ix JH, et al. KDIGO 2021 clinical practice guideline for the management of blood pressure in chronic kidney disease. Kidney Int 2021; 99:S1-S87.
Indexed at, Googlescholar, Crossref
- Chaharsooghi SK, Honarvar M, Modarres M. A multi-stage stochastic programming model for dynamic pricing and lead time decisions in multi-class make-to-order firm. Sci Iran 2011; 18:711-21.
Googlescholar, Crossref
- Rico JRF, Anedo RD, Sarabia MR, Galvis NP, Espinosa AB, Gulfo IU, et al. Proteoma urinario en la enfermedad renal diabética. Estado del arte Rev Colomb Nefrol 2021; 8:e546.
Googlescholar, Crossref
- Patel V, Joharapurkar A, Jain M. Role of mineralocorticoid receptor antagonists in kidney diseases. Drug Dev Res 2021; 82:341-63.
Indexed at, Googlescholar, Crossref
- Nathan DM, Genuth S, Lachin J, Cleary P, Crofford O, Davis M, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329:977-86.
Indexed at, Googlescholar, Crossref
- UK Prospective Diabetes Study (UKPDS) Group. Intensive Blood-Glucose Control with Sulfonylureas or Insulin Compared with Conventional Treatment and Risk of Complications in Patients with Type 2 Diabetes (UKPDS 33). Endocrinologist 1999; 352:837-53.
Indexed at, Googlescholar, Crossref
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med 1993; 329:1456-62.
Indexed at, Googlescholar, Crossref
- Lewis EJ, Hunsicker LG, Clarke WR, Berl T, Pohl MA, Lewis JB, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345:851-60.
Indexed at, Googlescholar, Crossref
- Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving H-H, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345:861-9.
Indexed at, Googlescholar, Crossref
- Steiner S. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. Zeitschrift fur Gefassmedizin. 2016.
- Mahaffey KW, Neal B, Perkovic V, De Zeeuw D, Fulcher G, Erondu N, et al. Canagliflozin for Primary and secondary prevention of cardiovascular events: Results from the CANVAS Program (Canagliflozin Cardiovascular Assessment Study). Circulation 2018; 373:2117-28.
Indexed at, Googlescholar, Crossref
- Perkovic V, Jardine MJ, Neal B, Bompoint S, Heerspink HJL, Charytan DM, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019; 380:2295-306.
Indexed at, Googlescholar, Crossref
- Jorge RF, Rodrigo DA, Maria Ximena CB, Victor LM, Emilio AF, Nehomar PG, et al. SGLT2 Inhibitors and nephroprotection in diabetic kidney disease: From mechanisms of action to the latest evidence in the literature. J Clin Nephrol 2020; 4:44-55.
Googlescholar, Crossref
- Marso SP, Daniels GH, Frandsen KB, Kristensen P, Mann JFE, Nauck MA, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375:311-22.
- Gerstein HC, Colhoun HM, Dagenais GR, Diaz R, Lakshmanan M, Pais P, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): A double-blind, randomised placebo-controlled trial. Lancet 2019.
Indexed at, Googlescholar, Crossref
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2016; 394:121-130.
Indexed at, Googlescholar, Crossref
- Lytvyn Y, Godoy LC, Scholtes RA, van Raalte DH, Cherney DZ. Mineralocorticoid antagonism and diabetic kidney disease. Curr Diabetes Rep 2019 38:7.
Indexed at, Googlescholar, Crossref
- Ruilope LM, Tamargo J. Renin–angiotensin system blockade: Finerenone. Nephrol Ther 2017; 13:S47-53.
Indexed at, Googlescholar, Crossref
- Rico-Mesa JS, White A, Ahmadian-Tehrani A, Anderson AS. Mineralocorticoid Receptor Antagonists: a Comprehensive Review of Finerenone. Curr Cardiol Rep 2020; 22:140.
Indexed at, Googlescholar, Crossref
- Vodošek Hojs N, Bevc S, Ekart R, Piko N, Petreski T, Hojs R. Mineralocorticoid receptor antagonists in diabetic kidney disease. Pharmaceuticals (Basel) 2021; 14:561.
Indexed at, Googlescholar, Crossref
- Stockand JD, Meszaros JG. Aldosterone stimulates proliferation of cardiac fibroblasts by activating Ki-RasA and MAPK1/2 signaling. Am J Physiol Heart Circ Physiol 2003; 284:H176-84.
Indexed at, Googlescholar, Crossref
- Erraez S, López-Mesa M, Gómez-Fernández P. Mineralcorticoid receptor blockers in chronic kidney disease. Nefrologia 2021; 41:258-78.
Indexed at, Googlescholar, Crossref
- Pitt B, Kober L, Ponikowski P, Gheorghiade M, Filippatos G, Krum H, et al. Safety and tolerability of the novel non-steroidal mineralocorticoid receptor antagonist BAY 94-8862 in patients with chronic heart failure and mild or moderate chronic kidney disease: A randomized, double-blind trial. Eur Heart J 2013; 34:2453-63.
Indexed at, Googlescholar, Crossref
- Pitt B, Anker SD, Böhm M, Gheorghiade M, Køber L, Krum H, et al. Rationale and design of MinerAlocorticoid Receptor antagonist Tolerability Study-Heart Failure (ARTS-HF): A randomized study of finerenone vs. eplerenone in patients who have worsening chronic heart failure with diabetes and/or chronic kidney disease. Eur J Heart Fail 2015.
Googlescholar, Crossref
- Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Nowack C, et al. Design and Baseline Characteristics of the Finerenone in Reducing Kidney Failure and Disease Progression in Diabetic Kidney Disease Trial. Am J Nephrol 2019; 17:224-32.
Indexed at, Crossref
- Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, et al. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med 2019; 50:333-44.
Indexed at, Googlescholar, Crossref
- Pitt B, Filippatos G, Agarwal R, Anker SD, Bakris GL, Rossing P, et al. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. N Engl J Med. 2021; 385:2252-63.
Googlescholar, Crossref
Competing interests: The authors have declared that no competing interests exist.








