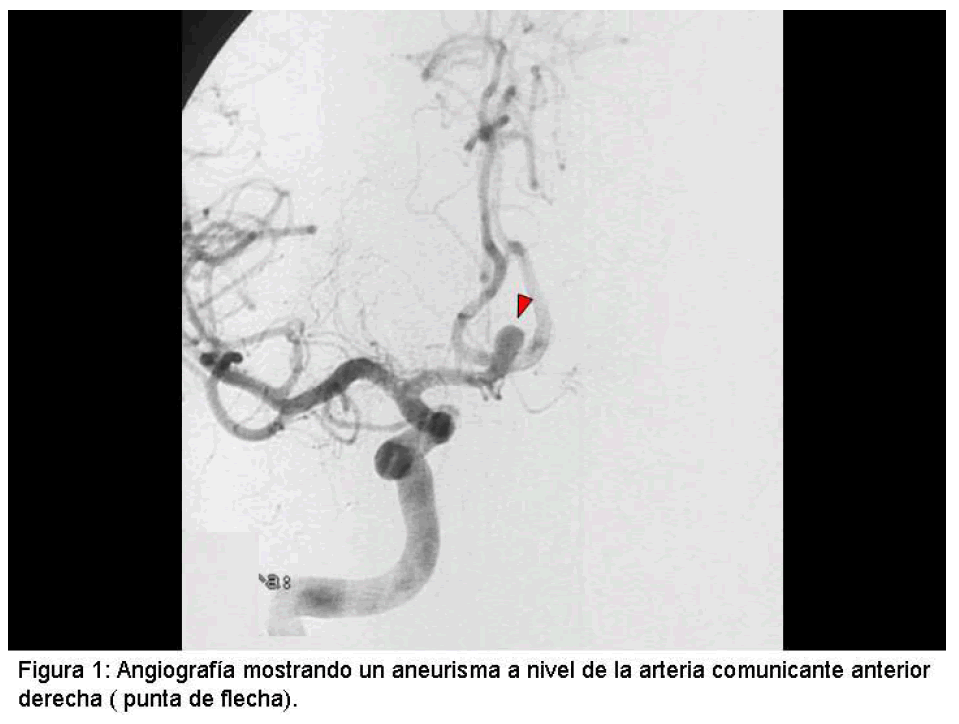
Los aneurismas intracraneales son dilataciones de las arterias cerebrales,
generalmente asintomáticas a lo largo de la vida del paciente, que pueden
romperse y provocar el cuadro clínico característico de la hemorragia
subaracnoidea (HSA). Constituyen un problema de salud importante con una
frecuencia en series autópsicas del 5% (0.2%-0.9%) y una máxima incidencia
entre los 40-60 años predominando ligeramente en el sexo femenino.
En 1995 las muertes por enfermedad cerebrovascular en España supusieron el
11.58% del total, con una tasa cruda de mortalidad de 100 muertes por cada
100.000 personas/año; alrededor de una cuarta parte de ellas fueron debidas
a hemorragia subaracnoidea. Aproximadamente la mitad de los pacientes que
presentan HSA fallecen como consecuencia del sangrado o de complicaciones
secundarias, y la mayoría de los supervivientes requerirán terapias
rehabilitadoras prolongadas. El impacto económico es severo, teniendo en
cuenta la mayor incidencia de esta patología en los años de máxima
productividad de los enfermos. El 80-90% de las HSA son debidas a roturas
aneurismáticas; el 60% de los individuos fallece antes de poder recibir
asistencia sanitaria, en cuanto al resto, un tercio fallece en el hospital, una
sexta parte presentará secuelas graves, y el resto se recuperará
aceptablemente.
Los aneurismas no rotos descubiertos incidentalmente han sido encontrados
más frecuentemente en la arteria carótida interna (64%), comunicante
anterior (12.8%) y cerebral media (6.3%). Por el contrario, los aneurismas
rotos se encuentran con mayor frecuencia en la comunicante anterior (32%),
comunicante posterior (26,4%) y cerebral media (26.2%). [1,2]
Atendiendo a la clasificación de Mohr, hablamos de aneurismas saculares (80-
90%) para referirnos a todas las dilataciones de los vasos cerebrales de causa
desconocida y de aneurismas arterioscleróticos para referirnos a las
formaciones dolicoectásicas que se asocian a enfermedad vascular
ateromatosa grave y amplia. Los aneurismas de origen inflamatorio, como los
asociados a lupus eritematoso sistémico, arteritis de células gigantes o
panarterititis nodosa, son el resultado de la destrucción de la pared vascular
por infiltración linfocítica crónica. En cambio, en los infecciosos, tanto
bacterianos (sifilíticos) como fúngicos (aspergillus, phycomycetos), la
inflamación comienza por la pared de los vasa vasorum de la adventicia, que
aparecen rodeados de células plasmáticas y linfocitos, causando una
periarteritris y endarteritis obliterativa de estos vasa vasorum; progresivamente la capa media se necrosa y se atrofia por isquemia, y
lentamente la capa muscular es sustituida de forma irregular por tejido
conectivo cicatricial. Los aneurismas traumáticos tienen su origen en una
disrupción arterial alrededor de la cual se organiza un hematoma produciendo
un falso aneurisma. Los aneurismas neoplásicos metástasicos se han
relacionado con el mixoma auricular, el coriocarcinoma y el carcinoma
broncogénico indiferenciado, pudiendo desarrollarse incluso tras la resección
del tumor primario. Los aneurismas por radiación tienen una morfología
fusiforme y suele ser proximales, se han descrito especialmente en pacientes
jóvenes que recibieron tratamiento por germinomas o meduloblastomas. [3]
En cambio la patogenia de los aneurismas saculares (AS) permanece incierta;
centraremos el estudio en los AS antes de su rotura, analizando su formación
y crecimiento.
Histológicamente, las arterias se organizan en tres capas concéntricas: la
túnica íntima, es la capa más interna y está constituida por un endotelio de
células escamosas orientadas longitudinalmente; la túnica media compuesta
esencialmente por células musculares lisas dispuestas circularmente; y una
capa externa la túnica adventicia formada por fibroblastos y fibras colágenas
que se funden gradualmente con el tejido conjuntivo laxo perivascular. El
límite entre la túnica íntima y la media viene marcado por la lámina elástica
interna, especialmente desarrollada en las arterias de mediano calibre. Entre
la túnica media y la túnica adventicia se sitúa la lámina elástica externa. [4]
Las arterias durales y cerebrales tienen paredes relativamente finas, con una
elástica interna bien desarrollada pero una túnica media delgada desprovista
de fibras elásticas, y una membrana elástica externa ausente.
El examen microscópico de la porción de la pared vascular de la que surge un
aneurisma no revela anomalías estructurales; la túnica íntima, la membrana elástica interna, la capa muscular y la adventicia, permanecen inalteradas.
Justo en el punto donde se inicia el saco aneurismático, la íntima aparece muy
engrosada, con un recubrimiento interno del saco compuesto por tejido hialino
fibroso sin la presencia de leucocitos. La membrana elástica interna,
desaparece de forma brusca en el cuello del saco y no se vuelve a observar en
ningún punto de la pared del aneurisma. El final de esta membrana es de
borde liso y no escalonado, como ocurre en la arteriosclerosis. La capa
muscular también desaparece de forma abrupta al principio del saco, sin que
exista evidencia de tejido muscular en ningún otro punto. El espesor de la
adventicia es variable, en algunos lugares es más grueso y con marcado
carácter hialino, mientras que en otros no difiere de la normalidad. Nada
indica la presencia de proceso inflamatorio alguno en la pared aneurismática ni
en los tejidos adyacentes, contrariamente a lo que ocurre en los aneurismas
inflamatorios o infecciosos y a lo que propugnaron autores como Handler y
Blumenthal que sugirieron un fenómeno alérgico o infeccioso subclínico por
virus o rickettsias como origen de los aneurismas saculares. [5]
En el fundus, donde se rompen entre el 64 y el 84% de los aneurismas, la
pared está constituida tan sólo por una capa de tejido fibroso hialino que en
ocasiones presenta márgenes imperceptibles con trombos intracavitarios. [6]
Hay que destacar también que se identifican muy escasas fibras de elastina,
responsables de dar flexibilidad y capacidad elástica a la pared, localizándose
la mayoría en la lámina elástica interna con muy pocas a nivel de estrato
medio y adventicia.
La anatomía microscópica de las arterias cerebrales revela tres detalles que
las hacen especialmente vulnerables a la formación de aneurismas: 1) la
túnica media, dónde reside la principal fortaleza de una arteria, es más fina
que en otros vasos de similar calibre (por ejemplo las coronarias); 2) Si bien la elástica interna está bien desarrollada, la externa lo está pobremente o
incluso ausente, siendo ésta clave en el mantenimiento de la pared vascular;
3) Además se encuentran en el espacio subaracnoideo, dónde están
débilmente protegidas por el tejido circundante. [7]
Centrándonos en la túnica media muscular, podemos observar que en casi
todas las zonas de división de las arterias cerebrales, hay un defecto peculiar
en la muscularis, una vaina de tejido conectivo se extiende desde la elástica
interna hasta la adventicia, atravesando la muscular. En asociación con este
defecto, no se aprecia reacción inflamatoria o necrosis tisular. El tejido
conjuntivo que sustituye al músculo no presenta características de tejido
cicatricial, sino que se presenta como una simple continuación de la
adventicia. [8]
Así pues, parece descartarse un origen infeccioso-inflamatorio para explicar
estos defectos; como tampoco parece razonable pensar en un fenómeno
avanzado arteriosclerótico, pues si bien es causa de destrucción de la capa
media, no se han descrito nunca estos defectos sin afectar a la íntima. Los
efectos de la arteriosclerosis son la desaparición de la muscular, el
engrosamiento e hialinización de la adventicia, el aumento de tamaño de la
íntima obstruyendo la luz vascular, y finalmente una elástica interna de
aspecto desgarrado perdiendo su capacidad elástica.
Estos defectos musculares se observan tanto en niños como en adultos, lo que
invita a pensar en un fenómeno congénito y no en un proceso adquirido de
degeneración muscular. En este sentido habría que destacar los trabajos de
Forbus sobre el desarrollo embriológico de la túnica media arterial. Demostró
que la capa muscular de la aorta y la de sus ramas principales se desarrollan
de forma independiente a partir de cúmulos de células mesenquimales que
crecen a lo largo del vaso hasta fusionarse unos con otros en las zonas de unión; lo que explica que los defectos musculares puedan observarse tanto en
el ápex como en los ángulos laterales de la bifurcación. [5]
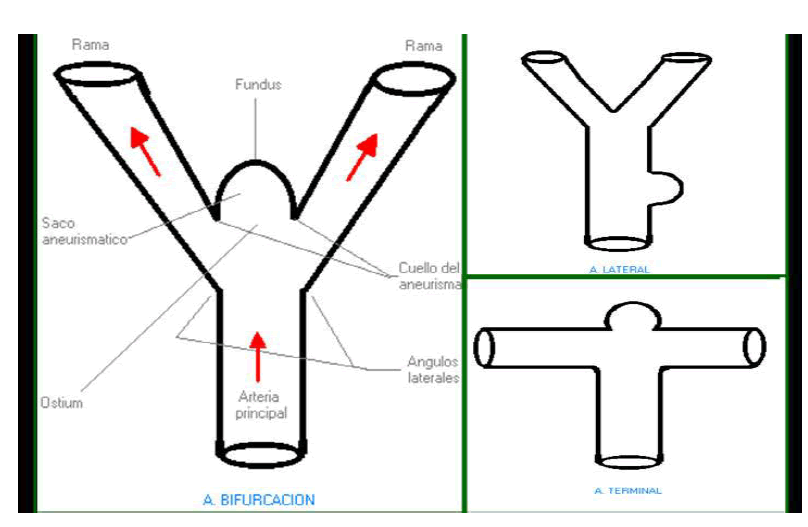
Los aneurismas se originan en las horquillas de bifurcación de los troncos de
las arterias principales o en el origen de pequeñas ramas de estas arterias. No
suceden en las ramas periféricas de las principales arterias cerebrales o
cerebelosas ni en pequeños vasos intracerebrales. Salvo contadas
excepciones, los aneurismas nacen en el ápex de la horquilla y nunca en los
ángulos laterales. Esta distribución no se corresponde con la de los defectos
mediales.
Si bien es cierto que este defecto muscular se presenta típicamente en el
punto donde se originan los aneurismas saculares, no es menos cierto que
este mismo defecto puede ser observado en las bifurcaciones de otras arterias
sistémicas, en las que paradójicamente los aneurismas son raros.
Además, estos defectos también se describen en casos sin asociación con
aneurismas. Debe haber pues “ algo más ” que defectos musculares para que
un aneurisma se desarrolle.
Si analizamos más detalladamente la zona del ápex, llegamos a la conclusión
de que se trata del punto donde incide la máxima presión del flujo sanguíneo,
y es precisamente en el punto donde más reforzada debería estar la pared en
el que ésta se encuentra más debilitada. Los defectos parecen constituir pues
un “ locus minoris resistentiae ”. [5]
El estudio de la hemodinámica de la bifurcación arterial y de la formación del
saco es clave para comprender el fenómeno aneurismático.
La presión media intraaneurismática es similar a la presión media arterial
sistémica, y de carácter pulsátil, en concordancia con la observación
habitualmente remarcada por los cirujanos sobre la sensación de pulsatilidad
del saco aneurismático. Los cambios en la presión sistémica se reflejan en cambios similares en la presión intraaneurismática. Los cálculos del stress de
la pared vascular indican claramente que para cualquier presión, la pared de
un aneurisma está sometida a un stress considerablemente mayor que la de
una arteria intracraneal. [9]
Hay que considerar tres fuerzas: la fuerza de empuje, la pulsatilidad y la
presión arterial. Fry ha demostrado que un aumento puntual en la fuerza de
empuje en la interfase sangre - pared vascular daña el endotelio, y expone la
membrana basal al depósito de trombos (lo que para algunos constituye el
proceso inicial en la arterioesclerosis).
El impacto y rápida deflexión del flujo en el ápex resulta en la transmisión de
un influjo pulsátil a esta región de la bifurcación que no sucede en ningún otro
punto del vaso. En el momento del impacto la energía cinética de la sangre
circulante es convertida en energía de estancamiento en el ápex. Otras áreas
de la pared vascular no están sujetas a esta presión extra. La presión total
que se ejerce en el ápex equivale pues a la suma de la presión transmural
más la presión de estancamiento.
Las turbulencias excitan la pared arterial hasta hacerla vibrar en su frecuencia
de resonancia. Por lo que fuerzas relativamente bajas resultan en tensiones
relativamente altas, produciendo daño estructural a la pared. El tejido elástico
arterial es particularmente vulnerable a los efectos de la vibración. Esto es
más acusado en los aneurismas debido a las alteraciones que presentan en la
elastina. La función de la elastina es la de mantener la tensión contra la
presión sanguínea normal, mientras que el colágeno juega un papel protector
de soporte. El colágeno en la pared del aneurisma es pues el único elemento
presente para procurar el mantenimiento de la tensión, y hay evidencias sobre
las anomalías estructurales en el mismo que disminuyen su flexibilidad y
capacidad elástica. [10]
El estudio Doppler intraoperatorio de aneurismas saculares cerebrales revela
la presencia de un flujo de baja frecuencia periódico o cuasiperiódico
superimpuesto a la onda del pulso. Los trabajos sobre modelos artificiales han
ayudado a demostrar la correlación entre el tipo de aneurisma y la presencia
de alteraciones de flujo. Especialmente susceptibles a las fluctuaciones del
flujo resultan los aneurismas terminales del tipo de los encontrados en la
bifurcación de la basilar. Por el contrario, los aneurismas laterales presentan
escasa tendencia a la inestabilidad de flujo. Las fluctuaciones del flujo ocurren
bajo ciertas circunstancias, dependiendo especialmente de la configuración
geométrica y del número de Reynolds*.
Los registros de flujo intraaneurismático muestran un patrón intermedio entre
el flujo laminar y el turbulento puro.
En los aneurismas laterales, la instilación de contraste muestra una
opacificación de la luz en dirección craneocaudal con un vórtex central que se
rellena y aclara lentamente. El remanso del contraste en la luz aneurismática
resulta muy pronunciado. Estas observaciones se confirman en los estudios
Doppler, donde también destaca un flujo laminar alterado en el segmento de
la arteria principal adyacente al ostium aneurismático.
En los aneurismas de la bifurcación, el influjo ocurre en el borde del ostium
próximo al eje longitudinal de la arteria principal, mientras que el flujo de
salida pasa por el punto opuesto del ostium, dirigiéndose exclusivamente hacia
una de las dos ramas asociadas al aneurisma, que es siempre la rama opuesta
a la cara del ostium que recibe el influjo. El flujo es siempre rápido y en
sentido rotatorio hacia la rama de salida, sin observarse fenómeno de éstasis
sanguíneo.
En los aneurismas terminales, el influjo ocurre en el lado del ostium más
próximo a una línea recta que pasara por el centro de la arteria madre. El flujo
de salida ocurre en el otro extremo del ostium y se dirige exclusivamente a la
rama arterial más próxima. Como en el caso de los aneurismas de la
bifurcación, el flujo es rápido, rotatorio y sin fenómeno de remanso. [11,12]
El fenómeno de éstasis del flujo sanguíneo resulta en la acumulación de
plaquetas y leucocitos sobre el endotelio y en una dificultad para la difusión de
oxígeno y metabolitos desde la sangre hacia la pared vascular. Todo ello
conduce a la aparición de daño intimal que favorece la formación del trombo y
el engrosamiento parietal, ambos responsables del crecimiento del aneurisma.
Se explicaría así la predilección de los aneurismas gigantes a desarrollarse en
la carótida interna y el sistema vertebrobasilar dada la configuración
geométrica de estas arterias que predispone a la formación de invaginaciones
laterales con el consiguiente fenómeno de éstasis del flujo y formación de
trombo intraaneurismático.
Es conocida la aparición de aneurismas saculares en algunas colagenopatías
como el síndorme de Ehlers-Danlos, el síndrome de Marfan o el
pseudoxantoma elástico. Algunos autores han descrito alteraciones a nivel del
colágeno tipo III en el estudio de las paredes de los aneurismas con resultados
contradictorios sobre la asociación hereditaria de este defecto, llegando a
proponer la hipótesis de “formes frustrées” de Ehlers-Danlos para explicar la
asociación familiar entre AS y defectos del colágeno. El análisis genético de
sujetos afectos ha puesto en evidencia la existencia de agregaciones familiares
con una herencia genética mendeliana, que no responde a herencia dominante
ni recesiva, sino más bien sugestiva de heterogeneidad genética, aunque
Bannerman no logró demostrar tendencia hereditaria. [14,15,16,17,18,19]
Otras asociaciones comunes con AS son la coartación aórtica y la poliquistosis
renal. Tanto en el caso de la coartación aórtica, como en las anomalías en el
polígono de Willis, o tras la ligadura quirúrgica de un vaso cerebral, se
producen fenómenos de incremento del flujo en algunas bifurcaciones que
aumentan el riesgo de desarrollar AS. El mejor ejemplo es la desigualdad de
los segmentos proximales de las arterias cerebrales anteriores, que resulta en
un shunt a través de la comunicante anterior en dirección a la bifurcación.
En cuanto a la poliquistosis renal, algunos autores quieren ver una relación
entre las anomalías estructurales que favorecen el desarrollo de los quistes
renales y la formación de los AS. [20,21]
Hay que destacar también que ambos cuadros (CoAo y PQR) se asocian a una
mayor incidencia de hipertensión arterial que podría relacionarse con los AS.
Sin embargo el papel de la hipertensión arterial en la formación de los
aneurismas saculares es controvertido con resultados contradictorios en
diferentes trabajos publicados. [22,23]
En conclusión, los aneurismas saculares ocurren de forma independiente a
fenómenos inflamatorios, arteriosclerótico, o traumatismos externos. La
formación y crecimiento aneurismáticos se consideran estrechamente
relacionados con la estructura y peculiaridades de la pared vascular de las
arterias cerebrales por un lado, y con fenómenos hemodinámicos propios del
flujo intracraneal por otro. La comprensión de las causas que conducen al
desarrollo de los aneurismas es un requisito para entender su crecimiento,
pudiendo así en un futuro actuar en vistas a prevenir su rotura.
Bibliografía
- Stehbens WE. Aneurysms and anatomical variation of cerebral arteries. Arch Pathol 1963;75:45-76.
- Castillo J, Álvarez J, Martí-Vilalta JL, Martínez E, Matías-Guiu J. Manual de enfermedades vasculares cerebrales. Prous Science; 2° edición: p.199-206.
- Fawcett DW. Tratado de Histología. Interamericana-McGraw-Hill;11ª edición:p.369- 409.
- Cotran RS, Kumar V, Collins T. Robbins: Patología estructural y funcional. Interamericana-Mc Graw-Hill;6° edición:p.519-569.
- Forbus WD. On the origin of miliary aneurysms of the superficial cerebral arteries. Bulletin of the John Hopkins Hospital 1930;47:239-284.
- Artmann H, Vonofakos D, Müller H, Grau H. Neuroradiologic and neuropathologic findings with growing giant intracranial aneurysm. Surg Neurol 1984;21:391-401.
- Crawford T. Some obervations on the pathogenesis and natural history of intracranial aneurysms. J Neurol Neurosurg Psychiat 1959;22:259-266.
- Stehbens WE, Phil D. Etiology of intracranial berry aneurysms. J Neurosurg 1989;70:823-831.
- Ferguson GG. Direct measurement of mean and pulsatile blood pressure at operation in human intracranial saccular aneurysms. J Neurosurg 1972;36:560- 563.
- Ferguson GG. Physical factors in the initiation, growth, and rupture of human intracranial aneurysms. J Neurosurg 1972;37:667-677.
- Steiger HJ, Reulen HJ. Low frequency flow fluctuations in saccular aneurysms. Acta Neurochir 1986;83:131-137.
- Strother CM, Graves VB, Rappe A. Aneurysm hemodynamics: an experimental study. AJNR 1992;13:1089-1095.
- Nakatani H, Hashimoto N, Kang Y, Yamazoe N, et al. Cerebral blood flow patterns at major vessel bifurcations and aneurysms in rats. J Neurosurg 1991;74:258-262.
- Rubinstein MK, Cohen NH. Ehlers-Danlos syndrome associated with multiple intracranial aneurysms. Neurology 1954;14:125-132.
- Finney HL, Roberts TS, Andreson RE. Giant intracranial aneurysm associated with Marfan’s syndrome. J Neurosurg 1976;45:342-347.
- Pope FM, Narcisi P, Neil-Dwyer G, Nicholls AC, et al. Some patients with cerebral aneurysms are deficient in type III collagen. The Lancet 1981;I:973-975.
- Kuivaniemi H, Prockop DJ, Wu Y, Madhatheri SL, et al. Exclusion of mutation in the gene for type III collagen (COL3A1) as a common cause of intracranial aneurysms or cervical artery dissections. Neurology 1993;43:2652-2658.
- Bannerman RM, Ingall GB, Graf CJ. The familial occurrence of intracranial aneurysms. Neurology 1970;20:283-292.
- Ronkainen A, Hernesniemi J, Puranen M, Niemitukia L, et al. Familial intracranial aneurysms. The Lancet 1997;349:380-384.
- Bigelow NH. The association of polycystic kidneys with intracranial aneuryms and other related disorders. Am J Med Sci 1953;225:483-494.
- Wright CJ. Coarctation of the aorta with death from rupture of a cerebral aneurysm. Arch Pathol 1949;48:382-486.
- Sekhar LN, Heros RC. Origin, growth, and rupture of sacular aneuryms : a review. Neurosurgery 1981;18:248-260.
- McCormick WF, Schmalstieg EJ. The relationship of arterial hypertension to intracranial aneurysms. Arch Neurol 1977;34:285-287.
1396