Key words
polycystic ovary, polycystic ovary syndrome, treatment polycystic ovary syndrome, polycystic ovary syndrome infertility.
Introducción
Concepto de síndrome de ovario poliquístico
El Síndrome de Ovario Poliquístico (SOP) es la alteración endocrinológica más frecuente que afecta a las mujeres en edad reproductiva. El SOP se caracteriza por oligomenorrea, síntomas secundarios al exceso de andrógenos y puede resultar en alteraciones sobre la calidad de vida y en humor depresivo. La aparición de los síntomas puede estar condicionada por el medio ambiente y la herencia genética actuando sobre etapas tempranas de la vida. Los modelos experimentales sugieren que la exposición durante el desarrollo fetal a andrógenos puede inducir efectos similares al síndrome de ovario poliquístico [1].
Su diagnóstico se realiza durante la época reproductiva cuando las mujeres presentan dos de los siguientes criterios: 1) ciclos irregulares o anovulatorios, 2) hiperandrogenismo y 3) fenotipo de síndrome de ovario poliquístico [2, 3]. Existen varios fenotipos de SOP, según los criterios de Rotterdam (2003): Obesidad con hiperandrogenismo y poliquistosis, poliquistosis y obesidad sin hirsutismo clínico, obesidad e hirsutismo sin poliquistosis asociada, y finalmente poliquistosis e hiperandrogenismo sin obesidad, por orden de prevalencia [4].
La prevalencia en la población general ronda el 6,6%, con una prevalencia en España del 6,5% [5, 6].
Para el diagnóstico del mismo se recomienda usar los criterios de Rotterdam, que consiste en la presencia de dos de los siguientes criterios: hiperandrogenismo, ovarios poliquísticos, disfunción ovárica, aunque es difícil realizar el diagnóstico en mujeres adolescentes y menopáusicas [7].
Existen numerosas complicaciones asociadas a esta entidad, como pueden ser cambios en el humor, hígado graso no alcohólico, aumento de riesgo cardiovascular, aumento del riesgo del cáncer de endometrio y otros. Para el tratamiento de esta entidad clínica el primer escalón terapéutico pasa por el uso de anticonceptivos hormonales. El tratamiento de primera línea para la infertilidad es el clomifeno. No se han encontrado mejoras significativas con el uso de cambios en el estilo de vida, aunque en aquellas pacientes en sobrepeso u obesidad tienen mejoras en su salud al seguir dichas pautas [3, 8-10].
Epidemiología
Según la fuente utilizada y los criterios seleccionados para el diagnóstico de la enfermedad, la epidemología varía. En el estudio de Azziz et al., realizaron una evaluación de las pacientes según si cumplían los criterios de Rotterdam, criterios serológicos de niveles hormonales, presencia o ausencia de hirsutismo y disfunción ovárica [5].
Dicho estudio señalaba una prevalencia acumulada de de 6,6%, siendo del 6,6% en las pacientes de raza negra y 4,8% en las pacientes de raza blanca, no hallándose diferencias estadísticamente significativas entre ambos grupos.
Para la población española tenemos el estudio de Asunción et al. que realizó una estimación de forma prospectiva de ovario poliquístico en 154 mujeres caucásicas de edad reproductiva que se iban a someter a donación de sangre. Los criterios de selección de estos pacientes implicaron la existencia de oligomenorrea, hiperandrogenismo clínico o bioquímico y la exclusión de hiperprolactinemia, desórdenes tiroideos y déficit atípico de 21-hidroxilasa. Se definió una prevalencia del 6,5% de la muestra con criterios de hirsutismo en el 7,1% y estado de acné en el 12,3% de la muestra [6, 7].
Criterios diagnósticos
Diagnóstico en adultos: el síndrome de ovario poliquístico es un síndrome de etiología compleja, y escasamente comprendida. Para el diagnóstico en adultos se realiza cumpliendo dos de los tres criterios: hiperandrogenismo, ovarios poliquísticos (objetivados mediante técnica ecográfica) o disfunción ovárica. Se deben excluir las entidades que en su desarrollo natural de enfermedad presenten clínica que pueda solaparse, como las afecciones tiroideas, hiperprolactinemia e hiperplasia suprarrenal congénita (mayormente déficit primario de la 21-hidroxilasa). Los criterios más utilizados para el diagnóstico son los de Rotterdam (8), aunque es frecuente usar otros criterios diagnósticos (Tabla 1) [3, 4].
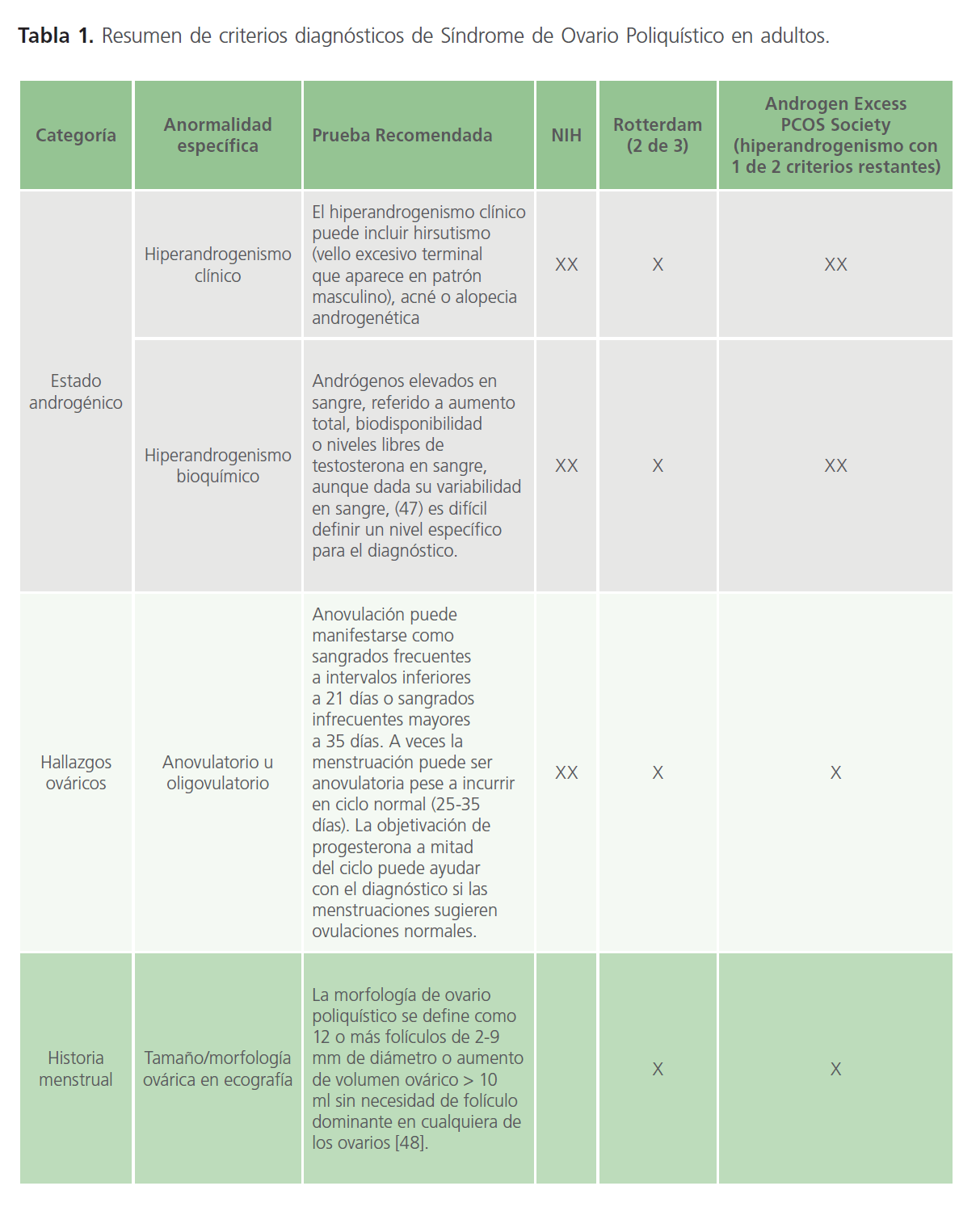
Tabla 1: Resumen de criterios diagnósticos de Síndrome de Ovario Poliquístico en adultos.
Los criterios anteriores permiten un diagnóstico clínico (en anovulaciones crónicas secundarias a hiperandrogenismo), de forma analítica con análisis específicos en sangre de andrógenos o con ecografía compatible. No está recomendado el cribado de forma sistemática en mujeres que cumplan dos de los tres criterios clínicos, aunque sí se recomienda recoger en la historia clínica cuáles han orientado el diagnóstico en cada caso de forma individual, incluyendo los criterios ecográficos de Rotterdam de morfología ovárica. Para cumplir los criterios de Rotterdam la paciente debe presentar al menos un ovario con al menos 12 folículos de 2-10 milímetros o un volumen superior a 10mL en ausencia de folículo dominante superior a 10 milímetros [3].
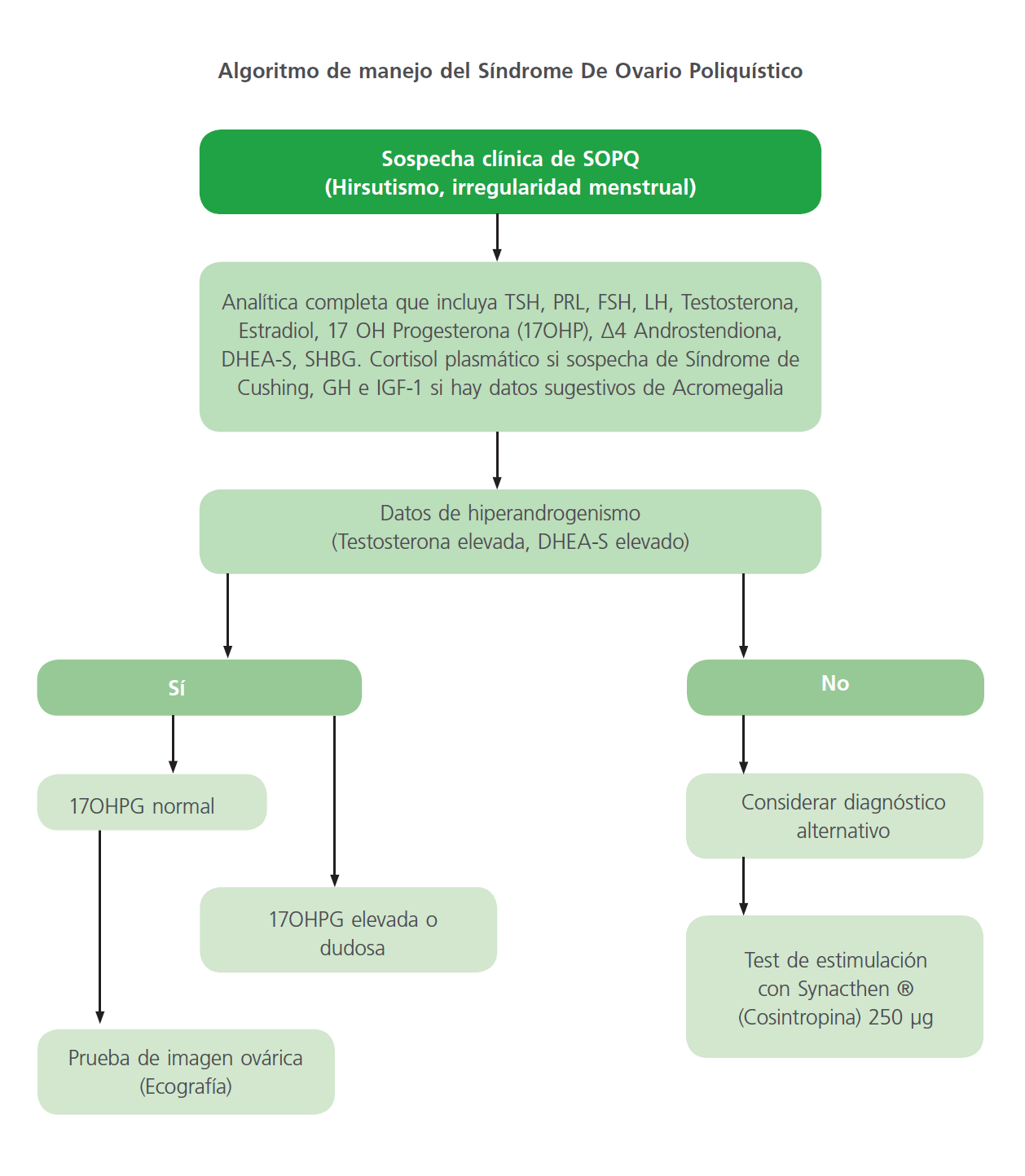
Por la facilidad de realizar el descarte durante el manejo, todas las mujeres con sospecha de síndrome de ovario poliquístico deberían realizarse un cribado de TSH, prolactina y niveles de 17-HP. La hiperprolactinemia puede presentarse como hirsutismo o dismenorrea [12]. La enfermedad tiroidea puede presentarse con ciclos menstruales irregulares. También debe descartarse la hiperplasia suprarrenal congénita, dado que justifica hasta el 6,8% de pacientes con hiperandrogenismo. En mujeres seleccionadas con amenorrea, virilización acromegalia, debilidad muscular u otros síntomas atípicos deberían considerarse otras entidades clínicas [3, 13].
Diagnóstico en adolescencia: la mayoría de guías europeas recomiendan realizar el diagnóstico de síndrome de ovario poliquístico ante la presencia de clínica sugestiva y/o exámenes analíticos compatibles. El morfotipo de SOP y los síntomas anovulatorios no son suficientes para realizar el diagnóstico, dado que dichos síntomas son habituales durante la maduración reproductiva. Tampoco se ha demostrado que el criterio ecográfico de los criterios de Rotterdam no se puede extrapolar a la adolescencia al no haber sido validado en este grupo poblacional. Durante el primer año tras la menarquia hasta el 85% de los ciclos menstruales son anovulatorios, disminuyendo progresivamente hasta el 25% de ciclos anovulatorios a partir del sexto año tras la misma. Estos ciclos anovulatorios se suelen asociar a aumento de LH en plasma [3, 13].
Diagnóstico en menopausia y perimenopausia: aunque hay no criterios diagnósticos específicos para las mujeres en la etapa de menopausia y perimenopausia, sí que se puede realizar diagnóstico de presunción en el contexto de historia objetivada de hiperandrogenismo y oligoamenorrea durante su etapa reproductiva. La presencia de morfotipo de Síndrome de Ovario Poliquístico mediante ecografía puede sugerir dicho diagnóstico, aunque es algo inhabitual en la mujer menopáusica. Existen pocos estudios específicos en este ámbito, además del problema asociado a la disminución del tamaño del ovario, contaje folicular y niveles hormonales anti-Muller que se encuentra en este tipo de pacientes. Tampoco existen niveles de referencia que nos indiquen los niveles adecuados de testosterona en este tipo pacientes, aunque sí que debe descartarse un tumor productor de andrógeno en mujeres con niveles muy altos de testosterona [3, 14].
Comorbilidades asociadas
Uno de los mayores problemas asociados a este síndrome son los procesos asociados. Podemos dividirlos según su área de influencia:
Salud reproductiva e infertilidad: las mujeres que padecen de síndrome de ovario poliquístico poseen un mayor riesgo de infertilidad y ciclos anovulatorios. En ausencia de anovulación el riesgo de infertilidad es dudoso. En algunas mujeres con síndrome de ovario poliquístico con historia menstrual regulada pueden presentar episodios anovulatorios, en cuyo caso se puede realizar analítica serológica de progesterona a nivel de la mitad de cuerpo lúteo. Se recomienda de forma general realizar la historia menstrual de las mujeres buscando quedarse embarazadas. También deben descartarse otras causas que justifiquen la infertilidad. Se estima que hasta el 50% de estas mujeres pueden presentar infertilidad primaria y un 25% infertilidad secundaria, llegando la infertilidad global a oscilar entre el 25 y el 40% de las pacientes debidos a causa anovulatoria [3, 15].
Sin embargo, a pesar de los periodos anovulatorios, durante un estudio sobre la fecundidad realizado sobre mujeres suecas se comprobó que un 75% de las mujeres con Síndrome de Ovario Poliquístico eran capaces de concebir de forma espontánea [16].
No podemos obviar otros factores acompañantes a este síndrome que pueden sucederse en pacientes afectas de SOP y que pueden ocasionar complicaciones durante el embarazo (parto pretérmino, diabetes gestacional y preeclampsia). En estas pacientes debería realizarse de forma sistemática consejo preconcepcional, incluyendo test de tolerancia oral de glucosa, toma de tensión arterial y medida de Índice de Masa Corporal. En el caso de fecundaciones In Vitro no existió diferencias significativas entre el grupo con SOP y el grupo control, con una OR de 1,0, p de 0,05 e IC 0.5-8.1 [17]. Un metaanálisis donde se tomó en consideración el Índice de Masa Corporal demostró un riesgo significativo de parto prematuro en las pacientes con SOP (< 37 semanas, OR 1,75; p=0,05; IC 1,16-2,62) y de pre-eclampsia (OR 3,47; p=0,05; IC 1,95-6,17); además de un riesgo aumentado de hipertensión durante el embarazo y diabetes gestacional [18].
Obesidad: el aumento de tejido graso, particularmente abdominal, está asociado a aumento de producción de andrógenos y mayor riesgo cardiovascular, de forma que se recomienda desde la adolescencia cálculo del índice de masa corporal y medida de circunferencia de abdomen. Se estima una prevalencia de obesidad en este tipo de pacientes de entre el 30 a 60%, que puede estar debida a una dieta incorrecta [19, 20].
Existe un sesgo importante en estos pacientes, puesto que la obesidad en general y la obesidad abdominal en particular causa hiperandrogenismo y disminución plasmática de la proteína fijadora de hormonas sexuales [21]. Las mujeres con SOP y obesidad también muestran una menor respuesta reproductiva ante fármacos específicos. La obesidad per se aumenta el riesgo de síndrome metabólico, diabetes, dislipemia y otros factores de riesgo cardiovascular [5, 19].
Diabetes Mellitus tipo 2 y Riesgo Vascular: se recomienda uso de test de sobrecarga oral de glucosa (medida a las dos horas tras el uso de dosis de carga de 75g de glucosa) para comprobar la posible intolerancia oral a glucosa o aparición de diabetes mellitus tipo 2 por el riesgo aumentado de estas complicaciones. En caso de no querer realizarse el test de sobrecarga oral de glucosa puede considerarse realizar una hemoglobina glicosilada (Hb1AC). Se recomienda cribado cada 3-5 años o antes en caso de obesidad abdominal, aumento de peso o síntomas cardinales de desarrollo de diabetes (Tabla 2) [10, 22].

Tabla 2: Resumen de criterios diagnósticos de Síndrome de Ovario Poliquístico en adultos.
El diagnóstico de Síndrome de Ovario Poliquístico condiciona per se un aumento de riesgo relativo de 5-10 veces de desarrollar diabetes mellitus tipo 2. En el estudio de Celik et al. Se realizó un seguimiento de 84 mujeres con SOP durante una media de 2,6 años, demostrando que las pacientes con glucemia basal alterada con SOP tenían una incidencia anual de 4,5% de pasar a Intolerancia Oral a Glucosa. Las mujeres que ya tenían Intolerancia Oral a Glucosa modificaron su estado en 33% a convertirse en diabetes mellitus tipo 2 en el mismo periodo del estudio, lo cual implica una incidencia anual del 10,4% en este grupo de pacientes [22].
Depresión: en estas pacientes se recomienda identificar y tratar de forma adecuada los síntomas depresivos y de ansiedad. Las mujeres con SOP comparadas con controles demostraban un mayor número de síntomas depresivos, sobre todo alteraciones de hábitos alimentarios (OR 6,4; p= 0,05; IC 1,2-31) [23].
Sin embargo, en un estudio específico en la adolescencia, con una muestra de 102 pacientes con SOP, no se hallaron diferencias significativas de la incidencia de depresión clínica en pacientes adolescentes con SOP con respecto al grupo control de 1349 pacientes (OR 1,3; p= 0,05; IC 0,7-2,7), aunque sí existía mayor riesgo depresivo en las pacientes con aumento de su Índice de Masa Corporal (p = 0,01) y muy posiblemente con acné, muy cerca de la significación estadística (p = 0,08) [24].
La prevalencia de ansiedad también se encuentra aumentada en este grupo de pacientes, mostrando un aumento clínico de sintomatología ansiosa, objetivable en las escalas hospitalarias de ansiedad y depresión (HADS) respecto a la población general (p<0,001), de ahí que el cribado de patologías psiquiátricas sea recomendable en este tipo de pacientes [25].
Manifestaciones cutáneas (hirsutismo): se recomienda que un examen físico en estas pacientes incluya manifestaciones cutáneas de síndrome de ovario poliquístico, como son crecimiento de vello terminal, acné, alopecia, acantosis nigricans. La historia clínica debería incluir la edad de inicio de los mismos, evolución, tratamientos previos, cambios de peso y problemas cutáneos familiares. También se debe mencionar que en las mujeres en estado de obesidad, mujeres con SOP y resistencia a la insulina se presenta acantosis nigricans.
El SOP representa la principal causa de hirsutismo, aunque esta no se considera un factor predictivo del estado de disfunción ovárica. En líneas generales, el hirsutismo aparece en aproximadamente el 65-75% de los pacientes con SOP, resultando más frecuente en pacientes con obesidad abdominal [24, 26].
El acné también es frecuente en las mujeres con SOP, especialmente en la adolescencia con una prevalencia entre el 14-25% [27]. La alopecia androgenética es menos frecuente y aparece con posterioridad, pero permanece como una entidad con gran carga emocional, pero no tiene tanta relación con el SOP como el hirsutismo [5, 28].
Hígado graso: se sugiere pensar en la posibilidad de hígado graso en estos pacientes, pero no existen recomendaciones específicas de cribado en las pacientes con síndrome de ovario poliquístico.
Se estima una prevalencia de entre el 15 al 60% de Hígado Graso No Alcohólico, según el sistema de objetivación usado para definir la entidad (aumento de AST u objetivación mediante ultrasonido). Sin embargo, no existen herramientas de screening para el Hígado Graso No Alcohólico, y el aumento de AST tiene una baja sensibilidad y especificidad para el diagnóstico de esta entidad clínica. Tampoco existe tratamiento preventivo adecuado ni tratamiento [29]. De forma específica en adolescentes no existen diferencias significativas respecto a la población general o los niveles de AST, aunque sí se halló relación con la edad (r = -0,53), IMC (r=0,41) y otros factores de riesgo cardiovascular como la obesidad abdominal, series lipídicas e intolerancia a la glucemia [30].
Resto de manifestaciones: las pacientes con síndrome de ovario poliquístico comparten muchos de los factores de riesgo asociados con el desarrollo de cáncer endometrial, incluyendo obesidad, diabetes, aumento de sangrado uterino. En un estudio de cohortes de 31 años de seguimiento se comprobó que existía un Riesgo Relativo de 3,5 de desarrollo de cáncer endometrial; no obstante, la evidencia actual es contradictoria e incompleta sobre la relación carcinoma de endometrio-SOP [31]. Por ello, no se recomienda medir el grosor endometrial en las mujeres con síndrome de ovario poliquístico, aunque sí consultar en caso de sangrado o manchado [32, 33]. Se recomienda en las mujeres con sobrepeso u obesidad el cribado de Síndrome de Apnea Obstructiva del Sueño, en cuyo caso deberá ser referido a ámbito especializado para un correcto control de dicha entidad. Las mujeres con SOP igualan o exceden a los hombres. Incluso aunque se normalice el IMC, las pacientes con SOP presentan 30 veces más riesgo de alteraciones respiratorias con el sueño y 9 veces mayor probabilidad de somnolencia diurna. También presentan mayor riesgo de Síndrome de Apnea Hipoventilación (SAH) comparada con controles con un IMC parecido (p< 0,01).Tratamientos con CPAP han mejorado la sintomatología. En mujeres jóvenes el tratamiento del SAH mejora la resistencia a la insulina y la presión arterial [34].
Tratamiento Síndrome de Ovario Poliquístico
Tratamiento no farmacológico
Ejercicio físico y pérdida de peso: dado que el SOP se asocia a obesidad y sobrepeso en una elevada proporción de casos, se recomienda pérdida de peso, tanto aumentando el ejercicio físico como con dieta hipocalórica:
Se recomienda ejercicio físico en el manejo de las complicaciones de obesidad y sobrepeso de estas pacientes. Aunque no existen estudios randomizados que justifiquen esta práctica, su uso en combinación con el resto de medidas higiénico-dietéticas mejora la pérdida de peso, reducen la incidencia de desarrollo de diabetes y mejoran el resto de factores de riesgo cardiovascular.
Se recomienda la pérdida de peso mediante dieta restrictiva. La pérdida de peso en este caso es beneficiosa para las disregulaciones metabólicas y de fertilidad, aunque en las mujeres en normopeso no se han encontrado mejorías significativas que justifique este tipo de medidas. No parece haber diferencias entre distintos tipos de dieta en términos de resultados antropométricos, pero las dietas con bajo índice glucémico podrían ser ligeramente superiores a otras en mejora de la fertilidad (Si bien esta mejora se observa con cualquier pérdida de peso), así como en la mejoría de parámetros metabólicos de resistencia a la insulina (En este último caso, de forma similar a la dieta hiperprotéica y a la baja en hidratos de carbono versus hipocalórica estándar); la pérdida de peso asimismo parece mejorar la caliAnticoncepción hormonal: se recomienda métodos de anticoncepción hormonal (pastilla, anillo vaginal o parche) como tratamiento de primera línea para el manejo del acné/hirsutismo y las disregulaciones menstruales. Se recomienda también el cribado de contraindicaciones de anticoncepción hormonal, aunque no existe una indicación con mayor grado de recomendación sobre las demás para el tratamiento del SOP, pero el riesgo-beneficio puede ser variable entre preparados y fórmula (Tabla 3) [36]. En las mujeres con síndrome de ovario poliquístico la progesterona se encuentra disminuida y la producción ovárica de andrógenos. Algunos progestágenos poseen efectos antiandrogénicos, dado que antagonizan efectos de los receptores androgénicos y/o inhiben la actividad de la 5-alfa-reductasa. Se recomienda el uso de ciclos largos de tratamiento para evitar el efecto rebote en estas pacientes [37].

Tabla 3: Consideraciones en el manejo de uso de Anticoncepción Hormonal, incluyendo pastilla, anillo vaginal y parche en mujeres con SOP.
Metformina
Se recomienda evitar la metformina como primer escalón terapéutico para el tratamiento sistemático de manifestaciones cutáneas, obesidad o manejo de complicaciones del embarazo. Sin embargo su uso sí se encuentra recomendado en pacientes con tolerancia anormal a la glucosa o diabetes mellitus tipo 2 que no respondan a medidas higiénico-dietéticas. La AACE (American Association of Clinical Endocrinologists), en su posicionamiento de 2005, recomiendan metformina como primera opción terapéutica en estos casos, y considerar en el resto como segunda opción [38].
En algunos casos de oligomenorrea, el inicio de metformina puede inducir la regularización de los ciclos y la ovulación Sin embargo, no hay evidencia de que aumente el porcentaje de recién nacidos vivos [39-42].
Inductores de la ovulación: para el tratamiento de infertilidad se recomienda el citrato de clomifeno o moduladores estrogénicos como el letrozol como tratamiento de la infertilidad de primera línea. Se recomienda el uso de metformina de forma coadyuvante en la terapéutica de la infertilidad para prevenir el síndrome de hiperestimulación ovárica en las mujeres con SOP bajo tratamiento de fertilización in vitro [39, 44].
Otros fármacos: aunque los resultados son prometedores, la evidencia actual disponible no permite recomendar el uso sistemático de sensibilizadores de insulina como el inositol, o tiazolidindionas (dadas las dudas sobre su seguridad). También se contraindica el uso de estatinas para el tratamiento de la anovulación y el hiperandrogenismo hasta que nuevos estudios demuestren un índice riesgo-beneficio adecuado [43, 45].
Situaciones especiales
Adolescencia
En adolescente se recomienda el uso de anticoncepción hormonal como tratamiento de primer escalón para el tratamiento de síntomas anovulatorios, acné, hirsutismo o para prevención del embarazo. Se recomiendan cambios higiénico-dietéticos (dieta de restricción calórica y ejercicio) con el objetivo principal de ayudar a las posibles complicaciones asociadas al SOP (Sobrepeso y Obesidad). Se recomienda el uso de metformina en caso de síndrome metabólico o intolerancia oral a glucosa. Se requieren más estudios para comprobar la duración óptima del tratamiento con metformina o anticoncepción hormonal. En mujeres en premenarquia con criterios analíticos de hiperandrogenismo y desarrollo puberal avanzado (Tanner mayor o igual a IV en desarrollo mamario) se recomienda usar anticoncepción hormonal [46].
SOP y gestación
En lo referente a la gestación, no existe evidencia de que metformina mejore los resultados obstétricos en administración preconcepcional [43], pero durante la gestación parece que podría ser beneficiosa, aunque existe controversia al respecto [45]. Puede considerarse su uso en pacientes seleccionados.
Conclusiones

Conflicto de intereses
los autores de esta Guía de Práctica Clínica declaran que no existe ningún conflicto de intereses relacionado con la presente guía de práctica clínica.
Agradecimientos
Un agradecimiento especial al Dr. D. Jesús Antonio Bayort Fernández, a la Unidad de Gestión Clínica de Endocrinología y Nutrición del Hospital Universitario Virgen del Rocío de Sevilla y al Servicio de Endocrinología del Hospital Infanta Luisa de Sevilla.
También queremos agradecer al Distrito Sanitario de Jaén-Jaén Sur (especialmente al Centro de Salud Virgen de la Capilla y a la Unidad Docente de Medicina Familiar y Comunitaria) y al Servicio de Urgencias y Emergencias del Complejo Hospitalario de Jaén por su ayuda prestada.
495
References
- Abbot, DH.,Nicol, LE., Levine, JE., Xu, N., Goordazi, MO., Dumesic, DA. Nonhuman primate models of polycystic ovary syndrome. Mol Cell Endocrinol. 2013; 373: 21-8.
- Welt, CK., Carmina, E. Life cycle of polycystic ovary syndrome (PCOS): From in Utero to Menopause. J ClinEndocrinolMetab. 2013; 98 (12): 4629-38.
- Legro, RS., Arslanian, SA., Ehrmann, DA., Hoeger, KM., Murad, MH., Pasquali, R. et al. Diagnosis and treatment of polycystic ovary syndrome: An endocrine society clinical practice guideline. J ClinEndocrinolMetab. 2013; 98 (12): 4565-92.
- Kar, S. Anthropometric, clinical, and metabolic comparisons of the four Rotterdam PCOS phenotypes: A prospective study of PCOS women. J Hum Reprod Sci. 2013; 6 (3): 194-200.
- Azziz, R., Woods, KE., Reyna, R., Key, TJ., Knochenhauer, ES., Yildiz, BO. The prevalence and Features of the polycystic ovary syndrome in an unselected population. The Journal of Clinical Endocrinology & Metabolism 2004; 89 (6): 2745-9.
- Asunción, M., Calvo, RM., San Millán, JL., Sancho, J., Ávila, S., Escobar-Morreale, HF. A prospective styudy of the prevalence of the polycystic ovary syndrome in unslecetedcaucasian women from spain. The Journal of Clinical Endocrinology & Metabolism 2000; 85 (7): 2434-8.
- Franks, F. Diagnosis of Polycystic Ovarian Syndrome: In Defense of the Rotterdam Criteria. The Journal of Clinical Endocrinology & Metabolism 2004; 91 (3): 786-9.
- Merino, P., Schulin-Zethen, C., Codner, E. Diagnóstico del síndrome de ovariopoliquístico: nuevosfenotipos, nuevasincógnitas. Rev Méd Chile 2009; (13): 1071-80.
- Hatch, R., Rosenfield, RL., KIM, MH., Tredway, D. Hirsutism: Implications, etiology and management. Am J Obstet Gynecol. 1981; 140: 815-30.
- Wild, RA., Carmina, E., Diamanti-Kandarakis, E. et al. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: A consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AEPCOS) Society. J ClinEndocrinolMetab. 2010; 95: 2038-2049.
- Vermeulen, A., Ando, S. Prolactin and adrenal androgen secretion. ClinEndocrinol. 1978; 8: 295-303.
- Carmina, E., Rosato, F., Jannì, A., Rizzo, M., Longo, RA. Extensive clinical experience: Relative prevalence of different androgen excess disorders in 950 women referred because of clinical hyperandrogenism. J ClinEndocrinolMetab. 2006; 91: 2-6.
- Apter, D. Endocrine and metabolic abnormalities in adolescents with a PCOS-like condition: consequences for adult reproduction. Trends EndocrinolMetab. 1998; 9: 58-61.
- Johnstone, EB., Rosen, MP., Neril, R. et al. The polycystic ovary post-Rotterdam: A common, age-dependent finding in ovulatory women without metabolic significance. J ClinEndocrinolMetab. 2010; 95: 4965-4972.
- Bhattacharya, S., Porter, M., Amalraj, E. et al. The epidemiology of infertility in the North East of Scotland. Hum Reprod. 2009; 24: 3096-3107.
- Hudecova, M., Holte, J., Olovsson, M., SundströmPoromaa, I. Longterm follow-up of patients with polycystic ovary syndrome: Reproductive outcome and ovarian reserve. Hum Reprod. 2009; 24: 1176-1183.
- Heijnen, EM.,Eijkemans, MJ., Hughes, EG., Laven, JS., Macklon, NS., Fauser, BC. A meta-analysis of outcomes of conventional IVF in women with polycystic ovary syndrome. Hum Reprod Update. 2006; 12: 13-21.
- Boomsma, CM.,Eijkemans, MJ., Hughes, EG., Visser, GH., Fauser, BC., Macklon, NS. A meta-analysis of pregnancy outcomes in women with polycystic ovary syndrome. Hum Reprod Update. 2006; 12: 673-683.
- Azziz, R., Carmina, E., Dewailly, D. et al. Task Force on the Phenotype of the Polycystic Ovary Syndrome of the Androgen Excess and PCOS Society. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. FertilSteril. 2009; 91: 456-88.
- Dos S. Rodrigues, AM., Martins, LB., Franklin, AMT., Candido, AL., dos Santos, LC.,Ferrerira, AVM. Poor quality diet is associated with overweight status and obesity in patients with polycistic ovary syndrome. Journal of human nutrition and dietetics. 2014; (Ahead of print).
- Pasquali, R., Gambineri, A., Pagotto, U. The impact of obesity on reproduction in women with polycystic ovary syndrome. BJOG. 2006; 113: 1148-1159.
- Celik, C., Tasdemir, N., Abali, R., Bastu, W., Yilmaz, M. Progression to impaired glucose tolerance or type 2 diabetes mellitus in polycystic ovary syndrome: a controlled follow-up study. Fertility and Sterility. 2014; (Ahead of print).
- Bhattacharya, SM., Jha, A. Prevalence and risk of depressive disorders in women with polycystic ovary syndrome (PCOS). FertilSteril. 2010; 94: 357-359.
- Milsom, SR., Nair, SM., Ogilvie, CM., Stewart, JM., Merry, SN. Polycistic ovary syndrome and depression in New Zealand adolescents. J PediatrAdolesc Gynecol. 2013; 26: 142-7.
- Benson, S., Hahn, S., Tan, S., Mann, K., Janssen, OE.,Schedlowski, M. et al. Prevalence and implications of anxiety in polycystic ovary syndrome: Results of an internet-based survey in Germany. Hum Reprod. 2009; 24: 1446.
- Hatch, R., Rosenfield, RL., Kim, MH., Tredway, D. Hirsutism: Implications, etiology, and management. Am J Obstet Gynecol. 1981; 140: 815-30.
- Lowenstein, EJ. Diagnosis and management of the dermatologic manifestations of the polycystic ovary syndrome. DermatolTher. 2006; 19: 210-23.
- Karrer-Voegeli, S., Rey, F., Reymond, MJ.,Meuwly, JY., Gaillard, RC., Gomez, F. Androgen dependence of hirsutism, acne, and alopecia in women: Retrospective analysis of 228 patients investigated for hyperandrogenism. Medicine 2009; 88: 32-45.
- Vassilatou, E., Lafoyianni, S., Vryonidou, A. et al. Increased androgen bioavailability is associated with non-alcoholic fatty liver disease in women with polycystic ovary syndrome. Hum Reprod. 2010; 25: 212-20.
- Michaliszyn, SF., Lee, SJ., Tfayli, H., Arslanina, S. Polycystic ovary syndrome and nonalcoholic fatty liver in obese adolescents: Association with metabolic risk profile 2013; 100 (6): 1745-51.
- Hardiman, P., Pillay, OS.,Atiomo, W. Polycystic ovary syndrome and endometrial carcinoma. Lancet 2003; 361: 1810-12.
- Wild, S., Pierpoint, T., Jacobs, H., McKeigue, P. Long-term consequences of polycystic ovary syndrome: Results of a 31 year follow-up study. Hum FertilCamb. 2000; 3: 101-5.
- Smith, RA., von Eschenbach, AC., Wender, R. et al. ACS Prostate Cancer Advisory Committee, ACS Colorectal Cancer Advisory Committee, ACS Endometrial Cancer Advisory Committee. American Cancer Society guidelines for the early detection of cancer: Update of early detection guidelines for prostate, colorectal, and endometrial cancers. Also: Update 2001–testing for early lung cancer detection. CA Cancer J Clin. 2001; 51: 38- 75.
- Tasali, E., Chapotot, F., Leproult, R., Whitmore, H., Ehrmann, DA. Treatment of obstructive sleep apnea improves cardiometabolic function in young obese women with polycystic ovary syndrome. J ClinEndocrinolMetab. 2011; 96: 365-374.
- Moran, LJ.,Ko, H., Misso, M., Marsh, K., Noakes, M., Talbot, M. et al. Dietary Composition in the Treatment of Polycystic Ovary Syndrome: A Systematic Review to Inform Evidence-Based Guidelines. J AcadNutr Diet. 2013; 113 (4): 520-45.
- US Medical Eligibility Criteria for Contraceptive Use. MMWR Recomm Rep. 2010; 59 (3): 1-86.
- Legro, RS., Pauli, JG., Kunselman, AR. et al. Effects of continuous versus cyclical oral contraception: A randomized controlled trial. J ClinEndocrinolMetab. 2008; 93: 420-429.
- American Association of Clinical Endocrinologists Polycystic Ovary Syndrome Writing Committee. American Association of Clinical Endocrinologists Position Statement on Metabolic and Cardiovascular Consequences of Polycystic Ovary Syndrome. EndocrPract. 2005; 11 (2): 126-34.
- Legro, RS., Barnhart, HX., Schlaff, WD., Carr, BR., Diamond, MP., Carson, SA. et al. Clomiphene, metformin, or both for infertility in the polycystic ovary syndrome. N Engl J Med. 2007; 356: 551- 66.
- Lord, JM., Flight, IH., Norman, RJ. Metformin in polycystic ovary syndrome: Systematic review and meta-analysis. BMJ 2003; 327: 951-953.
- Mathur, R., Alexander, CJ., Yano, J., Trivax, B., Azziz, R. Use of metformin in polycystic ovary syndrome. Am J Obstet Gynecol. 2008; 199 (6): 596-609.
- Artini, PG., Di Berardino, OM., Papini, F., Genazzani, AD., Simi, G., Ruggiero, M. et al. Endocrine and clinical effects of myo-inositol administration in polycystic ovary syndrome. A randomized study. GynecolEndocrinol. 2013; 29 (4): 375-9.
- Tang, T., Lord, JM., Norman, RJ.,Yasmin, E., Balen, AH. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligoamenorrhoea and subfertility. Cochrane Database Syst Rev. 2012; 5: CD003053.
- Brown, J., Farquhar, C., Beck, J., Boothroyd, C., Hughes, E. Clomiphene and anti-oestrogens for ovulation induction in PCOS. Cochrane Database Syst Rev. 2009; 4: CD002249.
- Lautatzis, ME., Goulis, DG., Vrontakis, M. Efficacy and safety of metformin during pregnancy in women with gestational diabetes mellitus or polycystic ovary syndrome: A systematic review. Metabolism 2013; 62 (11): 1522-34.
- Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS). Hum Reprod. 2012; 27 (1): 14-24.
- Rosner, W., Auchus, RJ.,Azziz, R., Sluss, PM., Raff, H. Position statement: Utility, limitations, and pitfalls in measuring testosterone: An Endocrine Society position statement. J ClinEndocrinolMetab. 2007; 92: 405-413.
- Balen, AH.,Laven, JS., Tan, SL., Dewailly, D. Ultrasound assessment of the polycystic ovary: International consensus definitions. Hum Reprod Update 2003; 9: 505-514.










