Keywords
System of Activation of the Plasminogen, cancer, u-PA
Introducción
Los biomarcadores son herramientas muy útiles para el diagnóstico y pronóstico de riesgos en pacientes con cáncer, algunos de estos biomarcadores son útiles en la definición y seguimiento de la terapia. En vista de recientes descubrimientos en la biología del cáncer de que factores proteolíticos del Sistema de Activación del Plasminógeno no solo están asociados con la regulación y control del cáncer establecido sino también en el pronóstico, varios investigadores han tratado de elucidar el mecanismo celular mediado por proteasas en la invasión y metástasis del tumor.
Durante la invasión y metástasis del tumor, ocurre entrecruzamiento de las células tumorales, las células del hospedero y la matriz extracelular por unión e interacción con la membrana basal y la matriz extracelular y proteólisis local. La penetración de las células tumorales focaliza la actividad proteolítica en la superficie celular a través de receptores para la plasmina y el activador del Plasminógeno tipo uroquinasa (u-PA). El receptor de las células tumorales para u-PA, denominado u- PAR, une u-PA liberados de las células tumorales cercanas, esta unión u-PA/u-PAR focaliza la acción proteolítica de la superficie de las células tumorales. El u-PA convierte al plasminógeno en plasmina, la plasmina degrada proteínas de la matriz extracelular facilitando la proliferación de las células del tumor, invasión y metástasis [1-3]. La acción proteolítica del u-PA es controlada por sus inhibidores el Inhibidor del Activador del Plasminógeno tipo 1 (PAI-1) y el tipo 2 (PAI-2) los cuales pueden unirse a la superficie de la célula asociado al complejo u-PAR/u-PA formando un complejo trimérico enzimáticamente inactivo receptor-proteasainhibidor el cual es internalizado por las células del tumor [4,5].
Al parecer la proteasa u-PA y el inhibidor PAI-1 están presentes en el tumor para lograr limitar la proteólisis mediada por el receptor del u-PA. La internalización y reciclaje del u-PAR puede restaurar la actividad proteolítica asociada a la superficie celular. Otras proteasas conocidas como catepsinas y metaloroteasas se han visto que están involucrada en la invasión y metástasis tumoral interactuando con el u-PA en una cascada [1,5].
Estudios clínicos han demostrado que en general los tumores elevan los niveles antigénicos de u-PA, u-PAR y/o PAI-1, pero disminuye los niveles de PAI-2, esto está asociado a empeoramiento de la enfermedad y conduce a extensión y metástasis del tumor. Determinación de los factores proteolíticos son de importancia en la clínica para definir pacientes de alto riesgo afectados con tumores sólidos malignos [1].
Componentes del Sistema de Activación del plasminógeno relevantes en la invasión y metástasis del tumor:
El u-PA, una molécula central en la proteólisis pericelular, convierte al plasminógeno enzimáticamente inactivo a plasmina serinoproteasa activa. El u-PA media la conversión del plasminógeno a plasmina esto es controlado por dos inhibidores el PAI-1 y el PAI-2 los cuales inactivan al u-PA por unión al u-PA libre en solución o al u-PA unido a su receptor celular, u-PAR. El u-PA, u-PAR y PAI-1 y 2 están presentes en una variedad de células normales y tumorales. El u-PA es expresado y producido por células normales como las células del túbulo renal, células fagocíticas, neumocitos, queratinocitos, fibroblastos, y células trofoblásticas de la placenta así como también por células tumorales como una pro-enzima (prouPA) con poca o ninguna actividad enzimática intrínseca. Pro-uPA es activada por una variedad de proteasas como la plasmina, catepsinas B/L, calicreina, termolisina convirtiéndola en u-PA una forma enzimáticamente activa de alto peso molecular de doble cadena (Figura 1) [1,2,6].
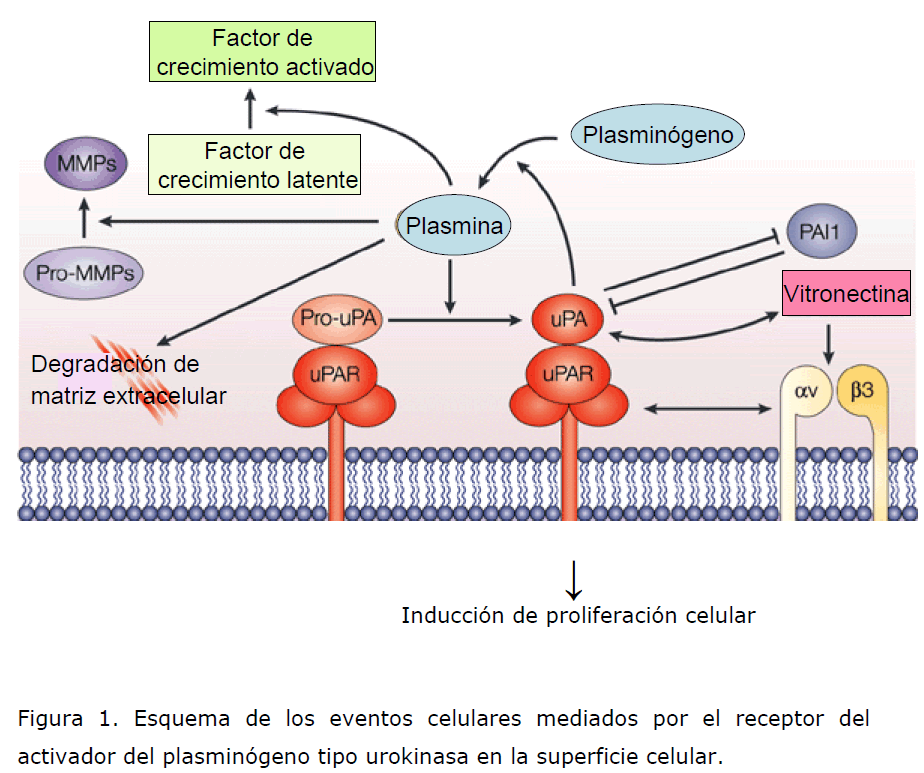
Figura 1. Esquema de los eventos celulares mediados por el receptor del activador del plasminógeno tipo urokinasa en la superficie celular.
El u-PAR es una glicoproteína rica en cisteina, descrita en 1985 por Vassalli y colaboradores en mielocitos humanos y en una línea celular de Leucemia promielocítica U937, está unido a la membrana plasmática por una unión covalente del carboxilo aminoterminal de la proteína a una forma glicosilada del fosfatidil inositol. La unión del u-PA al u-PAR se observa en una variedad de células incluyendo células de Leucemia, migración de células endoteliales y quimiotaxis de neutrófilos humanos entre otros [1,2].
La eficiente invasión de las células tumorales, proteólisis focal y metástasis con el crecimiento de un tumor secundario, está basado en un crítico balance del u- PA, el receptor de superficie celular u-PAR, y el inhibidor PAI-1. Se ha observado en modelos animales que la sobreexpresión de u-PAR en células de cáncer de mama resulta en un incremento en la invasión y metástasis del tumor. El u-PAR no solo se une a u-PA sino también a una proteína rica en la matriz extracelular como lo es la vitronectina, así puede regular la función de las células, adhesión celular y directamente la migración de las células adherentes [1-3,5].
Significado clínico de los componentes del Sistema Activador del plasminógeno:
Ciertos componentes del sistema de activación del plasminógeno pueden servir como marcadores pronósticos en el cáncer humano. Los pacientes con cáncer pueden ser definidos como de bajo y alto riesgo dependiendo de la cantidad de u-PA, u-PAR, o PAI-1 en su tumor primario. Muchos investigadores determinan estos factores en los extractos de tejido de cáncer utilizando ELISA, inmunohistoquímica o midiendo la actividad de u-PA. Estos factores proteolíticos como pronóstico de la enfermedad del cáncer han sido observados en una variedad de tumores, incluyendo cáncer de mama, cuerpo uterino, ovario, estómago, colon, pulmón, cerebro, hígado, vejiga y tejido blando. Análisis estadísticos de estos factores revelaron que u-PA, u-PAR y PAI-1/2 son estadísticamente factores pronóstico independientes con la facultad de predecir si el paciente está libre de enfermedad y/o la supervivencia del mismo [5,7,8].
Cáncer de mama:
En el mundo occidental, el cáncer de mama afecta a una de cada 8 a 10 mujeres. Las pacientes cuyos nódulos linfáticos axilares están cargados de células tumorales (2/3 de todas las pacientes con cáncer de mama) en general reciben una misma terapia adyuvante. El otro tercio cuyos nódulos linfáticos axilares están libres de células cancerígenas (llamadas cáncer de mama nódulo negativo) antes de considerar la terapia adyuvante se les estima la probabilidad de recurrencia de la enfermedad y el beneficio de la terapia, de este modo las pacientes nódulo negativo con alto riesgo pueden ser identificadas y tratadas. Los factores pronósticos tradicionales usados para identificar a las pacientes nódulo negativos con alto y bajo riesgo de recurrencia de la enfermedad, eran parámetros histomorfológicos (por ejemplo: grado nuclear y tamaño del tumor) además de el estado del receptor de las hormonas tiroideas. Otros factores pronósticos como los factores de proteólisis (u-PA, mataloproteasas, catepsinas, sus inhibidores y receptores) han tenido gran aceptación clínica, estos nuevos factores biológicos se ha visto que son mejores que los otros [1,4,5].
La determinación de los factores proteolíticos u-PA, u-PAR y PAI-1 en el tejido tumoral de las pacientes con cáncer de mama, donde están elevados algunos de estos factores en el tumor primario, indica un alto riesgo de desarrollar metástasis. En contraste al u-PA y PAI-1 el aumento de los niveles del activador del plasminógeno tipo tisular (t-PA) es indicador de buen pronóstico. Duffy y colaboradores en 1988, fueron los primeros en describir una correlación significativa entre los niveles enzimáticos elevados del u-PA en extractos de tejido de cáncer primario de mama y la progresión del cáncer [9]. Autores confirmaron que la determinación antigénica del u-PA es un factor pronóstico estadísticamente significativo, independientes de los factores pronósticos tradicionales [10-12].
Jänicke y colaboradores, 1989 reportaron que altos niveles de PAI-1 en el tejido de tumor primario de mama está correlacionado con un pobre pronóstico de las pacientes con cáncer de mama. La elevación del u-PAR, en el tejido de un tumor primario es de mal pronóstico [12]. En contraste niveles elevados de PAI-2 indica buen pronóstico. No es fácil de entender por qué un elevado contenido de PAI-1 en el tumor indica pobre pronóstico para una paciente con cáncer de mama; una explicación es que, por interacción del PAI-1 con el u-PA, se previene la degradación del estroma del tumor (tejido conectivo o matriz extracelular) y es posible la formación de nueva matriz extracelular. El u-PA enzimáticamente activo se une a la superficie de las células del tumor a través de su receptor u-PAR, el PAI-1 puede unirse e inactivar el u-PA, formando un complejo ternario compuesto por u-PAR/u-PA/PAI-1 el cual es rápidamente internalizado por la célula tumoral. La inactivación y liberación de la actividad proteolítica del u-PA de la superficie de las células del tumor puede prevenir la activación del plasminógeno y proteger a la matriz extracelular [1,2,12].
Según observaciones de Kanse y col. y Stefansson y col. (1996), indican que el PAI-1 puede estar también involucrado en la modulación del u-PAR unido a los componentes matriz extracelular. El efecto del PAI-1 en la malignidad de las células tumorales está relacionada con la co-expresión del u-PA, su receptor y el PAI-1 es necesario para focalizar y optimizar la invasión así como para la actividad angiogénica. El PAI-2 muy probablemente actúa en las células tumorales en una vía diferente al PAI-1. El complejo u-PA/PAI-2 no es internalizado al unirse al receptor del u-PA en las células tumorales. El ELISA se usa para determinar u-PA, u-PAR, PAI-1 y PAI-2 en tejido de cáncer de mama. La distribución celular del u-PA, u-PAR y PAI-1/2 en tejido de cáncer de mama ha sido documentado además por inmunohistoquímica y RNA mensajero en hibridización in situ por varios autores [13,14].
Los factores proteolíticos son de especial interés en la clínica de enfermedades de cáncer porque juegan un papel importante en la invasión del tumor, angiogénesis y metástasis. El alto riesgo de pacientes con cáncer de mama puede ser identificado por estos factores permitiendo una individualización de las pacientes tratadas con terapia adyuvante. En cáncer de mama nódulo negativo, generalmente se asume que el pronóstico es bueno en un 70 % de las pacientes con cirugía del tumor primario sin recibir ninguna terapia adyuvante; 30 % de estas pacientes nódulo negativas tienen un riesgo silente de desarrollar metástasis [9,11].
Se ha observado que las pacientes con cáncer de mama nódulo negativos con altos niveles de PAI-1 experimentan un riesgo aumentado de desarrollar metástasis. En comparación con los factores pronósticos tradicionales la incidencia de recurrencia de la enfermedad en 5 años después de cirugía se estima en 39 % en el grupo de alto riesgo definido por elevados niveles de u-PA/PAI-1 versus 6 % en el grupo de bajo riesgo, bajos niveles de u-PA/PAI-1 [2,5,9,11,12].
El poder del u-PA para predecir recurrencia es fuerte en los primeros 3 años, especialmente en pacientes nódulo negativo. Existen posibles asociaciones entre los niveles de u-PA o PAI-1 y la eficacia de la terapia de reemplazo hormonal en 235 pacientes con cáncer de seno, han revelado que los niveles de u-PA en el tumor primario de mama podrían ser útiles en la predicción de supervivencia en respuesta a la terapia con Tamoxifen. Las pacientes con u-PA negativo exhiben mejor respuesta al Tamoxifen que las pacientes u-PA positivas; por el contrario las pacientes con altos niveles de u-PA y/o PAI-1 raramente responden a terapia endocrina cuando ocurre metástasis de la enfermedad [2,9,12].
Cáncer del tracto urogenital:
Fuertes evidencias han demostrado que el u-PA, u-PAR y/o PAI-1 o PAI-2 son predictores de pobre pronóstico en pacientes con cáncer de ovario, endometrio, cuello uterino, vejiga o riñón. Kuhn y colaboradores en 1994 y Konecny y colaboradores en 2001 determinaron la existencia de un fuerte impacto pronóstico del u-PA y PAI-1 en pacientes con cáncer de ovario en estado avanzado, las pacientes con bajos niveles de u-PA y PAI-1 en su tumor primario tienen mucho mejor pronóstico (supervivencia) que las pacientes con elevados niveles de estos factores [15,16]. Hasui y colaboradores, en 1992 demostraron que el u-PA es un marcador pronóstico en pacientes con cáncer de vejiga; el u-PA antigénico determinado por ELISA fue significativamente menor en pacientes con bajo grado y cáncer no invasivo que otros tipos de cáncer de vejiga. Se ha observado en estudios prospectivos de pacientes con cáncer renal que elevados niveles de u-PA, u-PAR y PAI-1 son predictores tempranos de la enfermedad recurrente y metástasis a distancia [17].
Cáncer del tracto gastrointestinal:
Elevados niveles de u-PA y PAI-1 han sido descritos en tumor primario de esófago, estómago, colorectal y cáncer pancreático en comparación con la mucosa normal. La invasión tumoral y las metástasis dependen de la destrucción de la matriz extracelular y de la membrana basal de los vasos, con el paso a la circulación de las células tumorales. Los tumores con alto nivel proteolítico tienen más capacidad invasiva. Uno de los sistemas proteolíticos más importantes es el activador del plasminógeno (u-PA), que incluye una proteasa, el receptor de esta proteína y el inhibidor del activador del plasminógeno (PAI). El cáncer gástrico tiene una sobreexpresión del sistema uPA. El inhibidor PAI-1 se ha considerado un factor pronóstico independiente de supervivencia en algunas series. Se han descrito otras proteasas en cáncer de estómago, como metaloproteínas, cathepsina D, tripsina, etc [18,19].
El análisis de todos estos factores biológicos permite tener un mejor conocimiento del pronóstico de los pacientes para adecuar los tratamientos. Además estos factores se pueden utilizar para mejorar la estadificación de la enfermedad mediante la detección precoz de enfermedad diseminada, de otra forma no identificable por métodos radiológicos o clínicos, mediante el análisis molecular en sangre periférica de PAI [18,20].
El impacto pronóstico de elevados niveles de u-PA y PAI-1 en pacientes con resección completa de cáncer gástrico está asociado con pobre pronóstico, además se ha mostrado que pacientes con cáncer gástrico con u-PA positivo/PAI-2 negativo tienen un peor pronóstico que otros pacientes. El PAI-1 y u-PA positivos pueden servir como factores pronósticos en el cáncer gástrico, para predecir la corta supervivencia de los pacientes lo cual es de gran importancia clínica. También se ha observado que la expresión del u-PA, u-PAR, PAI-1 y PAI-2 tienen importancia predictiva en el desarrollo de cáncer colorectal, metástasis hepática y supervivencia, independiente de los parámetros de mejora clínico-patológico. Además el u-PA, u-PAR y/o PAI-1 y PAI-2 son importantes en el pronóstico de cáncer de cerebro y pulmón [18,20,21].
El Sistema de activación del plasminógeno y su asociación con el tumor son de interés para la terapia del cáncer:
Alrededor de 1947 Astrup y Permin describieron la actividad del activador del plasminógeno en tejido, en 1951 Williams demostró la presencia de sustancias (uroquinasa) capaces de activar al plasminógeno en orina. Se ha demostrado que los componentes del sistema de activación del plasminógeno están involucrados en la proliferación, invasión y metástasis de las células tumorales. Se ha sugerido que la invasión de estos factores podría servir como objetivo para nuevos tratamientos con el fin de prevenir la invasión y metástasis del tumor [1,6].
La estrecha correlación entre elevados niveles de u-PA, u-PAR y/o PAI-1 y PAI-2 en el tejido de cáncer primario y el fenotipo de malignidad son puntos básicos para explorar nuevos conceptos orientados a la biología del tumor con el objeto de suprimir la expresión del u-PA, u-PAR y PAI-1, inhibir la actividad enzimática del u- PA o abolir la interacción del u-PA con su receptor celular (u-PAR) [1,6].
Se ha observado que la interrupción de la interacción del u-PA a su receptor reduce la invasión y crecimiento del tumor; también la prevención de la metástasis del cáncer por inhibidores sintéticos de la actividad enzimática del u-PA, además de la capacidad de un inhibidor selectivo de la actividad enzimática del u-PA para prevenir el desarrollo del crecimiento y la invasión del tumor. Estos estudios demuestran que inhibidores específicos del u-PA pueden disminuir el tamaño del tumor primario y la invasión así como la metástasis en el cáncer de mama y próstata donde el u-PA está implicado como uno de los mayores factores patogénicos. La interacción del u-PAR con las integrinas, el receptor celular de las proteínas de matriz extracelular, pueden ser bloqueadas por un péptido sintético que se une al u-PAR e interrumpe la interacción matriz/célula tumoral [1,6].
Conclusión
Los factores proteolíticos u-PA, u-PAR, PAI-1 y PAI-2 del sistema de activación del plasminógeno están implicados en la degradación y remodelación del tejido normal, cancerígeno y de la matriz extracelular. En pacientes con cáncer el incremento de estos factores proteolíticos está asociado con la progresión del tumor y con una corta supervivencia y/o tiempo sin enfermedad. Los componentes del sistema de activación del plasminógeno son de objetivo potencial para el desarrollo de una terapia anti-invasiva y anti-metastásica, esta terapia puede ser posible con componentes de inhibición de la unión del u-PA a su receptor, u-PAR; o con inhibidores específicos de la actividad enzimática del u-PA. Existen inhibidores sintéticos de la actividad enzimática del u-PA para prevenir la metástasis del cáncer, los cuales previenen el crecimiento y la invasión del tumor.
1375
References
- Andreasen PA, Kjoller L, Christensen L, Duffy MJ. The urokinase-type plasminogen activator system in cancer metastasis: a review. Int J Cancer. 1997 Jul 3;72(1):1-22.
- Harbeck N, Alt U, Berger U, Kruger A, Thomssen C, Janicke F, Hofler H, Kates RE, Schmitt M. Prognostic impact of proteolytic factors (urokinase-type plasminogen activator, plasminogen activator inhibitor 1, and cathepsins B, D, and L) in primary breast cancer reflects effects of adjuvant systemic therapy. Clin Cancer Res. 2001 Sep;7(9):2757-64.
- Konecny G, Untch M, Pihan A, Kimmig R, Gropp M, Stieber P, Hepp H, Slamon D, Pegram M. Association of urokinase-type plasminogen activator and its inhibitor with disease progression and prognosis in ovarian cancer. Clin Cancer Res. 2001 Jun;7(6):1743-9.
- Costantini V, Sidoni A, Deveglia R, Cazzato OA, Bellezza G, Ferri I, Bucciarelli E, Nenci GG. Combined overexpression of urokinase, urokinase receptor, and plasminogen activator inhibitor-1 is associated with breast cancer progression: an immunohistochemical comparison of normal, benign, and malignant breast tissues. Cancer. 1996 Mar 15;77(6):1079-88.
- Janicke F, Schmitt M, Graeff H. Clinical relevance of the urokinase-type and tissue-type plasminogen activators and of their type 1 inhibitor in breast cancer. Semin Thromb Hemost. 1991 Jul;17(3):303-12.
- Schmitt M, Harbeck N, Thomssen C, Wilhelm O, Magdolen V, Reuning U, Ulm K, Hofler H, Janicke F, Graeff H. Clinical impact of the plasminogen activation system in tumor invasion and metastasis: prognostic relevance and target for therapy. Thromb Haemost. 1997 Jul; 78(1):285-96.
- Nekarda H, Schmitt M, Ulm K, Wenninger A, Vogelsang H, Becker K, Roder JD, Fink U, Siewert JR. Prognostic impact of urokinase-type plasminogen activator and its inhibitor PAI-1 in completely resected gastric cancer. Cancer Res. 1994 Jun 1;54(11):2900-7.
- Nielsen HJ, Pappot H, Christensen IJ, Brunner N, Thorlacius-Ussing O, Moesgaard F, Dano K, Grondahl-Hansen J. Association between plasma concentrations of plasminogen activator inhibitor-1 and survival in patients with colorectal cancer. BMJ. 1998 Mar 14;316(7134):829-30.
- Duffy MJ, O'Grady P, Devaney D, O'Siorain L, Fennelly JJ, Lijnen HJ. Urokinaseplasminogen activator, a marker for aggressive breast carcinomas. Preliminary report. Cancer. 1988 Aug 1;62(3):531-3
- Duffy MJ. Plasminogen activators and cancer. Blood Coagul Fibrinolysis. 1990 Dec; 1(6):681-7.
- Duffy MJ, Reilly D, O'Sullivan C, O'Higgins N, Fennelly JJ, Andreasen P. Urokinase-plasminogen activator, a new and independent prognostic marker in breast cancer. Cancer Res. 1990 Nov 1; 50(21):6827-9.
- Janicke F, Schmitt M, Ulm K, Gossner W, Graeff H. Urokinase-type plasminogen activator antigen and early relapse in breast cancer. Lancet. 1989 Oct 28;2(8670):1049.
- Kanse SM, Kost C, Wilhelm OG, Andreasen PA, Preissner KT. The urokinase receptor is a major vitronectin-binding protein on endothelial cells. Exp Cell Res. 1996 May 1;224(2):344-53.
- Stefansson S, Lawrence DA. The serpin PAI-1 inhibits cell migration by blocking integrin alpha V beta 3 binding to vitronectin. Nature. 1996 Oct 3;383(6599):441-3.
- Kuhn W, Pache L, Schmalfeldt B, Dettmar P, Schmitt M, Janicke F, Graeff H. Urokinase (uPA) and PAI-1 predict survival in advanced ovarian cancer patients (FIGO III) after radical surgery and platinum-based chemotherapy. Gynecol Oncol. 1994 Dec;55(3 Pt 1):401-9.
- Konecny G, Untch M, Arboleda J, Wilson C, Kahlert S, Boettcher B, Felber M, Beryt M, Lude S, Hepp H, Slamon D, Pegram M. Her-2/neu and urokinase-type plasminogen activator and its inhibitor in breast cancer. Clin Cancer Res. 2001 Aug;7(8):2448-57.
- Hasui Y, Marutsuka K, Suzumiya J, Kitada S, Osada Y, Sumiyoshi A. The content of urokinase-type plasminogen activator antigen as a prognostic factor in urinary bladder cancer. Int J Cancer. 1992 Apr 1;50(6):871-3.
- Kaneko T, Konno H, Baba M, Tanaka T, Nakamura S. Urokinase-type plasminogen activator expression correlates with tumor angiogenesis and poor outcome in gastric cancer. Cancer Sci. 2003 Jan;94(1):43-9.
- Ji F, Chen YL, Jin EY, Wang WL, Yang ZL, Li YM. Relationship between matrix metalloproteinase-2 mRNA expression and clinicopathological and urokinasetype plasminogen activator system parameters and prognosis in human gastric cancer. World J Gastroenterol. 2005 Jun 7;11(21):3222-6.
- Kaneko T, Konno H, Baba M, Tanaka T, Nakamura S. Urokinase-type plasminogen activator expression correlates with tumor angiogenesis and poor outcome in gastric cancer. Cancer Sci. 2003 Jan; 94(1):43-9.
- Iwamoto J, Mizokami Y, Takahashi K, Nakajima K, Ohtsubo T, Miura S, Narasaka T, Takeyama H, Omata T, Shimokobe K, Ito M, Takehara H, Matsuoka T. Expressions of urokinase-type plasminogen activator, its receptor and plasminogen activator inhibitor-1 in gastric cancer cells and effects of Helicobacter pylori. Scand J Gastroenterol. 2005 Jul;40(7):783-93.






