Introducción
Datos epidemiológicos
La Enfermedad de Alzheimer (EA) es una enfermedad neurodegenerativa que resulta devastadora
tanto para el paciente como para sus familiares. Su prevalencia se duplica cada cinco años a partir
de los 65 años hasta los 85, así varía desde el 1% a los 60 años hasta el 32,2% a los 94 años de
edad. La incidencia es superior al 1% para el conjunto de la población de edad igual o mayor a los
65 años. En España la cifra de personas que padece EA asciende a más de 400.000, según el
estudio recogido en el Libro Blanco del deterioro cognitivo en el envejecimiento y demencia en
España [realizado por el Gabinete de Estudios Sociológicos Bernard Kriel hace ya varios años], que
representa el primer estudio nacional sobre este tema. Respecto al coste de los recursos sanitarios
los datos que se tienen en España corresponden a un estudio realizado en el año 1999 (Boada,
1999). El resultado medio anual obtenido fue de 19.170€. Uno de los factores que más influye en el
coste anual por enfermo es el grado de deterioro cognitivo al diagnóstico, por lo que alcanzar un
diagnóstico certero precoz debe ser un reto prioritario y para ello es necesario contar con pruebas
complementarias que apoyen el método clínico.
Diagnóstico
Actualmente el diagnóstico de EA se basa en criterios clínicos que ofrecen una sensibilidad y
especificidad de aproximadamente el 70% en fases moderadas de la enfermedad. En los últimos
años se han multiplicado los esfuerzos por encontrar alguna molécula cuya presencia pueda ser
detectada en algún fluido corporal en pacientes con deterioro cognitivo de forma que ayude al diagnóstico de la EA. Hasta el momento los únicos resultados moderadamente satisfactorios se han
obtenido mediante la estimación de los niveles en líquido cefalorraquídeo de dos proteínas que
están directamente implicadas en la patogenia de la EA (la proteína tau fosforilada y la proteína ßamiloide),
sin embargo su determinación no ha trascendido a la práctica clínica habitual porque
supone la realización de una punción lumbar y la relativamente baja eficacia del diagnostico no
justifica el procedimiento. Es prioritario, por tanto, hallar una molécula cuyos niveles, medidos en
fluidos periféricos (sangre u orina), se correlacionen con los distintos estadios evolutivos de la EA,
permitiendo no solo un diagnostico sensible y especifico sino también la monitorización de la
evolución de la EA. En la actualidad varias moléculas están siendo estudiados con este objetivo y
como veremos más adelante la Kalikreína 6 es una de las más prometedoras.
Las Kalikreínas
Genes de la familia de la kalikreína
Las Kalikreínas tisulares son una subfamilia de serín proteasas con un alto grado de especificidad
de substrato y variada expresión in diversos tejidos y fluidos biológicos.
En las actualidad las Kalikreínas se dividen en dos grupos, plasmáticas y tisulares que difieren
tanto en peso molecular como especificidad de substrato, características inmunológicas y
estructura génica. Las kalikreinas plasmáticas son sintetizadas exclusivamente en el hígado y están
implicadas en coagulación y fibrinolisis, regulación de la presión arterial y reacciones inflamatorias
(2). Las kalikreínas tisulares están implicadas en procesamiento post-translacional de péptidos y
potencialmente liberación de péptidos de gran importancia biológica como la kinina (3). Las
Kalikreínas tisulares, también llamadas kininogenasas, son enzimas que inactivas kininas(4). La
Kalikreína K1 digiere kininógeno generando bradiquinina y por lo tanto modulando funciones
biológicas tan variadas como presión arterial, balance electrolítico e inflamación así como
angiogénesis o control de niveles de factores de crecimiento, hormonas y citokinas a las que puede
digerir (5).
Kalikreínas humanas
Los genes que codifican para las Kalikreínas humanas se encuentran localizados como un grupo en
el mismo locus cromosómico. Los genes de las Kalikreínas tisulares humanas se encuentran en el
cromosoma 19 (6). Todos los genes están localizados dentro de una región de 320 kilobases y
codifican para proteínas cuyo peso molecular oscila entre 27 y 40 kDa. Todas las Kalikreínas son
serín proteasas con un aminoácido serina conservado en las secuencia Gly-Asp-Ser-Gly del centro
activo (7).
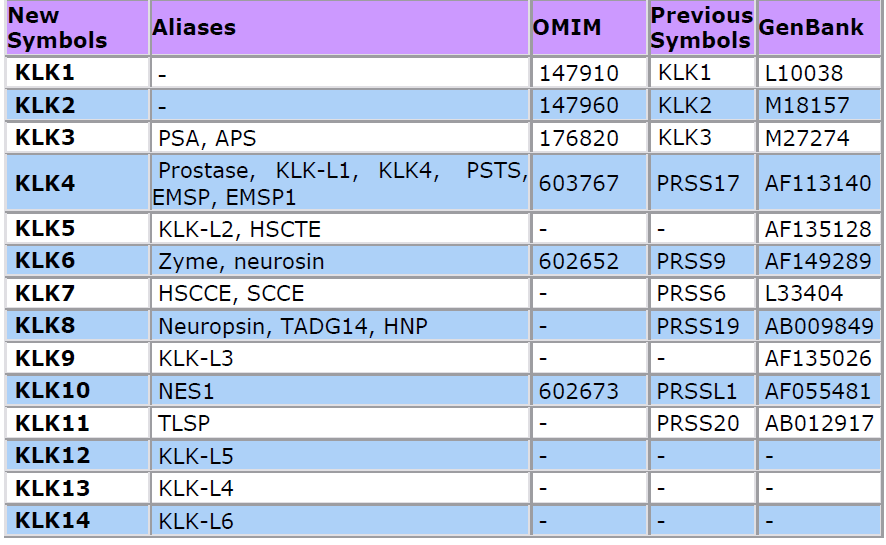
Tres proteínas del grupo de las Kalikreínas son llamadas Kalikreínas clásicas en referencia al hecho
de que fueron las primeras descritas. Este grupo incluye hK1, hK2 y hK3. El resto se conocen como
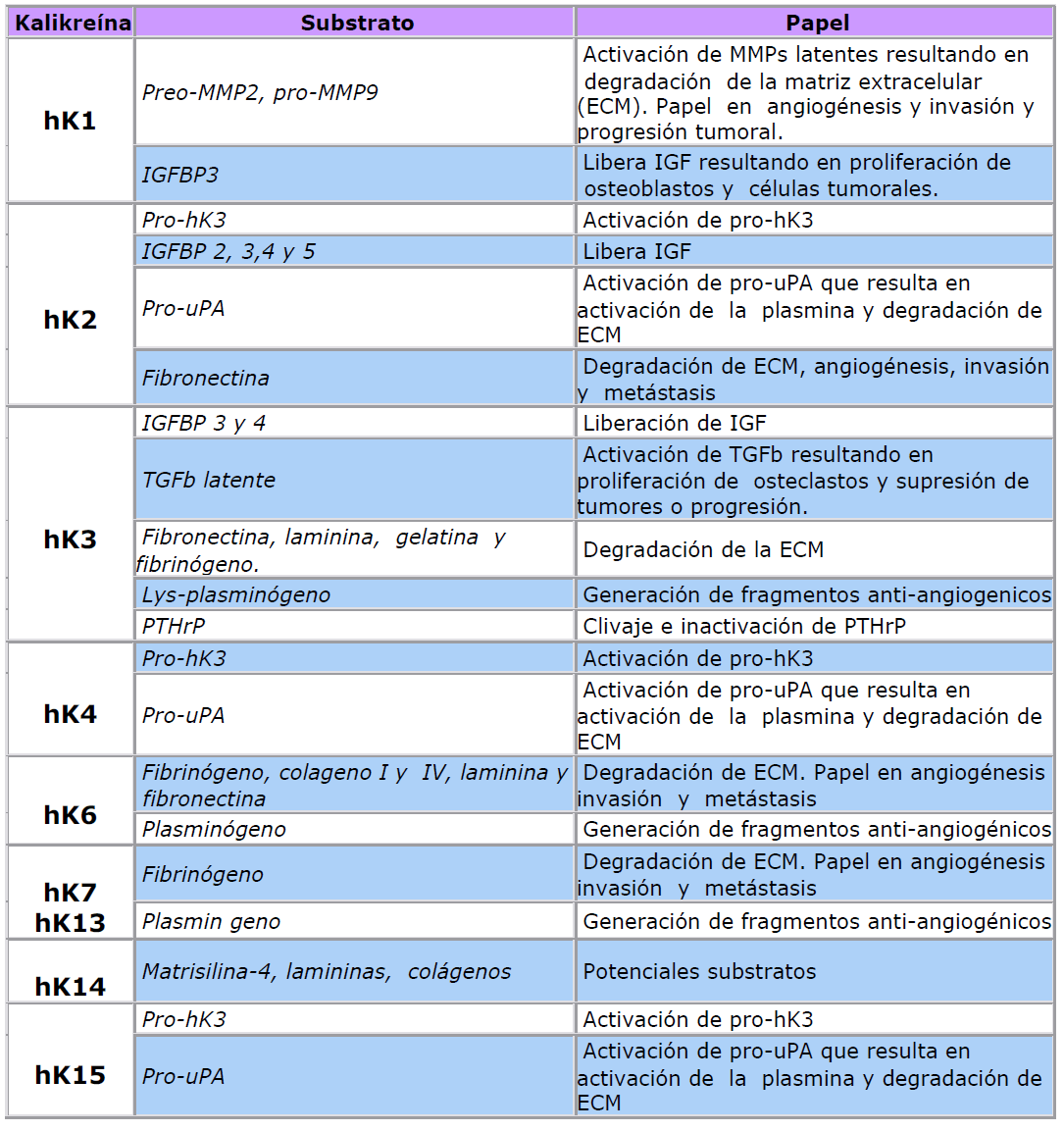
nuevas Kalikreínas. Numerosas funciones han sido descritas para las Kalikreínas tanto en fisiología
normal como en progresión tumoral y las hemos resumido en la tabla que sigue:
Valor diagnóstico y pronóstico de las Kalikreínas
En 1998 la Federal and Drug Administration (FDA) aprobó para su uso en clínica la determinación
de PSA (antígeno prostático específico o hK3) libre como un test diagnostico que se correlaciona
con la probabilidad de existencia de cáncer de próstata. Este test diagnostico es universalmente
aceptado y es clave en el diagnostico y estudio de la evolución del cáncer de próstata.
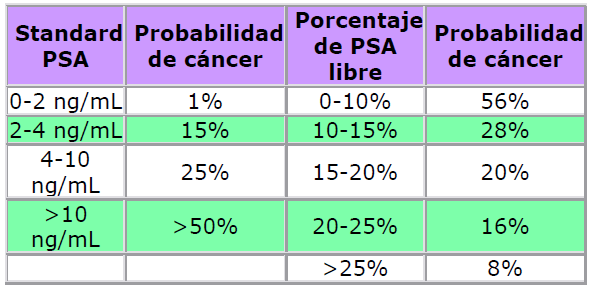
Están por demostrar los valores predictivos que tienen otras kalikreínas como biomarcadores de
aquellas enfermedades con las que se han relacionado. Con la EA se han relacionado de una forma
u otra las Kalikreínas 6, 7, 8 y 10, si bien aún no se han realizado los estudios necesarios para
conocer su sensibilidad y especificidad.
La Kalikreína 6
Tal como se ha señalado, el gen de la Kalikreína 6 se encuentra
localizado en el cromosoma 19q13.3-q13.4, y está compuesto de
7 exones de los cuales los dos primeros no se trascriben (8). La
Kalikreína 6 tiene una pauta abierta de lectura de 732 pares de
bases que codifican una proteína de 244 aminoácidos sintetiza
como pre-pro-hK6. Una vez el peptido senal es liberado la prohK6
es liberada al medio extracelular, donde un nuevo clivaje
mediado por la cual probablemente es predecesora de una forma
activa de 223 aminoácidos aunque esto no ha sido demostrado,
compartiendo ~30% de similitud con otras Kalikreínas.
La Kalicreína tipo 6 (hk6), también conocida como neurosina,
zyme o proteasa M, es una serín proteasa “similar a tripsina”
como demuestran los datos de cristalización (9) expresada
principalmente en el cerebro humano (Figura 1).
Figura 1. Expresión de hK6. Obtenido de GeneCard for gene KLK6 GC19M056153.
https://bioinfo.weizmann.ac.il/cards-bin/carddisp?KLK6&search=KLK6
En el cerebro, hK6 es expresada en el epitelio del plexo coroideo (10) y en los oligodendrocitos
(células productoras de mielina en el sistema nervioso central) maduros (11) existiendo una
relación entre hK6 y enfermedades desmielinizantes (12) de forma que el bloqueo de la actividad
de hK6 atenua enfermedades inflamatorias del sistema nervioso central (13).
Kalikreína 6 como biomarcador de la Enfermedad de Alzheimer
Se ha encontrado hK6 presente en liquido cefalorraquídeo humano en condiciones de normalidad
(14), aunque esta forma aislada corresponde a la proteína completa sin procesamiento de la región pro como lo demuestra el hecho de que su secuencia N-terminal sea Glu-Glu-Gln-Asn-Lys y por lo
tanto presumiblemente inactiva. Curiosamente, en pacientes con Enfermedad de Alzheimer la
concentración de hK6 en líquido cefalorraquídeo es ~3 veces superiores (15) aunque otros autores
afirman que se encuentran disminuidos (14) mientras que en sangre la concentración es unas 10
veces superior a la normal (15).
No parece existir controversia en los datos que afirman una disminución de los niveles de hK6 en
parénquima cerebral de pacientes con EA (16) donde se localiza en las placas seniles y ovillos
neurofibrilares (17). El mecanismo patogénico por el que la hK6 puede estar implicada en la
enfermedad de Alzheimer no esta claro, si bien en cierto modo parece que hk6 posee propiedades
amiloidogénicas (18).
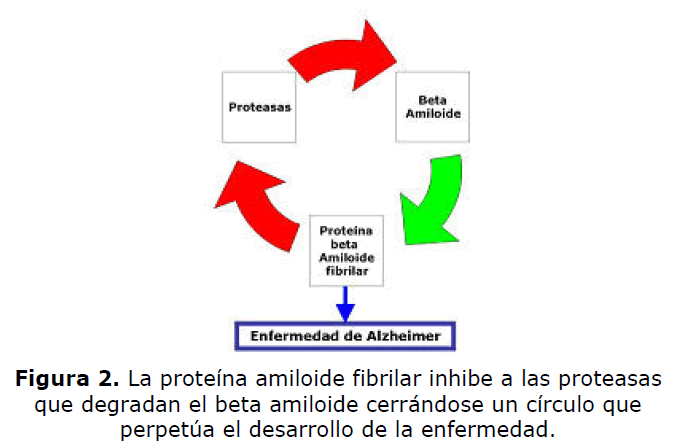
Por un lado se sabe que la proteína beta amiloide fibrilar (fAß), que es uno de los principales
componentes de las pacas amiloides que aparecen en la EA, inhibe la actividad proteásica de
ciertas proteínas, tales como la proteasa bovina cerebral de alto peso molecular y la tripsina (19),
por lo que muy probablemente también inhiba a hk6. Además fAß es resistente a la actición
proteolítica de la tripsina desde fases tempranas de la enfermedad, cuando se comienzan a formar
los agregados de beta-amiloide. Todo ello sugiere que la fibrilación de Abeta puede afectar al
propio aclaramiento de Abeta por la inhibición de proteasas cerebrales, cerrándose un círculo
vicioso que hace progresar la enfermedad (Figura 2).
Figura 2. La proteína amiloide fibrilar inhibe a las proteasas
que degradan el beta amiloide cerrándose un círculo que
perpetúa el desarrollo de la enfermedad.
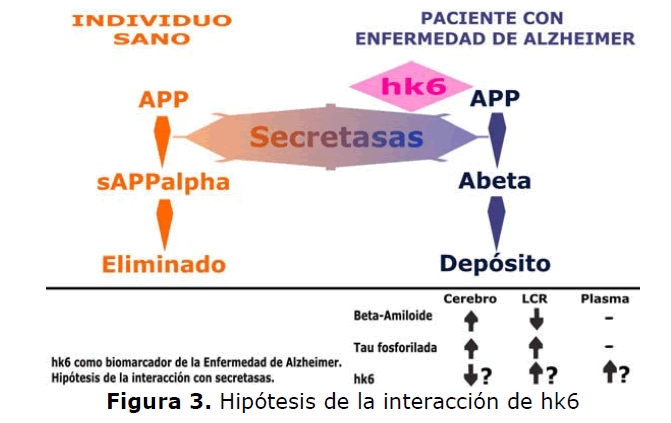
Por otro lado, una de las hipótesis más plausibles es que hk6 actúa regulando el balance de las
distintas secretasas (Figura 3) que procesan la proteína beta amiloide, deshaciendo el equilibrio
fisiológico en favor de la beta secretasa (BACE) que genera amiloide 1-42 que no puede ser
eliminado desencadenándose así la casacada amiloide.
Figura 3. Hipótesis de la interacción de hk6
No obstante los estudios realizados hasta el momento incluyen un número escaso de pacientes y
no se han incluído otros pacientes con otros tipos de demencia, por lo que para comprobar la
sensibilidad y especificidad de esta prueba son necesarios estudios más amplios
Clonación y Purificación de Kalikreína 6
El primer paso necesario para la determinación y cuantificación de cualquier proteína es su
purificación. En las líneas siguientes describimos el procedimiento que nuestro grupo a desarrollado
para lograr este objetivo.
Se ha extraído mRNA de células SW-13 usando el kit RNAeasy obtenido de Qiagen, Valencia, CA,
siguiendo las instrucciones del proveedor. El DNA fue digerido con DNase obtenida de Ambion,
Austin, TX, y cDNA fue sintetizado usando el First-Strand cDNA synthesis kit obtenido de
Invitrogen, La Jolla, CA seguido de digestión con RNase obtenida de Ambion, Austin, TX. Se usaron
100 ng de cDNA para amplificar la secuencia de hK6 en una reacción de PCR de 50 μl con 1 U of
Platinum® Taq polymerase High Fidelity, 5 ml de cDNA de la reacción anterior, 60 mM Tris-SO4pH
8.9, 18 mM (NH4)2SO4, 2mM Mg2SO4, usando 0.2 μM de los primeros.
5’-CACCATGAAGAAGCTGATGGTGGTG-3’
5’-CTTGGCCTGAATGGTTTTTTGGAT-3’
El producto de PCR fue visualizado en gel de agarosa tenido con bromuro de etidio y la la banda
correspondiente a hK6 extraída y purificada usando el Gel extracción Kit obtenido de Qiagen
siguiendo las instrucciones del proveedor.
La secuencia de la hK6 fue insertada en el plásmido pCDNA6.2/GW/V5/D-TOPO obtenido de
Invitrogen en siguiendo las instrucciones del proveedor. El inserto fue secuenciado y su secuencia
depositada en GenBank con Accession Number AY785948.
Dicho vector fue transfectado en células HEK293 usando Fugene 6.0 obtenido de Roche,
Indianapolis, IN, y las células seleccionadas usando 100 mg/ml de blasticidina en el medio de
cultivo durante dos semanas. Los niveles de expresión de hK6 se comprobaron mediante análisis
de Western-blot incubados con anticuerpos anti-V5 como se muestra en la Figura 4.
El clon HEK293-hK6-12 fue seleccionado para obtener 1 litro de medio de cultivo que se uso para
purificar hK6. El medio fue filtrado a 0.22 mm e incubado con 10 mg de anticuerpo anti-V5 y 200 μl
de proteína G-agarosa durante 12 horas. El medio fue pasado a través de una columna para
capturar las bolas de agarosa que fueron subsecuentemente lavadas con 5 ml de NaCl 50 mM en
HEPES 20 mM, pH 7.4 y eluidas en 5 ml de NaCl 2M en HEPES 20 mM, pH 7.4. La muestra fue
dializada contra 1.5 l de NaCl 50 mM en HEPES 20 mM, pH 7.4 y concentrada hasta 100 ml usando
Amicon Centrifugal Devices obtenidos de Millipore, Billerica, MA. Los resultados finales se muestran
Bibliografía
- Boada, M., J. Pena-Casanova, et al. (1999). "Costs of health care resources of ambulatorycare patients diagnosed with Alzheimer's disease in Spain." Med Clin (Barc) 113(18): 690-5.
- Bhoola, K. D., C. J. Elson, et al. (1992). "Kinins--key mediators in inflammatory arthritis?" Br J Rheumatol 31(8): 509-18.
- Clements, J., A. Mukhtar, et al. (1997). "Kallikreins and kinins in inflammatory-like events in the reproductive tract." Pharmacol Res 35(6): 537-40.
- Yousef, G. M. and E. P. Diamandis (2001). "The new human tissue kallikrein gene family: structure, function, and association to disease." Endocr Rev 22(2): 184-204.
- Bhoola, K. D., Figueroa C. D., et al. (1992). "Bioregulation of kinins: kallikreins, kininogens, and kininases." Pharmacol Rev 44(1): 1-80.
- Clements, J., A. Mukhtar, et al. (1997). "Kallikreins and kinins in inflammatory-like events in the reproductive tract." Pharmacol Res 35(6): 537-40.
- Neurath, H., K. A. Walsh, et al. (1967). "Evolution of structure and function of proteases." Science 158(809): 1638-44.
- Yousef, G. M., L. Y. Luo, et al. (1999). "Molecular characterization of zyme/protease M/neurosin (PRSS9), a hormonally regulated kallikrein-like serine protease." Genomics 62(2): 251-9.
- Bernett, M. J., S. I. Blaber, et al. (2002). "Crystal structure and biochemical characterization of human kallikrein 6 reveals that a trypsin-like kallikrein is expressed in the central nervous system." J Biol Chem 277(27): 24562-70.
- Petraki C, Karavana N, Skoufogiannis P, Little S, Howarth D, Yousef G, Diamandis E.The Spectrum of Human Kallikrein 6 (Zyme/Protease M/Neurosin) Expression in Human Tissues as Assessed by Immunohistochemistry. Journal of Histochemistry and Cytochemistry, Vol. 49, 1431-1442.
- Yamanaka, H., X. He, et al. (1999). "Protease M/neurosin mRNA is expressed in mature oligodendrocytes." Brain Res Mol Brain Res 71(2): 217-24.
- Scarisbrick, I. A., S. I. Blaber, et al. (2002). "Activity of a newly identified serine protease in CNS demyelination." Brain 125(Pt 6): 1283-96.
- Blaber, S. I., B. Ciric, et al. (2004). "Targeting kallikrein 6 proteolysis attenuates CNS inflammatory disease." Faseb J 18(7): 920-2.
- Mitsui, S., A. Okui, et al. (2002). "Decreased cerebrospinal fluid levels of neurosin (KLK6), an aging-related protease, as a possible new risk factor for Alzheimer's disease." Ann N Y Acad Sci 977: 216-23.
- Diamandis, E. P., G. M. Yousef, et al. (2000). "Human kallikrein 6 as a biomarker of alzheimer's disease." Clin Biochem 33(8): 663-7.
- Zarghooni, M., A. Soosaipillai, et al. (2002). "Decreased
1405