Keywords
Gereralized Lupus Erythematosus, antigens, auto-antibodies.
Introducción
El Lupus Eritematoso Generalizado (LEG), es una enfermedad autoinmune [1] policlonal [2] inflamatoria, crónica [3] y multisistémica [4,5] cuya etiología es multifactorial [5,6]. El LEG se caracteriza por la producción de auto-anticuerpos [7] y puede ser una enfermedad órgano-especifica o sistémica, generando varias manifestaciones clínicas debido a la ubicuidad de estos autoantígenos [8]. Afecta al 0.1% de la población y es más frecuente en mujeres que en hombres [8,9,10]. Se ha descrito que cerca del 25% de personas con LEG también pueden desarrollar el síndrome de Sjörgren [3].
En la patogenia del LEG están involucrados factores ambientales, genéticos [14] y hormonales [3,11], que contribuyen a la perdida de la tolerancia inmunológica [8,12]. Aunque la mayor incidencia es de mujeres en edad fértil, también se presenta en niños, mujeres postmenopausicas y en hombres, donde es más severa la enfermedad [8,12]. Cuando el LEG se presenta en una edad avanzada, es menos probable la afectación a los principales órganos y sistemas. El LEG es más frecuente en niños y mujeres jóvenes, pero en la edad pediátrica, la severidad no está influida por el género, como se presenta en los adultos [12].
El LEG se caracteriza por la activación e hiperreactividad de linfocitos B (LB) [10] y formación de auto-anticuerpos [13], mediados por la secreción de diversas citocinas producidas por linfocitos T (LT) [3,14]. Los principales indicadores de la enfermedad son los auto-anticuerpos, complejos inmunes, factores del complemento y las células autorreactivas [3]. El LEG incluye además inflamación e incremento de muerte celular por apoptosis [15].
Los auto-anticuerpos se unen a los antígenos propios (RNA, DNA, restos apotóticos, etc.) que al entrar al torrente sanguíneo, a estas uniones se le denomina complejos inmunes [8], los cuales se pueden depositar en las membranas basales llevando a la activación del complemento [15], lo que provoca la aparición del proceso inflamatorio y en consecuencia manifestaciones clínicas dependiendo del órgano blanco [9], un ejemplo son aquellos complejos inmunes formados por anticuerpos anti-DNA de doble cadena (anti-sdDNA) que participan en el daño renal y cutáneo [8].
Otros complejos inmunes se unen al receptor FcyRIIa de las células dendríticas plasmocitoides (DCp) o al receptor de antígeno del LB específico. Ya acoplados al receptor, serán internalizados y se unirán a uno de los receptores de la membrana endosómica TLR (Toll like receptor) que son parte del sistema inmunitario innato. Se han descubierto 13 TLRs distintos localizados en membrana celular o en vesículas endosómicas y tienen gran especificidad por su ligando respectivo. El TLR-7 reconoce específicamente RNA de cadena simple y el TLR-9 a DNA (ambos en membrana endosómica), ya unidos éstos complejos antígeno-anticuerpo con los receptores TLRs activan una cascada de cinasas que conllevan a la síntesis masiva de interferón alfa (INF-a). También se han identificado estímulos endógenos capaces de inducir interferón tipo 1 por vías independientes a los TLRs. Además de la estimulación de INF-a, se producen las citocinas IL-2, IFNg, IL-4, IL-6, IL-10 y TGF–β (Factor del crecimiento transformante beta), BAFF (BLyS) y APRIL, estas dos últimas promotoras de la supervivencia y diferenciación de LB [16].
Una de las citocinas más importantes en la patogenia del LEG, es el interferón tipo 1, el cual, actúa como una molécula de estrés en el sistema inmune, señalando peligro en la patogenicidad y sus efectos influyen sobre la mayoría de los procesos de regulación, es decir, actúa como un factor inmunomodulador en varias células blanco, como células dendríticas (CD), CDp, LT citotóxicos, células NK (Natural killer), LT cooperadoras (Th), LB, etc. [8].
Para la activación constante de LB, encontramos el factor activador de LB (BAFF), el cual es regulado por INFg, IL-10 e IL-6. El INFg también participa en el desequilibrio de la tolerancia hacia autoantígenos, aumentando la expresión del complejo mayor de histocompatibilidad (CMH) de clase II. Otra citocina descrita en LEG, es el TNF-a, que junto con IFNg e IL-10 están relacionadas con nefritis lúpica y la IL-6 con lupus discoide cutáneo [17].
Los pacientes manifiestan alteraciones en el sistema nervioso central (SNC), renales, articulares, hematológicas, vasculitis [3], arteriosclerosis acelerada, arteriopatía coronaria y osteoporosis entre las más frecuentes [18]. Se cree que es la enfermedad autoinmune con más variedad serológica y clínica [19] y es por ello que se considera como no órgano-específica, ya que puede afectar a cualquier órgano de muy diversas formas y grados, por consiguiente presenta un número amplio de auto-anticuerpos en cada paciente [20].
Los anticuerpos antinucleares (ANA) se presentan en un 98- 99.5% en pacientes con LEG, el 0.5% que no los presentan se denominan seronegativos. Los anticuerpos son un factor característico, pero no solo se presentan en esta patología, inclusive se encuentra presente en títulos bajos en un 5% de la población en general aumentando su prevalencia con la edad [15.21]. Los ANA del tipo autoinmunes, reflejan la perdida de tolerancia a lo propio y su origen es multifactorial [22]. A la fecha se conocen más de 100 antígenos específicos de LEG, sin embargo los más estudiados y con mayor especificidad son: sdDNA, ssDNA (DNA de cadena simple), antígenos extraíbles del núcleo (ENA, por sus siglas en ingles) (como Sm RNP, Ro y La), histonas y cromatina [12,15,22,23].
Los anti-sdDNA son muy importantes ya que son los principales para diagnóstico y análisis de la enfermedad, se observa que están presentes en el 40-60% de los pacientes, y es muy específicos para LEG, en comparación con anti-ssDNA que a pesar de que se encuentran en un 90% de los pacientes con LEG, son menos específicos ya que se encuentran en otras enfermedades autoinmunes. Los anti-DNA son los principales promotores del daño renal, se encuentran ubicados en el colágeno de la membrana basal del riñón y la piel, donde los anticuerpos anti-DNA se unirán a ellos, desencadenando una respuesta inflamatoria donde intervienen los múltiples mediadores inflamatorios [18].
Para entender la compleja etiología y desarrollo de LEG en la práctica clínica, es importante entender su comportamiento en cada individuo. Una manera es investigar la reactividad de los auto-anticuerpos y sus moléculas blanco, los cuales nos pueden indicar la agresividad y el curso de la enfermedad [24]. Por lo anterior, se propuso estudiar la prevalencia de antígenos que son blanco de auto-anticuerpos en pacientes con LEG en este entorno geográfico. El objetivo del presente estudio fue caracterizar los antígenos celulares reconocidos por el suero de pacientes con LEG de este entorno geográfico.
Material y Métodos
Lugar y selección de pacientes para la toma de muestras sanguíneas: Se colectaron las muestras de pacientes que acudieron a consulta en el sector público (IMSS) en las ciudades de Villanueva y de Zacatecas. La selección de los pacientes se basó en los criterios de clasificación establecidos por el Colegio Americano de Reumatología (CAR). Se tomaron muestras sanguíneas de pacientes con reciente diagnostico y otros con años de haberse hecho el diagnóstico.
Obtención del suero: Se colectó sangre venosa, por cada paciente se tomó una muestra de 10 mL por venopunción, se pasó a un tubo de ensayo sin anticoagulante. Las muestras obtenidas fueron centrifugadas a 1,500 r.p.m. para obtener el suero. El suero sanguíneo contiene en solución las inmunoglobulinas que son de nuestro interés.
Obtención de piel de ratón, del extracto antigénico y cuantificación de proteínas. Los ratones neonatos de tres días de nacidos, se inmovilizaron a baja temperatura, se obtuvo la piel, esta se congeló con nitrógeno líquido, y en un mortero se maceró para obtener el extracto antigénico adicionándole 1 mL de buffer de lisis el cual está compuesto de: Triton X-100 al 1%, NaCl 140 mM, EDTA 1 mM, Tris- HCl10 mM pH 7.6, y un inhibidor de proteasas 1 mM (PMSF; P-7626, Sigma Chemical Co, St Louis MO, USA). Después, se homogenizo y centrifugó a 14,000 r.p.m./10 min y se rescató el sobrenadante [25]. Del sobrenadante se realizó la cuantificación de proteínas mediante la técnica descrita por Bradford [26]. Posteriormente utilizando 15 mg de proteína, estas se caracterizaron por la técnica de electroforesis en geles de poliacrilamida (PAGE-SDS al 12.5%) para separar por masa molecular a las proteínas [27].
Western blot e inmunodetección: Las proteínas separadas por PAGE-SDS fueron transferidas a papel de nitrocelulosa. Después, para verificar si la transferencia tuvo éxito, la membrana de nitrocelulosa fue teñida con solución de Ponceau, donde se observaron las bandas de proteína de color rojo. La membrana fue marcada en carriles, enumerándolos y cortándolos. Las tiras se destiñeron con agua destilada y fueron colocadas en solución bloqueadora PBS/leche al 3% durante 24 h con la intención de evitar uniones inespecíficas durante la inmunodetección. Para inmunodetectar y visualizar la unión antígeno-anticuerpo, se realizó una primera incubación de cada una de las tiras con el suero de cada paciente con LEG, diluido 1:500 con solución bloqueadora al 3% durante 1 h. Posteriormente se realizaron cinco lavados alternando PBS y PBS-Tween al 3%. Para identificar la unión del anticuerpo al antígeno, se realizó una segunda incubación durante 1 h, esta vez utilizando un anticuerpo anti-IgG humano conjugado a la enzima peroxidasa, que reconoce la región Fc de las inmunoglobulinas provenientes del suero de los pacientes con LEG. Después se lavó diez veces alternando PBS y PBS-Tween al 3%. La unión de este complejo se detectó mediante las técnicas de color utilizando 3,3’ Diaminobencidina o por quimioluminiscencia (ECL plus “Western Blotting Detection Reagents, RPN2106). Posteriormente se visualizó el complejo antígeno-anticuerpo calculando su peso molecular aproximado mediante proteínas de referencia, y se asociaron a proteínas prevalentes en esta patología.
Resultados
Caracterización de sueros de pacientes con LEG por Western blot
En el presente trabajo se realizó la caracterización de 20 sueros de pacientes con LEG, los cuales fueron clasificados de acuerdo a los criterios establecidos por el CAR. Se utilizó como fuente antigénica las células de piel de ratón. De estos sueros, el 45% resultaron positivos y 55% negativos, como se puede observar en la tabla 1.

Tabla 1: Reconocimiento antigénico de sueros de pacientes con LEG obtenidos por la técnica de Western blot e inmunodetección.
Los resultados obtenidos por Western blot, muestran que los anticuerpos presentes en el sueros de los pacientes reconocieron varias proteínas antigénicas de diversos pesos moleculares que van de los 10 a los 94 kDa como se puede observar en la figura 1.
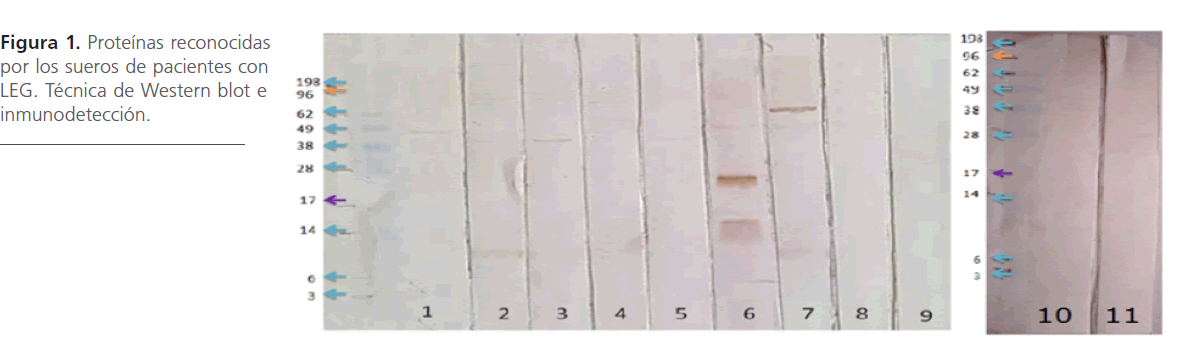
Figura 1: Proteínas reconocidas por los sueros de pacientes con LEG. Técnica de Western blot e inmunodetección.
Identificación y caracterización de antígenos en LEG
En los 9 sueros positivos caracterizados por la técnica de Western blot, se identificaron un total de 25 bandas reactivas en las tiras de nitrocelulosa correspondiente a 13 antígenos diferentes. El reconocimiento antigénico fue de alta y baja especificidad, donde los antígenos van de un peso molecular de 10 a 94 kDa, los cuales, se compararon con los ya reportados en la literatura para ver a cual antígeno pudiese corresponder. Los antígenos detectados por los sueros de pacientes con LEG fueron HSP90, Ku, U1RNP, Ro60, Ro52, fosfolípidos, La48. RNP-h, P-ribosomal, Sm, U2RNP, RNP-ribosomal y HB como se observa en la tabla 2.
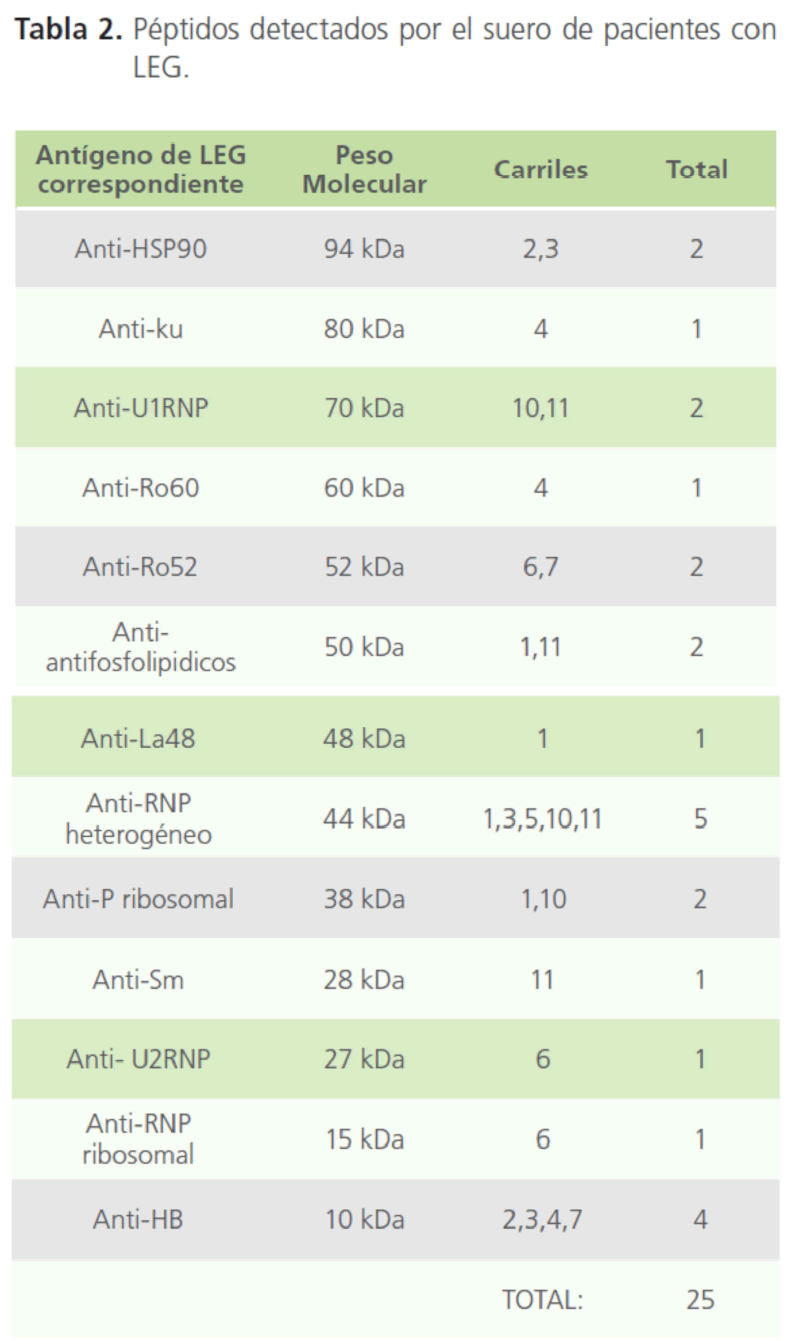
Tabla 2: Péptidos detectados por el suero de pacientes con LEG.
Prevalencia de antígenos reconocidos por el suero de pacientes con LEG
En la detección de antígenos celulares, los sueros reconocieron diferentes bandas con un patrón similar de reconocimiento antigénico, encontrando péptidos más prevalentes que otros como RNP-heterogéneo, HB, HSP90, U1RNP, Ro52, fosfolípidos y p-ribosomal, esto se observa en la gráfica 1.
Porcentaje de expresión de antígenos en LEG
El porcentaje de reconocimiento antigénico obtenido por Western blot mostró la siguiente proporción: el antígeno RNP-heterogéneo con 20%, HB con 16%, Ro52 con 8%, P-ribosomal con 8%, HSP90 con 8%, U1 RNP con 8%, fosfolípidos con 8% y con menor porcentaje pero más específico Ku, Ro60, La48, Sm, U2 RNP, RNP-ribosomal con un 4%, como se observa en la gráfica 2.
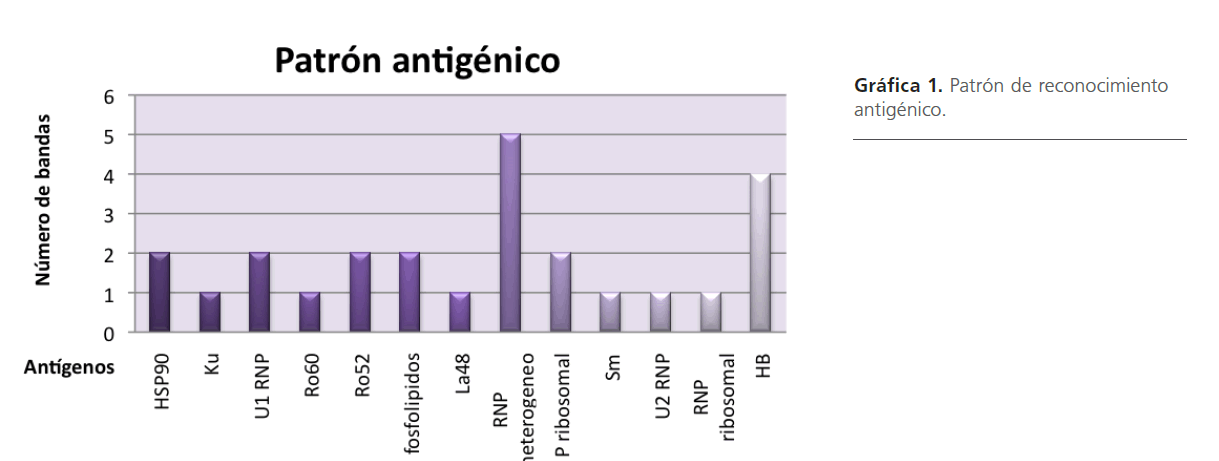
Gráfica 1: Patrón de reconocimiento antigénico.
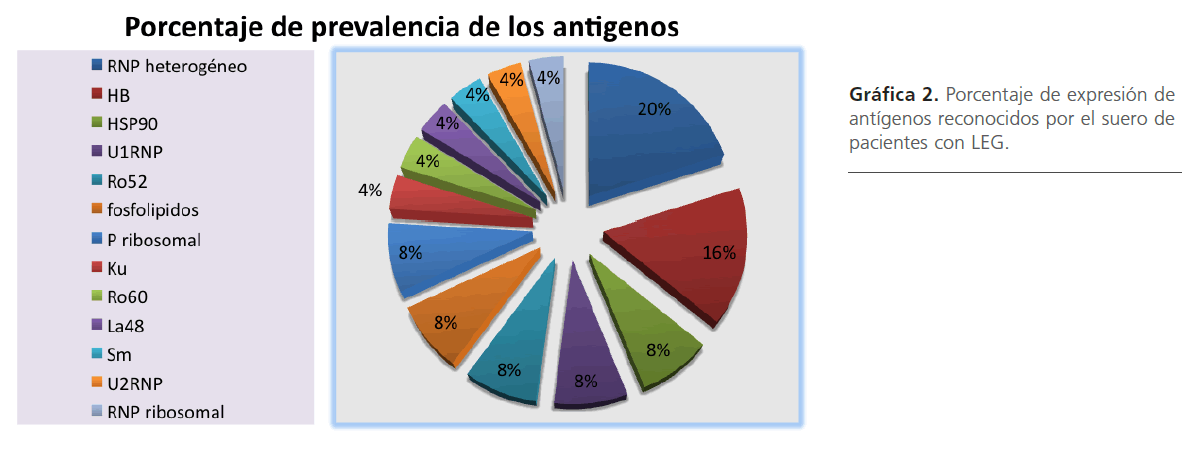
Gráfica 2: Porcentaje de expresión de antígenos reconocidos por el suero de pacientes con LEG.
Discusión
En este trabajo se caracterizó un número importante de antígenos celulares reconocidos por auto-anticuerpos provenientes del suero de pacientes con LEG de población del estado del estado de Zacatecas, México, utilizando como sustrato antigénico las células de piel de ratón.
Como resultado se obtuvo la detección de las proteínas antigénicas RNP-heterogéneo, HB, Ro52, P-ribosomal, HSP90, fosfolípidos, U1RNP, Ku, Ro60, La48, Sm, U2RNP, y RNP-ribosomal. Los antígenos más reconocidos por los anticuerpos en nuestro trabajo fueron las denominadas ribonucleoproteínas, que son proteínas nucleares pequeñas ricas en uridina (U), RNPsn U1, U2, U4, U5 y U6, que forman parte del antígeno Sm y están involucrados en el proceso de corte y empalme del ARN mensajero nuclear, formando parte del spliceosoma, el RNP-heterogéneo o pre-mensajero (ribonucleoproteína heterogénea nuclear), son diana de la respuesta de auto-anticuerpos en LEG y en AR [16]. En nuestro trabajo se reconocieron antígenos como la proteína RNP-heterogéneo de 44 kDa colocándose como la más prevalente de las caracterizaciones con un 20%, U1RNP de 70 kDa con 8%, U2RNP 27 kDa con 4%, Sm con 4%, P-ribosomal 38 kDa y RNP-ribosomal de 10 kDa. Se ha visto que los antígenos U1RNP y Sm se asocia a formas leves de la enfermedad y la aparición de nefritis lúpica [28]. Otros estudios han identificado anticuerpos dirigidos contra los diferentes polipéptidos asociados a RNP/Sm en pacientes con enfermedades inflamatorias del tejido conjuntivo, encontrando para LEG anticuerpos anti-RNP y anti-Sm con altos porcentajes de sensibilidad y especificidad [29].
Los antígenos P-ribosomales tienen alta especificidad para LEG, no se detectan en individuos sanos ni en otras enfermedades reumáticas, y pueden ser los únicos presentes. Su presencia ha sido relacionada con la aparición de manifestaciones psiquiátricas. En nuestro estudio la prevalencia fue de un 8% siendo el tercer lugar más común en los resultados. Un estudio evaluó a los anticuerpos anti-P-ribosomales como marcadores de actividad en LEG, concluyendo que su presencia se relaciona con la enfermedad activa [30].
Al analizar el antígeno Ro52, obtuvimos una prevalencia del 8%, en cuanto a Ro60 y La48 se encontró una prevalencia del 4%. Estos antígenos se relacionan con los síntomas más frecuentes de LEG, como el aumento de apoptosis, autorreactividad y fotosensibilidad, donde la exposición a la luz solar provoca las manifestaciones cutáneas (Ro60 y Ro52), estos últimos están presente con alta frecuencia en un subgrupo clínico de LEG llamado Lupus Cutáneo subagudo, además tiene asociación con exantema fotosensible [31,32,33]. En un estudio con biopsias de piel de pacientes con LEG, se analizaron la expresión de las proteínas Ro52, Ro60, La48 tomando pacientes fotosensibles, no fotosensibles y normales como control, donde se observó una mayor expresión de Ro60 y Ro52 en los pacientes fotosensibles, observando la estrecha relación de Ro con el desarrollo de fotosensibilidad en pacientes con LEG [34].
Otra proteína detectada en este estudio es la HB. La autorreactividad de la hemboglobina (HB) se demostró en pacientes con LEG, se presenta también en enfermedades infecciosas y autoinmunes, y se caracterizan por la inflamación, aumentando la producción de citocinas pro-inflamatorias y daño a órganos, teniendo un vínculo positivo con las respuestas anti-Sm [35]. En nuestro análisis tuvimos una incidencia muy elevada de anti-HB con un 16% colocándose en el segundo lugar en la concurrencia del antígeno.
Los anticuerpos anti-HSP90 (proteínas de choque térmico), se encuentran con títulos elevados en pacientes con Lupus Eritematoso Generalizado, son los más propensos a tener afecciones renales y un nivel de C3 bajo. En nuestro estudio la prevalencia de anticuerppos anti-HSP90 fue de un 8%, tomando el tercer lugar en incidencia antigénica. Un estudio ha mostrado que en la inmunopatogénesis de la nefritis lúpica, se encuentra asociada con HSP90 (como un autoantígeno) [36].
Por otra parte, el síndrome anti-fosfolípido es considerado una enfermedad autoinmune caracterizada por la presencia de anticuerpos anticardiolipina y al menos una manifestación clínica como trombosis arterial o venosa o pérdida fetal recurrente. El síndrome se puede presentar sin asociación con otra enfermedad en cuyo caso se denomina síndrome antifosfolípido primario o asociado con enfermedades del tejido conectivo, y recibe el nombre de síndrome anti-fosfolípido secundario, particularmente con Lupus Eritematoso Generalizado [37]. Se encontró en un 8% de prevalencia en nuestro estudio de la proteína antigénica fosfolipidos de 50 kDa.
Así mismo, se encontró a la proteína Ku, con una incidencia del 4%. Un estudio sobre la evaluación de anticuerpos anti-Ku, concluyen que se encuentran en un amplio espectro de enfermedades del tejido conectivo. Las manifestaciones clínicas que se asocian a este antígeno son afectaciones musculares y articulaciones, pero este anti-Ku se detecta con frecuencia en asociaciones con anti-Ro/SSA y otras especificidades antinucleares [38]. Este estudio entre muchos otros nos demuestra cómo tiene baja especificidad en LEG, sin embargo en la literatura es uno de los más recurrentes con un 5% en la patología [16].
Conclusiones
En este trabajo, se observo un reconocimiento antigénico con alta y baja especificidad para LEG. Los antígenos reconocidos por los auto-anticuerpos presentes en el suero de pacientes con LEG fueron RNP-heterogéneo, RNP-ribosomal, P-ribosomal, U1RNP, HSP90, fosfolípidos, HB, Ro52, Ku, Ro60, La48, Sm, U2RNP.
La presencia y caracterización de anticuerpos contra antígenos celulares por medio de la técnica de Western blot, sirve como marcador de diagnóstico en la detección de LEG, ya que muestra el estado patogénico en el que se encuentra la enfermedad. Los resultados negativos (sueros no reactivos), se debieron probablemente a que en estos pacientes la enfermedad se encontraba con baja actividad clínica y recibían tratamiento de largo plazo.
Agradecimientos
En el presente estudio agradecemos la colaboración del Dr. Pedro Martínez Tejada por la aportación de un número importante de sueros de pacientes con LEG.
697
References
- Marenco JL, Fernandez-Nebro A. Experiencia con rituximab en el tratamiento de pacientes con lupus. Reumatol Clin.2010;6(S2):28–33
- Allam R, Sayyed SG, Kulkarni OP, Lichtnekert J, Anders HJ. Mdm2 Promotes Systemic Lupus Erythematosus and Lupus Nephritis. Departament of Nephrology, Medizinsche Poliklinik, Klinikum der Universät München-Innenstandt, Munich, Germany. 2011
- Ramirez G, Gamarra G, Badillo AR, Daza BN, Uribe BI. Guías de práctica clínica basadas en la evidencia, Lupus Eritematoso Sistémico. Seguro social 2011:11-50.
- Abud-Mendoza C, Moreno-Valdés R, Cuevas-Orta E, Borjas A, Aranda F, Irazoque F, et al. Treating severe systemic lupus eruthematosus with rituximab. An open study. Reumatol Clin. 2009;5(4):147-152.
- Calderón SRE, Ramos SMA, Mejia HY, Aranda BLE, Sauza del Pozo MJ, Becerra MAM. Tratamiento con rituximab para la trombocitopenia secundaria a Lupus Eritematoso Sistémico. Reumatol Clin. 20010;6(2):82-85.
- Calvo AJ, Mata C, Aurrecoechea E. Utilización de terapias hiperestrogénicas en el Lupus Eritematoso Sistémico. Reumatol Clin. 2010;6(5):264–267.
- Mahler M, Fritzler MJ. Epitope specificity and significance in systemic autoimmune diseases. Ann. N.Y. Acad Sci. 2010;1183:267–287.
- Silva CE. Inmunopatogenia del Lupus Eritematoso Sistémico, parte II: Rol de los Componentes del Sistema Inmune y de los Autoanticuerpos. Rev. Chil. Reumatol. 2009;25(4):140-147.
- Romero ATB, García MGE. Citocinas y Lupus Eritematoso Sistémico. Gac Méd Caracas. 2009;117(3):196-211.
- Alarcon SG. Multiethnic lupus cohorts: What have they taught us?. Reumatol Clin. 2011;7(1):3–6.
- Estévez del Toro M, Chico CA, Echevarría R, Jiménez PR, Kokuina E. Daño en pacientes cubanos con Lupus Eritematoso Sistémico. Relación con características de la enfermedad. Reumatol Clin. 2010;6(1):11-15.
- Tsokos GC. Systemic Lupus Erythematosus. N Engl J Med. 2011;365:2110-2121.
- Vargas MJ, Moreira VC, Núñez DK, Núñez DM. Causas de muerte en pacientes con Lupus Eritematoso Sistémico (les) en el hospital méxico de 1989 a 2004. Revista Médica de Costa Rica y Centro América. 2010;594:337-343.
- Andrade-Ortega L. Eficacia de rituximab comparado con ciclofosfamida en pacientes con manifestaciones graves de Lupus Eritematoso Generalizado. Estudio aleatorizado y multicéntrico. Reumatol Clin.2010;6(5):250–255.
- Soto-Vargas J. Inmunopatogenia de Lupus Eritematoso Sistémico. Rev Med MD 2011;2(3):170-179.
- Gelpí SC. Anticuerpos en las enfermedades autoinmunitarias sistémicas. Especial mención al Lupus Eritematoso Sistémico. Reumatol Clin. 2008;4(1):11-6.
- Guarnizo ZP, Vásquez DGM. Polimorfismo de citoquinas en Lupus Eritematoso Sistémico. Rev. Colomb. Reumatol. 2004;11(3):209-216.
- Úcar AE, Rivera GN. Comorbilidad en Lupus Eritematoso Sistémico. Reumatol Clin. 2008;4:17-21.
- Quintana LG, Fernández AA, Félix RJ, Rojas A, Méndez P, Rondón HF, et al. Aplicación clínica de los anticuerpos en Lupus Eritematoso Sistémico. Rev. Colomb. Reumatol. 2003;10(1):32-45.
- Sánchez AAI. Lupus eritematoso sistémico. Aspectos clínicos poco frecuentes. Reumatol Clin. 2008;4:28-30.
- Santiago CWG, Morales RLN, Peña RDM, Chacón PNP. Lupus Eritematoso Sistémico Seronegativo. Repertorio de Medicina y Cirugía. 2010;19(1):52-56.
- Cabiedes J, Núñez ACA. Anticuerpos antinucleares. Reumatol Clin. 2010;6(4):224-230.
- Javier-Zepeda CA. Anticuerpos anti-nucleares. Una familia diversa. Rev. Med. Hond. 2002; 70:189-193.
- Martínez-Godoy MP, Oliva-Gutiérrez E, Zapata-Zúñiga M, Sánchez- Rodríguez SH. Lupus Eritematoso Generalizado: Características Generales, inmunopatogenia y Antígenos de relevancia. Archivos de Medicina. 2012;8(1:2):1-7.
- Harlow E, Lane D. Antibodies a laboratory manual. Cold Spring Harbor Laboratory. Cold Spring Harbor, N.Y. 1988.
- Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of proteins utilizing the principle of protein-dye binding. Analitycal 1976;72:248-254.
- Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;227:680-685.
- Ilic T, Curic S, Vodopivec S, Mitic I, Durdevic-Mirkovic T, Sakac V, et al. Anti-U1RNP antibodies and lupus nephritis. Med Pregl. 2000;53(11- 12):589-594.
- López-Longo FJ, Rodríguez-Mahou M, Escalona M, Monteagudo I, Sánchez-Atrio AI, Pérez T, et al. Detection of anti-RNP and anti-Sm antibodies by immunoblotting and contraimmunoelectrophoresis using the same rabbit thymus extract. Rev. Argent. Reumatol. 1994;5(4):114-124.
- Almeida D, Antolín J, Amérigo MJ, Cantabrana A, Roces A, Hayeck M. Anticuerpos anti-ribosomales como marcadores de actividad en el LES. An. Med. Interna (Madrid). 2002;19(2):73-75.
- Manson JJ, Isenberg DA. The pathogenesis of systemic lupus erythematosus. Neth J Med. 2003;61(11):343-346.
- Lin JH, Dutz JP, Sontheimer RD, Werth VP. Pathophysiology of Cutaneous Lupus Erythematosus. Clinic Rev Allerg Immunol. 2007;33:85-106.
- Orteu CH, Sontheimer RD, Dutz JP. The pathophysiology of photosensitivity in Lupus Erythematosus. Photodermatol Photoimmunol Photomed. 2001;17:95-113.
- Ioannides D, Golden BD, Buyon JP, Bystryn JC. Expression of SS-A/ Ro and SS-B/La Antigens in Skin Biopsy Specimens of Patients With Photosensitive Forms of Lupus Erythematosus. Arch Dermatol. 2000;136:340-346.
- Bhatnagar H, Kala S, L Sharma, Jain S, Kim KS, Pal R. Suero y de órganos asociados-anti-hemoglobina autorreactividad humoral: asociación con anti-Sm respuestas y la inflamación. Eur J Immunol. 2011;41(2):537-48.
- Kendrov A, Minkova V, Mihailova D, Giltiay N, Kyurkchiev S, Kehayov I, et al. Lupus-specific kidney deposits of HSP90 are associated with altered IgGidiotypic interactions of anti-HSP90 autoantibodies. Clin Exp Immunol 2002;129:169–176.
- Vallejo FJ, García L, Medina LF, Díaz CJ. Síndrome antifosfolípido secundario a Lupus Eritematoso Sistémico en un hombre. Rev Colomb Reumatol. 2006;13(1):91-95.
- Franceschini F, Cavazzana I, Generali D, Quinzanini M, Viardi L, Ghirardello A, et al. Anti-Ku antibodies in connective tissue diseases: clinical and serological evaluation of 14 patients. J Rheumatol. 2002;29(7):1393-1397.










