Keywords
Apoptosis, dieta, nutriente, quimioprevención.
Introducción
El término apoptosis proviene del término griego que significa “caída de las hojas”[1]. Ésta forma regulada de muerte celular es un proceso complejo que involucra la participación activa de las células afectadas en una cadena de autodestrucción que ocasiona la alteración de la estructura de la membrana, reducción del tamaño celular, disminución del volumen del núcleo, condensación de la cromatina y fragmentación del DNA debido a la activación de las endonucleasas. La apoptosis y su relación con los componentes de la dieta se estableció a partir de la observación de que uno de los constituyentes del té verde, la molécula –galato epigalocatequina [GEGC]- promueve la inducción de apoptosis y secuestro del ciclo celular en muchos tipos de células neoplásicas sin afectar a las células normales en concentraciones fisiológicas [2,3].
Éste tipo de muerte celular está controlado por dos vías (Figura 1): la intrínseca o mediada por mitocondrias y la vía extrínseca o mediada por receptores. La vía intrínseca está regulada por la familia de proteínas leucemia/linfoma 2 de las células B [Bcl 2] que controlan la permeabilidad de la membrana mitocondrial [4].
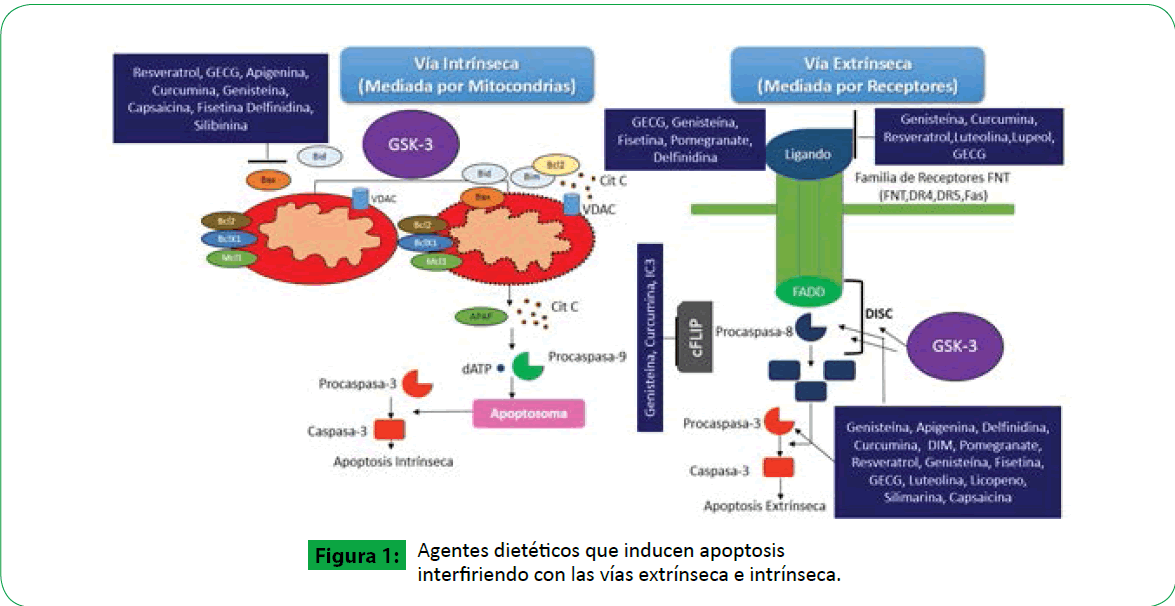
Figura 1: Agentes dietéticos que inducen apoptosis interfiriendo con las vías extrínseca e intrínseca.
Por el contrario, la vía extrínseca inicia con la interacción del ligando con un receptor de muerte que lleva a la activación de la caspasa-8 y la caspasa-3. La caspasa-3 posteriormente se divide en varios sustratos llevando a la apoptosis [3].
En la vía extrínseca, un ligando específico se une al receptor de muerte ubicado en la superficie celular y promueve el reclutamiento de la molécula adaptadora FADD para activar a la caspasa-8 que dispara la activación de las caspasas efectoras corriente abajo como la caspasa 3 propagando así el proceso de apoptosis. La vía intrínseca se caracteriza por la permeabilización de la membrana mitocondrial para liberar proteínas mitocondriales apoptogénicas que translocan a la mitocondria donde inducen la liberación de citocromo c ya sea directamente o a través de complejos con proteínas de membrana.
El citocromo c junto con Apaf-1 y la procaspasa-9 forman el apoptosoma donde se activa la caspasa 9. Las dos vías de la apoptosis confluyen en la caspasa 9 ya que ésta es capaz de activar directa o indirectamente la caspasa 8 que media la activación proteolítica de BID. La GECG, el resveratrol, apigenina, fisetina, pomegranate, delfinidina, lupeol, curcumina, genisteína, luteolina, lupeol e indol-3-carbinol actúan sobre la vía extrínseca mientras que la GECG, resveratrol, apigenina, fisetina, pomegranate, delfinidina, lupeol, curcumina, luteolina, indol-3- carbinol, capsaicina y silibinina actúan sobre la vía intrínseca de la apoptosis.
Compuestos Bioactivos de la Dieta y su interacción con la Apoptosis
Algunos alimentos de origen natural contienen cantidades significativas de fitoquímicos bioactivos que proveen beneficios para la salud además de una nutrición básica al reducir el riesgo de enfermedades crónicas y carcinogénesis [5]. Hasta la fecha se han identificado cuarenta nutrientes de la dieta con efectos preventivos contra el cáncer entre los que se encuentran el té verde, vino tinto, jengibre, soya, coliflor y brócoli [6] (Ver Tabla 1). En general, el potencial antioxidante de los fitoquímicos está bien documentado y se clasifican en: Fenólicos, carotenoides, alcaloides, compuestos organosulfurados y terpenoides [7]. Estos compuestos contribuyen al sabor y color de muchas frutas y vegetales además de ser constituyentes esenciales para el crecimiento normal, desarrollo y defensa de una planta [8].
| Agente |
Fórmula Química |
Fuente |
| Curcumina |
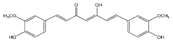 |
Cúrcuma |
| Resveratrol |
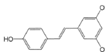 |
Uvas |
| Pterostilbeno |
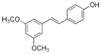 |
Moras Azules |
Galato-3-Epigalocatequina
(GECG) |
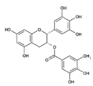 |
Té |
| Acacetina |
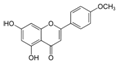 |
Flor de Crisantemo |
| [6]-Gingerol |
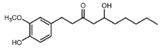 |
Jengibre |
| [6]-Shogaol |
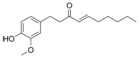 |
Jengibre |
| Luteolina |
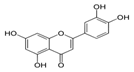 |
Apio |
| Capsaicina |
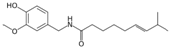 |
Chile |
| Indol-3-Carbinol |
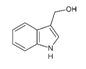 |
Repollo |
| Fenetil Isotiocianato |
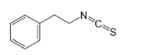 |
Brócoli |
| Sulforafano |
 |
Brócoli |
| Dialil sulfuro |
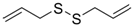 |
Ajo |
| Alicina |
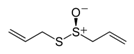 |
Ajo |
| Licopeno |
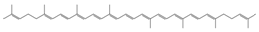 |
Jitomate |
| Ácido Caféico Fenetil Éster |
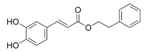 |
Miel |
Tabla 1: Fórmula Química y Fuente Alimenticia de los Principales Componentes de la Dieta con Capacidad Proapoptótica
Mecanismo de Acción de los Nutrientes sobre la Vía Intrínseca de la Apoptosis
Muchos componentes de la dieta inducen apoptosis a través de la vía intrínseca ocasionando la activación de una cascada de señales que promueven la permeabilización de la membrana externa mitocondrial y liberación de factores proapoptóticos incluyendo al citocromo c, endonucleasa G, activador secundario de caspasas derivado de la mitocondria [Smac]/ proteína de unión de la proteína inhibidora directa de la apoptosis [PIA] [DIABLO], proteína A2 que requiere altas temperaturas [HtrA2], y factor inductor de apoptosis [AIF] [9].
La mitocondria es un organelo crucial para la inducción de apoptosis vía fisión y fusión [10] (Ver Tabla 2). Algunas de estas proteínas son conocidas por activar a las caspasas a través de la formación de apoptosomas o por unión a la proteína inhibidora de la apoptosis [PIA]. El licopeno, un carotenoide rico en los jitomates, puede inducir la liberación de Citocromo c de la mitocondria en líneas celulares humanas de cáncer de próstata [11]. La capsaicina, un compuesto fenólico del chile induce un aumento rápido de las especies reactivas de oxígeno seguida por una disrupción del potencial de membrana mitocondrial en las células transformadas [12]. La luteolina encontrada en el apio, la acacetina que se encuentra en el crisantemo, la 5-hidroxi- 3,6,7,8,39,49-hexametoxiflavona [5-OH-HxMF], la cáscara de los cítricos y la curcumina de la cúrcuma, tienen la capacidad de despolarizar a la mitocondria de las células tumorales humanas e inducir la liberación de citocromo c, activar caspasas e inducir apoptosis [13-17]. Por el contrario, las células normales son resistentes a la inducción de apoptosis por el 5-OH-HxMF [18]. Debido a que la mayoría de las células tumorales crecen relativamente rápido, los agentes inductores de apoptosis más efectivos son aquellos que interrumpen las señales celulares mitogénicas. Estos hallazgos sugieren que los fitoquímicos de la dieta inducen apoptosis dentro de una ventana limitada de dosis por la generación de especies reactivas de oxígeno y bloqueo de la transducción de señales en células tumorales pero no en células de cultivos primarios.
•
| Sustancia |
|
Mecanismo Propuesto |
| Carotenoides |
Licopeno |
• Subregulación de pAkt y pBad
• Modulación de p53, Bcl-2, Bax y Bim
• Activación de Caspasas
• Liberación de citocromo c |
| Ácidos Fenólicos |
CAPE |
• Subregulación de Ciclina D1, c-myc y b-catenina
• Alteración de las proteínas inhibidoras de apoptosis
• Inducción de p53, Fas, Bax
• Activación de caspasas |
| Flavonoides |
Luteolina |
• Subregulación de ERk y Akt
• Modulación de la vía TNF inducida por NF-jB
• Fragmentación de la familia Bcl-2
• Activación de caspasas
• Inducción de la liberación de citocromo c
• Modulación de la translocación de Bax/Bak en la mitocondria
• Activación de JNK |
| |
Genisteína |
• Sensibiliza a la apoptosis inducida por TRAIL
• Promueve la interacción del estrés del retículo endoplásmico y alteración del daño a las mitocondrias
• Inhibe a NF-jB
• Activa a Akt y a la caspasa-3
• Subregula Bcl-2
• Media la interacción con la caspasa-7 y la cascada ASK1-p38
• Aumenta la liberación de Ca2+ del retículo endoplásmico
• Activa la calpaina y caspasa-12 |
| |
Silibinina |
• Inhibe la activación constitutiva de Stat3
• Activa la vía p53-caspasa 2
• Subregula a la survivina, Akt y NF-jB
• Modula a la familia de proteínas Bcl-2 y la cascada CDKI-CDK |
| |
Acacetina |
• Supraregula a Fas y FasL, p53, p21 y Bax
• Aumenta la producción de especies reactivas de oxígeno
• Altera el potencial transmembrana mitocondrial
• Activa a las caspasas |
| |
5-Hydroxy-3,6,7,8,
39,49-hexa-methoxyflavona |
• Aumenta la concentración de Ca2+ intracelular
• Depleción de las reservas de Ca2+ del retículo endoplásmico
• Modulación de la función mitocondrial
• Aumento de la producción de especies reactivas de oxígeno
• Supraregulación de Bax y activación de la cascada de las caspasas |
| |
EGCG |
• Subregula a la survivina y la actividad de las AKT cinasas
• Modula a la familia de proteínas de Bcl-2
• Inhibe a las ERK y la vía PI3K/Akt
• Activa a Fas y la cascada de las caspasas. |
| Estilbenos |
Resveratrol |
• Modula la activación de ERK
• Inhibe la expresión de la proteína pS6 ribosomal
• Activa a p53
• Ocasiona la depleción de Ca2+
• Promueve la apertura del PTM
• Modula a pAkt y la caspasa-9 |
| |
Pterostilbeno |
• Activa a Fas/Fasl, induce GADD153 y la cascada de caspasas.
• Aumenta la expresión de p53 y p21
• Disminuye a las ciclinas y pRb.
• Altera el potencial de membrana mitocondrial. |
| Polifenol o Monofenol |
Curcumina |
• Aumenta la relación Bax/Bcl-2, induce al Citocromo c y la liberación de Smac/DIABLO
• Inhibe la señalización de NF-jB y PI3K/Akt
• Subregula la expresión de EGFR y la actividad de ERK
• Aumenta la producción de especies reactivas de oxígeno y Ca2+ |
| |
[6]-Gingerol |
• Inhibe la expresión de Bcl-2
• Aumenta la expresión de TRAIL inducido por la activación las caspasas 3/7
• Inhibe la activación de TRAIL inducida por NF-jB
• Disminuye la expresión de la ciclina A y CDKs.
|
| |
[6]-Shogaol |
• Aumenta la producción y depleción de los contenidos de GSH intracelular
• Altera al potencial transmembrana mitocondrial
• Regula la activación de p38 MAPK, p-SAPK/JNK y STAT3 |
| |
Capsaicina |
• Altera el influjo de Ca2+ y el potencial transmembrana mitocondrial
• Activa a la caspasa-3 y la vía p38 MAPK
• Modula Bcl-2/Bax |
| Compuestos Órganosulfurados |
Dialilsulfuro |
• Altera el potencial transmembrana mitocondrial
• Subregula Bcl-2 y Bcl-XL
• Activa a p38 y ERK
• Disminuye el GSH intracelular |
| |
Alicina |
• Induce la liberación de AIF de la mitocondria
• Activa la cascada de caspasas |
| Isotiocianatos |
Sulforafano |
• Sensibiliza a la apoptosis mediada por TNF
• Subregula a ERK y Akt
• Disminuye a la familia de proteínas inhibidoras de la apoptosis
• Aumenta la expresión de Apaf-1
• Inhibe la traslocación NF-jB
• Activa a la calpaina y la caspasa-12 |
| |
PEITC |
• Induce la liberación de citocromo c y Smac/DIABLO
• Aumenta la producción de especies reactivas de oxígeno
• Altera el potencial de membrana mitocondrial
• Inhibe a ERK, Akt, c-mic
• Aumenta la actividad transcripcional de AP-1 |
Tabla 2: Nutrientes de la Dieta conocidos por su Acción en la Inducción de Apoptosis y sus Mecanismos de Acción Propuestos.
El pterostilbeno que se encuentra en las moras azules tiene la capacidad de inducir apoptosis por pérdida del potencial de membrana mitocondrial, liberación del citocromo c y activación de la caspasa-3 y factor de fragmentación del DNA [DFF-45] así como fragmentación de la poli [ADP-ribosa] polimerasa en células humanas de cáncer gástrico [19]. La genisteína encontrada en los granos de la soya, induce cambios en el potencial de membrana mitocondrial así como estrés oxidativo en el retículo endoplásmico de las líneas celulares humanas de hepatocarcinoma [20]. La galato epigalocatequina despolariza a la mitocondria y actúa contra la vía de señalización de transducción en las células tumorales humanas [21,22]. Los gingeroles y shogaoles que son constituyentes del jengibre, inducen alteración del potencial transmembrana de la mitocondria además de liberación del citocromo c en líneas celulares humanas de hepatoma y leucemia [23,24]. El dialil sulfuro que se encuentra en el ajo, induce apoptosis por generación de especies reactivas de oxígeno regulada por el complejo Bax/Bak pero independiente de Bcl-2 o Bcl-KL [25]. El fenetil isotiocianato [PEITC] es un isotiocianato de los vegetales crucíferos que induce muerte celular en las líneas celulares PC-3 por medio de disrupción del potencial de membrana mitocondrial y liberación de moléculas apoptogénicas [Citocromo c y Smac/DIABLO] de la mitocondria al citosol [26].
Mecanismo de Acción de los Nutrientes en la Vía Extrínseca de la Apoptosis
Los receptores de muerte se activan por ligandos extracelulares como el ligando Fas (FasL, también llamado CD95/Apo1L], factor de necrosis tumoral-alfa [TNF-a], y ligando inductor de factor de necrosis tumoral relacionado con la apoptosis [TRAIL]. Sus receptores cognados pertenecen a la superfamilia de receptores del factor de necrosis tumoral [TNF]. La acacetina [5,7.dihidroxi- 49-metoxiflavona] está presente en el cártamo, plantas, flores y Cirsium rhinoceros [planta koreana]. El nakai, que es el nombre común del árbol Kalopanax septemglobus tiene propiedades antiperoxidativas, antiinflamatorias y antiproliferativas por medio de la inducción de apoptosis y bloqueo de la progresión del ciclo celular [27]. La acacetina causa supraregulación significativa de Fas y FasL [28]. El pterostilbeno [trans-3,5- dimetoxi-49-hidroxiestilbeno] que es un dimetil éter análogo del resveratrol y que se aisla de las bayas Vaccinium tiene actividad quimiopreventiva contra el cáncer [29], además de que induce apoptosis a través de la cascada de caspasas, vía mitocondrial y vía de Fas/FasL por expresión de proteínas de daño al DNA y secuestro de ciclo celular en líneas celulares de cáncer gástrico. El resveratrol que se encuentra en grandes cantidades en las uvas rojas, ha mostrado activar la apoptosis dependiente de la señalización de CD95 en células tumorales humanas [29].
El ácido caféico fenetil éster [ACFE] induce apoptosis a través de la activación de Fas con inducción de p53, Bax, activación de caspasas y subregulación de la ciclina D1, c-myc y b-catenina en células tumorales humanas [30-32]. El tratamiento de las células A549 resistentes a TRAIL con una concentración subtóxica de sulforafano sensibiliza a estas células a la apoptosis mediada por TRAIL [33]. La luteolina que es un flavonoide comúnmente encontrado en algunas plantas medicinales sensibiliza a las células de cáncer pulmonar a la apoptosis mediada por factor de necrosis tumoral a través de la supresión de factor nuclear jB [NF-jB] vía acumulación de especies reactivas de oxígeno y potenciación de JNK [cinasas terminales c-Jun NH2] para aumentar la apoptosis inducida por el factor de necrosis tumoral (Ver Tabla 2) [34].
Mecanismo de Acción de los Nutrientes de la Dieta en la Señalización Celular de la Apoptosis.
La cascada de señalización de las MAP cinasas [proteína cinasas activadas por mitógeno] incluye a las proteína cinasas reguladas por señales extracelulares [ERKs], proteína cinasas activadas por JNKs/estrés oxidativo y las cinasas p38, y están involucradas en la apoptosis inducida poR estímulos como el estrés genotóxico y Fas [Apo-1/CD95] [35]. La translocación de las MAP cinasas al núcleo ocasiona la fosforilación de numerosos sustratos, incluyendo los factores de transcripción AP-1, ATF-2 y NF-jB. Las proteína cinasas reguladas por señales extracelulares [ERKs] transmiten señales iniciadas por promotores del crecimiento incluyendo al factor de crecimiento endovascular [EGF]. En contraste, la vía de la fosfatidilinositol 3-cinasa [PI3K]-AKT ha mostrado inhibir la apoptosis en la mayoría de las líneas celulares [55]. Muchos compuestos bioactivos de la dieta inducen apoptosis ocasionando interrupción de la señalización celular. La capsaicina aumenta significativamente a la MAPK p38 y al JNK1 [36,37]. La luteolina, silibinina, el GEGC, resveratrol, curcumina, sulforafano y el PEITC inducen apoptosis a través de la modulación de las vías del PI3KAKT y ERK [38-44].
Conclusión
Los compuestos quimiopreventivos de la dieta ofrecen un gran potencial contra el cáncer inhibiendo el proceso de carcinogénesis por medio de la regulación de la defensiva celular y la maquinaria de muerte celular. Un aspecto de vital importancia es si la conversión de una célula normal a célula neoplásica puede disminuir con la ingestión de dosis terapéuticas de estos agentes de la dieta. La apoptosis es un proceso complejo que comprende la vía extrínseca e intrínseca con numerosos blancos específicos. Cada vez existe más evidencia de que la apoptosis es blanco molecular de los componentes de la dieta en la quimioprevención del cáncer.
El entendimiento de los eventos críticos asociados con la carcinogénesis provee la oportunidad de prevenir el cáncer a través de la inducción de apoptosis en células tumorales preservando a las células normales. Estos agentes quimiopreventivos cuando se administran con radioterapia o quimioterapia pueden mejorar la eficacia de estos tratamientos aumentando la respuesta tumoral, disminuyendo la toxicidad y sensibilizando a las células tumorales a la quimioradioterapia concomitante.
La evidencia apoya la noción de que la combinación de estos nutrientes es más efectiva que el tratamiento con uno solo, sin embargo, falta más información que ayude a esclarecer los mecanismos moleculares subyacentes entre los componentes naturales de la dieta y la muerte celular. Un mejor entendimiento en esta área permitirá la quimioprevención no solo del cáncer, sino de enfermedades cardiovasculares, neurológicas, autoinmunes e inflamatorias.
Conflictos de interés
Los autores declaran no tener conflictos de interés con la publicación de este artículo.
3776
References
- Holdenrieder S, Stieber P (2004). Apoptotic markers in cancer. Clin Biochem. 37:605–617.
- Ahmad N, Feyes DK, Nieminen AL, Agarwal R, Mukhtar H. Green tea constituent epigallocatechin-3- gallate and induction of apoptosis and cell cycle arrest in human carcinoma cells. J Natl Cancer Inst 1997; 89: 1881–1886.
- Khan N, Afaq F, Mukhtar H. Apoptosis by dietary factors: the suicide solution for delaying cáncer growth. Carcinogenesis 2007; 28 :233–239.
- Green DR, Kroemer G. The pathophysiology of mitochondrial cell death. Science 2004; 305: 626–629.
- Surh, Y. J., Cancer chemoprevention with dietary phytochemicals. Nat. Rev. Cancer 2003, 3, 768–780.
- Liu, R. H., Potential synergy of phytochemicals in cancer prevention: Mechanism of action. J. Nutr. 2004, 134, 3479S–3485S.
- Ho, C. T., Lee, C. Y., Huang, M. T. (Ed.), Phenolic Compounds in Food and Their Effects on Health I. Analysis, Occurrence & Chemistry, ACS Symposium Series 506, American Chemical Society,Washington, DC 1992.
- Sun, S. Y., Hail, N., Jr., Lotan, R., Apoptosis as a novel target for cancer chemoprevention. J. Natl. Cancer Inst. 2004, 96, 662–672.
- Zamzami, N., Kroemer, G., The mitochondrion in apoptosis: How Pandora's box opens. Nat. Rev. Mol. Cell. Biol. 2001, 2, 67–71.
- Hantz, H. L., Young, L. F., Martin, K. R., Physiologically attainable concentrations of lycopene induce mitocondrial apoptosis in LNCaP human prostate cancer cells. Exp. Biol. Med. (Maywood) 2005, 230, 171–179.
- Macho, A., Calzado, M. A., Munoz-Blanco, J., Gomez-Diaz, C., et al., Selective induction of apoptosis by capsaicin in transformed cells: The role of reactive oxygen species and calcium. Cell Death. Differ. 1999, 6, 155 –165.
- Cheng, A. C., Huang, T. C., Lai, C. S., Pan, M. H., Induction of apoptosis by luteolin through cleavage of Bcl-2 family in human leukemia HL-60 cells. Eur. J. Pharmacol. 2005, 509, 1–10.
- Pan, M. H., Lai, C. S., Hsu, P. C., Wang, Y. J., Acacetin induces apoptosis in human gastric carcinoma cells accompanied by activation of caspase cascades and production of reactive oxygen species. J. Agric. Food Chem. 2005, 53, 620–630.
- Pan, M. H., Lai, Y. S., Lai, C. S., Wang, Y. J., et al., 5- Hydroxy-3, 6, 7, 8, 39, 49-hexamethoxyflavone induces apoptosis through reactive oxygen species production, growth arrest and DNA damage-inducible gene 153 expression, and caspase activation in human leukemia cells. J. Agric. Food Chem. 2007, 55, 5081–5091.
- Pan, M. H., Chang, W. L., Lin-Shiau, S. Y., Ho, C. T., Lin, J. K., Induction of apoptosis by garcinol and curcumin through Cytochrome c release and activation of caspases in human leukemia HL-60 cells. J. Agric. Food Chem. 2001, 49, 1464 –1474.
- Pan M, Ghai G, Ho C. Food bioactives, apoptosis, and cáncer. Mol. Nutr. Food Res. 2008, 52, 43 – 52.
- Pan, M. H., Lai, Y. S., Lai, C. S., Wang, Y. J., et al., 5-Hydroxy-3, 6, 7, 8, 39, 49-hexamethoxyflavone induces apoptosis through reactive oxygen species production, growth arrest and DNA damage-inducible gene 153 expression, and caspase activation in human leukemia cells. J. Agric. Food Chem. 2007, 55, 5081–5091.
- Pan, M. H., Chang, Y. H., Badmaev, V., Nagabhushanam, K., Ho, C. T., Pterostilbene induces apoptosis and cell cycle arrest in human gastric carcinoma cells. J. Agric. Food Chem. 2007, 55, 7777 –7785.
- Yeh, T. C., Chiang, P. C., Li, T. K., Hsu, J. L., et al., Genistein induces apoptosis in human hepatocellular carcinomas via interaction of endoplasmic reticulum stress and mitocondrial insult. Biochem. Pharmacol. 2007, 73, 782–792.
- Qanungo, S., Das, M., Haldar, S., Basu, A., Epigallocatechin- 3-gallate induces mitochondrial membrane depolarization and caspase-dependent apoptosis in pancreatic cancer cells. Carcinogenesis 2005, 26, 958–967.
- Zhao, Y., Yang, L. F., Ye, M., Gu, H. H., Cao, Y., Induction of apoptosis by epigallocatechin-3-gallate via mitocondrial signal transduction pathway. Prev. Med. 2004, 39, 1172 – 1179.
- Wang, C. C., Chen, L. G., Lee, L. T., Yang, L. L., Effects of 6- gingerol, an antioxidant from ginger, on inducing apoptosis in human leukemic HL-60 cells. In Vivo 2003, 17, 641–645.
- Chen, C. Y., Liu, T. Z., Liu, Y.W., Tseng,W. C., et al., 6-shogaol (alkanone from ginger) induces apoptotic cell death of human hepatoma p53 mutant Mahlavu subline via an oxidative stress-mediated caspase-dependent mechanism. J. Agric. Food Chem. 2007, 55, 948–954.
- Kim, Y. A., Xiao, D., Xiao, H., Powolny, A. A., et al., Mitochondria-mediated apoptosis by diallyl trisulfide in human prostate cancer cells is associated with generation of reactive oxygen species and regulated by Bax/Bak. Mol. Cancer Ther. 2007, 6, 1599–1609.
- Xiao, D., Lew, K. L., Zeng, Y., Xiao, H., Marynowski, S. W.et al., Phenethyl isothiocyanate-induced apoptosis in PC-3 human prostate cancer cells is mediated by reactive oxygen species-dependent disruption of the mitochondrial membrane potential. Carcinogenesis 2006, 27, 2223 –2234.
- Singh, R. P., Agrawal, P., Yim, D., Agarwal, C., Agarwal, R., Acacetin inhibits cell growth and cell cycle progression, and induces apoptosis in human prostate cancer cells: Structureactivity relationship with linarin and linarin acetate. Carcinogenesis 2005, 26, 845 –854.
- Pan, M. H., Lai, C. S., Wang, Y. J., Ho, C. T., Acacetin suppressed LPS-induced up-expression of iNOS and COX-2 in murine macrophages and TPA-induced tumor promotion in mice. Biochem. Pharmacol. 2006, 72, 1293–1303.
- Clement, M. V., Hirpara, J. L., Chawdhury, S. H., Pervaiz, S. Chemopreventive agent resveratrol, a natural product derived from grapes, triggers CD95 signaling-dependent apoptosis in human tumor cells. Blood 1998, 92, 996–1002.
- Watabe, M., Hishikawa, K., Takayanagi, A., Shimizu, N., Nakaki, T., Caffeic acid phenethyl ester induces apoptosis by inhibition of NF-kappaB and activation of Fas in human breast cancer MCF-7 cells. J. Biol. Chem. 2004, 279, 6017 – 6026.
- McEleny, K., Coffey, R., Morrissey, C., Fitzpatrick, J. M., Watson, R. W., Caffeic acid phenethyl ester-induced PC-3 cell apoptosis is caspase-dependent and mediated through the loss of inhibitors of apoptosis proteins. BJU. Int. 2004, 94,402–406.
- Xiang, D., Wang, D., He, Y., Xie, J., et al., Caffeic acid phenethyl ester induces growth arrest and apoptosis of colon cáncer cells via the beta-catenin/T-cell factor signaling. Anticancer Drugs 2006, 17, 753–762.
- Jin, C. Y., Moon, D. O., Lee, J. D., Heo, M. S., et al., Sulforaphane sensitizes tumor necrosis factor-related apoptosisinducing ligand-mediated apoptosis through downregulation of ERK and Akt in lung adenocarcinoma A549 cells. Carcinogenesis 2007, 28, 1058–1066.
- Ju, W., Wang, X., Shi, H., Chen, W., et al., A critical role of luteolin-induced reactive oxygen species in blockage of tumor necrosis factor-activated nuclear factor-kappaB pathway and sensitization of apoptosis in lung cancer cells. Mol. Pharmacol. 2007, 71, 1381–1388.
- Mansouri, A., Ridgway, L. D., Korapati, A. L., Zhang, Q., et al., Sustained activation of JNK/p38 MAPK pathways in response to cisplatin leads to Fas ligand induction and cell death in ovarian carcinoma cells. J. Biol. Chem. 2003, 278, 19245–19256.
- Hu, H., Jiang, C., Li, G., Lu, J., PKB/AKT and ERK regulation of caspase-mediated apoptosis by methylseleninic acid in LNCaP prostate cancer cells. Carcinogenesis 2005, 26,1374–1381.
- Kang, H. J., Soh, Y., Kim, M. S., Lee, E. J., Surh, Y. J., et al., Roles of JNK-1 and p38 in selective induction of apoptosis by capsaicin in ras-transformed human breast epithelial cells. Int. J. Cancer 2003, 103, 475–482.
- Kim, J. H., Lee, E. O., Lee, H. J., Ku, J. S., et al., Caspase activation and extracellular signal-regulated kinase/Akt inhibition were involved in luteolin-induced apoptosis in Lewis lung carcinoma cells. Ann. N. Y. Acad. Sci. 2007, 1095, 598 –611.
- Agarwal, C., Tyagi, A., Kaur, M., Agarwal, R., Silibinin inhibits constitutive activation of Stat3, and causes caspase activation and apoptotic death of human prostate carcinoma DU145 cells. Carcinogenesis 2007, 28, 1463–1470.
- Singh, R. P., Dhanalakshmi, S., Agarwal, C., Agarwal, R., Silibinin strongly inhibits growth and survival of human endotelial cells via cell cycle arrest and downregulation of survivin, Akt and NF-kappaB: Implications for angioprevention and antiangiogenic therapy. Oncogene 2005, 24, 1188 –1202.
- Qin, J., Xie, L. P., Zheng, X. Y.,Wang, Y. B., et al., A component of green tea, (-)-epigallocatechin-3-gallate, promotes apoptosis in T24 human bladder cancer cells via modulation of the PI3K/Akt pathway and Bcl-2 family proteins. Biochem. Biophys. Res. Commun. 2007, 354, 852–857.
- Alkhalaf, M., Resveratrol-induced growth inhibition in MDA-MB-231 breast cancer cells is associated with mitogen-activated protein kinase signaling and protein translation. Eur. J. Cancer Prev. 2007, 16, 334–341.
- Deeb, D., Jiang, H., Gao, X., Al-Holou, S., et al., Curcumin [1,7- bis(4-hydroxy-3-methoxyphenyl)-1-6-heptadine-3,5-dione; C21H20O6] sensitizes human prostate cancer cells to tumor necrosis factor-related apoptosis-inducing ligand/Apo2L-induced apoptosis by suppressing nuclear factor-kappaB via inhibition of the prosurvival Akt signaling pathway. J. Pharmacol. Exp. Ther. 2007, 321, 616–625.
- Satyan, K. S., Swamy, N., Dizon, D. S., Singh, R., et al., Phenethyl isothiocyanate (PEITC) inhibits growth of ovarian cancer cells by inducing apoptosis: Role of caspase and MAPK activation. Gynecol. Oncol. 2006, 103, 261–270.