Keywords
Leishmaniasis; Cutaneous; Treatment; Efficacy; Review
Introducción
La leishmaniasis es una enfermedad producida por un parásito del género leishmania spp. cuya transmisión se da por la picadura de vectores de los géneros Phlebotomus spp. y Lutzomyia spp. Dependiendo de la especie del parásito y de otras características clínicas y epidemiológicas, se pueden presentar varias formas de la enfermedad entre las que se encuentran la leishmaniasis visceral, leishmaniasis mucocutánea y leishmaniasis cutánea [1,2].
La leishmaniasis cutánea es la forma más prevalente de la enfermedad, se genera en las zonas expuestas del cuerpo produciendo lesiones nodulares, que posteriormente se transforman en úlceras; puede generar incapacidad y en un gran porcentaje de los casos dejan una cicatriz marcada con alteración en la pigmentación de la piel [1,2].
La epidemiología de esta enfermedad registra alrededor de un 95% de los casos en países de América, el Mediterráneo, Asia y Medio Oriente; sin embargo, el 70%-75% de la incidencia global estimada de la leishmaniasis cutánea se presenta en Afganistán, Argelia, Colombia, Brasil, Irán, Siria, Etiopía, Sudán del Norte, Costa Rica y Perú [1,3].
Para el tratamiento de la leishmaniasis cutánea, una de las primeras opciones son los antimoniales pentavalentes, generalmente administrados de manera intramuscular e intravenosa, tales como el antimoniato de meglumina y el estibogluconato de sodio; otros medicamentos incluyen anfotericina B, paromomicina, pentamidina, miltefosina y derivados azólicos como el ketoconazol, fluconazol e itraconazol [4,5].
Para los medicamentos de primera línea contra la leishmaniasis cutánea se ha reportado una elevada frecuencia de efectos adversos como nefrotoxicidad, hepatotoxicidad, cefalea, letargo, cardiotoxicidad, entre otras. Por esta y otras razones como el elevado número de pacientes que presentan contraindicación para estos medicamentos, en las últimas décadas se ha incrementado el interés por generar otras opciones terapéuticas, entre las cuales pueden enunciarse diferentes presentaciones de paromomicina, antimoniato de meglumina y estibogluconato de sodio; termoterapia, crioterapia, entre otras. En este orden de ideas, diferentes autores y organismos internacionales recomiendan la búsqueda de nuevas alternativas terapéuticas, enfocándose en tratamientos locales que generen los mismos beneficios con un menor riesgo en los pacientes [4-6].
Estudios previos sobre tratamientos de leishmaniasis cutánea demuestran proporciones de curación hasta del 92% con tratamientos locales, en comparación con el uso de tratamientos sistémicos [7]. Otros estudios demuestran la eficacia del tratamiento intralesional con antimonio de meglumina (glucantime) el cual presenta un elevado porcentaje de curación con una menor toxicidad [8]. Otras investigaciones han mostrado diferentes resultados en la eficacia terapéutica; en este orden de ideas se han reportado eficacias con tratamientos físicos entre el 42% [9] y el 82% [10]; en antibióticos la eficacia ha oscilado entre 38% [11] y 80% [12]; mientras que en tratamientos con antifúngicos se han documentado resultados entre 30% [13] y 89% [14]. Esta información corrobora la amplia gama de resultados relacionados con la proporción de pacientes curados en diferentes regímenes terapéuticos contra la leishmaniasis cutánea.
A pesar de las evidencias expuestas, en la literatura científica no se dispone de una investigación que de manera sistemática y rigurosa haya caracterizado los estudios clínicos relacionados con los tratamientos para la leishmaniasis cutánea; esto ha impedido consolidar hipótesis relacionadas con la eficacia de los principales tratamientos estudiados, no ha permitido conocer los países con mayor producción científica en este tema, las terapias con el mayor número de investigaciones y pacientes incluidos, no se ha sistematizado el grado de variabilidad en la eficacia reportada para cada grupo de tratamiento, entre otras limitaciones que requieren subsanarse con el fin de consolidar hipótesis sobre la eficacia de estas terapias y orientar estudios posteriores; por lo cual resulta necesario desarrollar una revisión sistemática de la literatura científica que permita subsanar esta necesidad de información, a partir de la selección no sesgada de estudios [15].
Vale precisar que en la literatura científica se dispone de revisiones sistemática para tratamientos contra la enfermedad pero focalizadas en ensayos clínicos controlados aleatorizados, los cuales presentan el mayor nivel de evidencia científica, pero no permiten la identificación de opciones terapéuticas que se han probado en otros tipos de estudios clínicos y que resultan importantes para focalizar los recursos de investigaciones posteriores. Además, teniendo en cuenta que el desarrollo actual de guías de práctica clínica exige la sistematización y gradación de toda la evidencia disponible sobre tratamientos, que cada vez se hace más necesario la evaluación de costo-efectividad de tecnologías en salud desde el modelo generalizado que exige la inclusión de todas las alternativas de tratamiento disponibles y que los tomadores de decisiones requieren el panorama completo de opciones terapéuticas para una enfermedad; los antecedentes de investigación en esta área resultan incompletos.
Dado lo anterior, se hizo una investigación con el objetivo de caracterizar los estudios clínicos sobre la eficacia de los tratamientos para la leishmaniasis cutánea entre 1980 y 2015.
Materiales y Métodos
Tipo de Estudio: Revisión sistemática de la literatura.
Pregunta PICO: Población Intervención Comparación Outcome (Desenlace)
Población: Pacientes con diagnóstico parasitológico confirmado de leishmaniasis cutánea.
Intervención: Tratamientos para leishmaniasis cutánea evaluados en estudios clínicos.
Comparación: Los referidos en cada estudio, estos pueden ser placebo, antimonial u otros.
Desenlaces: Curación, entendida como re-epitelización de las lesiones tres meses después de iniciar el tratamiento.
Fases de PRISMA: Preferred Reporting Items for Systematic reviews and Meta-Analyses [16]
Identificación o búsqueda de los estudios: Se realizó una búsqueda de investigaciones en las bases de datos PubMed- Medline, Ovid-Medline, ScienceDirect, Embase, Wiley, Scielo, Lilacs y Web of Science; adicional a ello se buscaron ensayos clínicos en EBM Reviews - Cochrane Central Register of Controlled Trials, Cochrane Database of Systematic Reviews, EBM Reviews - Cochrane Methodology Register, EBM Reviews Full Text - Cochrane DSR, ACP Journal Club y otras fuentes como Springer Link, Jama Network y Oxford Journals.
Se emplearon los términos de búsqueda “Cutaneous leishmaniasis” en combinación con “Treatement”, “Topical treatment”, “Local treatement”, “Local heat” y “Heat therapy” y sus homólogos en español y portugués, en octubre de 2015. Algunas sintaxis utilizadas fueron: i) (Cutaneous leishmaniasis [Title/Abstract]) AND Treatment[Title/Abstract]Filters:Clinical Trial, ii) cutaneous AND ('leishmaniasis'/exp OR leishmaniasis) AND ('topical'/exp OR topical) AND treatment/py, iii) cutaneous AND'leishmaniasis'/synAND'topical'/syn AND treatment AND ([controlled clinical trial]/lim OR [randomized controlled trial]/ lim)/py, iv) TITLE-ABSTR-KEY(Cutaneous leishmaniasis) and TITLEABSTR- KEY(treatment) y v) cutaneous leishmaniasis treatment {Including Related Terms}, cutaneous leishmaniasis treatment. ab,ti.
Tamización o aplicación de los criterios de inclusión: Se incluyeron estudios con los términos de búsqueda en título, resumen o palabras clave, sin límites de tiempo ni idioma y clasificados como experimentales o clínicos en las bases de datos; adicional a esto se revisaron las referencias de los artículos para localizar otros manuscritos. Los artículos que cumplieron con estos criterios fueron exportados a los programas Endnote Web para la eliminación de duplicados.
Posterior a esto se aplicó un criterio adicional, evaluar tratamientos diferentes al estándar o al recomendado en las guías terapéuticas; vale precisar que en esta revisión se incluyeron investigaciones que sólo aplicaron antimoniales siempre y cuando su objetivo fuese comparar vías de aplicación o dosis diferentes a las recomendadas en las guías de tratamiento de la OMS y la OPS.
Elección o aplicación de los criterios de exclusión y evaluación de la calidad de los estudios: con base en el tipo de estudios requeridos para el logro del objetivo de la revisión, se excluyeron revisiones sistemáticas, estudios de casos, investigaciones preclínicas, artículos no disponibles (que la base de datos solo refiere el título y fue imposible su consecución), con datos incompletos como reportar la proporción de eficacia sin hacer explícito el número de pacientes evaluados, ensayos clínicos que solo reportaron la eficacia terapéutica por lesión, con bajo número de pacientes y aquellos que no presentaban el resultado de la monoterapia sino de la combinación de tratamientos.
En algunos estudios con más de dos brazos solo se tomaron los grupos con buen tamaño de muestra (>20 individuos). En un estudio con 9 grupos solo se tomaron tres que tenían monoterapia, es decir, no se realizó extracción de información de los grupos con terapias combinadas.
Extracción de la información: La búsqueda se realizó de manera independiente por dos investigadores, a priori se determinó que las diferencias se resolverían por consenso o remisión a un tercero. Para la extracción de las variables del estudio (año de publicación, lugar del estudio, tiempo de seguimiento, tipo y número de pacientes por tratamiento, especie de Leishmania y eficacia) se diseñó una base de datos en Excel, la cual fue diligenciada de forma independiente por dos investigadores hallándose un índice kappa intraobserador e interobservador de 1,00.
Síntesis cualitativa y cuantitativa: La caracterización de los estudios se realizó con base en las variables de lugar, tiempo y persona. Se estimó la eficacia global de cada tratamiento a partir de la proporción de pacientes curados y su intervalo de confianza del 95% estimado a partir del estadístico P ± Zα/2*√[(P*Q)/n)].
Resultados
En la Tabla 1 se presentan la frecuencia de estudios obtenida con las cinco estrategias de búsqueda en ocho bases de datos; en ésta se presenta el número de artículos identificados sin la aplicación de límites (71.266) y restringiendo a título, resumen, palabras clave y tipo de artículo (34.677) según las opciones de cada fuente.
| PubMed |
Cutaneousleishmaniasis |
| Treatment |
Topicaltreatment |
Local treatment |
Local heat |
Heattherapy |
| Sin límites |
3672 |
251 |
202 |
13 |
53 |
| Título/Resumen |
1319 |
68 |
17 |
5 |
8 |
| OVID |
| Sin límites |
2443 |
7736 |
12114 |
5049 |
7497 |
| Título/Resumen |
22 |
9820 |
10579 |
5708 |
5469 |
| ScienceDirect |
| Sin límites |
5989 |
1252 |
2580 |
1037 |
1179 |
| Título/Resumen |
387 |
42 |
23 |
4 |
4 |
| Embase |
| Sin límites |
2249 |
423 |
167 |
15 |
61 |
| Artículo and Ensayo clínico |
154 |
53 |
13 |
3 |
5 |
| Wiley |
| Sin límites |
4011 |
1282 |
2049 |
809 |
867 |
| Título |
73 |
7 |
1 |
1 |
3 |
| Scielo |
| Sin límites |
141 |
8 |
18 |
1 |
0 |
| Título |
34 |
2 |
0 |
0 |
0 |
| Lilacs |
| Sin límites |
381 |
230 |
181 |
20 |
54 |
| Título |
49 |
73 |
11 |
4 |
8 |
| Web of Science |
| Sin límites |
6559 |
352 |
214 |
28 |
79 |
| Título |
608 |
72 |
14 |
5 |
9 |
| Nota: Los resultados de las búsquedas en las bases de datos de EBM Reviews, ACP Journal Club, Springer Link, Jama Network y Oxford Journals presentaron una frecuencia menor a 100 y correspondieron a duplicados de los resultados en las bases que aparecen en esta tabla. |
Tabla 1 Frecuencia absoluta de artículos hallados en las fases de identificación y tamización.
De los estudios identificados se excluyeron 34.037 que no se clasificaban como experimentales en las bases de datos, posterior a la aplicación de los criterios de inclusión y exclusión se tomaron 115 estudios como base para los resultados (Figura 1).
Figure 1: Flujograma de selección de los manuscritos.
Se halló un número importante de estudios de casos (22 manuscritos con menos de 10 individuos), 7 investigaciones en animales, 4 relacionados con farmacocinética de medicamentos. Vale destacar que en los estudios con bajo número de pacientes se presentaron investigaciones con rifampicina (8 pacientes), pentamidina (13 pacientes y 17 lesiones), imiquimod (12 pacientes), ketokonalzol (10 pacientes), IFNϒ (9 pacientes), fototerapia (11 pacientes), mefloquina (5), anfotericina (13), doxiciclina (14) y azitromicina (12, con 41 al inicio).
Con base en el periodo de estudio se halló una distribución porcentual similar en los últimos quinquenios; tres estudios fueron anteriores a 1990 (1985, 1986 y 1987), entre 1990 y 1994 se publicaron 14 estudios (12,2%). La mayor proporción de estudios se realizó en América (47,8%) y Asia (43,5%), de estos en Irán se desarrollaron 31 estudios (27%), en Brasil 15 (13%) y en Colombia 18 (15,7%). Sólo el 51,3% de los estudios hizo explícito un seguimiento de tres o más meses (Tabla 2), en el tiempo de seguimiento se halló una media de 6,0 meses, en el 50% fue 3,5 o más, el rango osciló entre 1 y 84 meses y el 50% de los valores centrales estuvo entre 2 y 6.58,8% de los estudios fueron experimentales, 5,3% cuasiexperimentales, 14% solo evaluaron un grupo de estudio y en el porcentaje restante no se hace explícita la aleatorización. En relación con la especie, el 33,9% no la presenta de forma explícita, entre los estudios que si lo hacen (n=76) el 56,6% corresponde al subgénero Viannia y el 43,6% subgénero Leishmania (Tabla 2). En el subgénero Leishmania 42,4% (n=14) fueron por L. (L) trópica, 57,6% (n=19) por L. (L) major y un 15,1% (n=5) registró ambas; en el subgénero Viannia, el 79,1% (n=34) fue L. (V) Braziliensis, 44,2% (n=19) L. (V) Guyanensis y ambas se registraron en el 32,6% (n=14).
| |
Frecuencia absoluta # |
Frecuencia relativa % |
| Periodo |
Anterior al 2000 |
30 |
26,1 |
| 2000 – 2004 |
26 |
22,6 |
| 2005 – 2009 |
33 |
28,7 |
| 2010 – 2015 |
26 |
22,6 |
| Continente |
Asia |
50 |
43,5 |
| América |
55 |
47,8 |
| Otro |
10 |
8,7 |
| Procedencia |
Zona endémica |
35 |
36,5 |
| Consulta dermatológica |
17 |
17,7 |
| Consulta Ambulatoria |
15 |
15,6 |
| Universidad |
21 |
21,9 |
| Militares |
8 |
8,3 |
| Seguimiento |
No es explícito |
24 |
21,2 |
| Menos de 45 días |
18 |
15,9 |
| 45 a 90 días |
13 |
11,5 |
| Mayor a 90 días |
58 |
51,3 |
| Aleatorización |
No explicita |
25 |
21,9 |
| Si |
67 |
58,8 |
| No aplica |
16 |
14,0 |
| No |
6 |
5,3 |
| Subgénero |
No reporta |
39 |
33,9 |
| Reporta |
76 |
66,1 |
| Leishmania |
33 |
43,4 |
| Viannia |
43 |
56,6 |
Tabla 2 Caracterización de los estudios.
En los tratamientos evaluados la mayor proporción correspondió a los antimoniales pentavalentes, seguido de paromomicina y termoterapia; al agruparlos se halló una mayor proporción de investigaciones en antibióticos y tratamientos físicos. En los controles los medicamentos más usados fueron los antimoniales seguidos del uso de placebo (Tabla 3). En la categoría de otros se presentó un 2,6% de estudios (n=3) en cada uno de los siguientes medicamentos: itrakonazol, imiquimod, azitromicina, ácido tricloacético, anfotericina, rifampicina y sulfato de zinc. Otros autores evaluaron en uno o máximo dos estudios medicamentos como opio tópico, extractos herbales, inmunoterapia (vacuna nitrógeno), óxido nítrico, artesunato, mefloquina, metrodinazol, fluconazol, dapsona y aminosidina.
| Terapias |
Tratamiento |
Control |
| # |
% |
# |
% |
| Antimonial |
18 |
15,7 |
66 |
57,4 |
| Paromomicina |
13 |
11,3 |
3 |
2,6 |
| Termoterapia |
11 |
9,6 |
-- |
-- |
| Crioterapia |
9 |
7,8 |
-- |
-- |
| Pentamidina |
9 |
7,8 |
2 |
1,7 |
| Alopurinol |
9 |
7,8 |
-- |
-- |
| Miltefosina |
8 |
7,0 |
3 |
2,6 |
| Ketokonazol |
4 |
3,5 |
-- |
-- |
| Otros |
34 |
29,5 |
5 |
4,4 |
| No aplica (sólo evalúa un grupo) |
17 |
14,8 |
| Placebo |
19 |
16,5 |
| Agrupados |
|
|
|
|
| Antimonial |
18 |
15,7 |
66 |
57,4 |
| Antibiótico |
27 |
23,5 |
6 |
5,2 |
| Físico |
20 |
17,4 |
-- |
-- |
| Antiparasitarios |
12 |
10,4 |
2 |
1,7 |
| Antineoplásico |
8 |
7,0 |
3 |
2,6 |
| Antifúngico |
8 |
7,0 |
-- |
-- |
| Otros |
22 |
19,1 |
2 |
1,7 |
Tabla 3 Distribución porcentual de los estudios según tratamientos y controles usados.
En el grupo de tratamiento, las menores eficacias reportadas fueron del 4,2% para una evaluación de opio [17] y del 10% para aminosidina [18] y sulfato de Zinc [19]. El valor máximo de eficacia fue 100% en diferentes aplicaciones de estibogluconato de sodio [20,21]. El 50% de los estudios reportó una eficacia de 74% o más, mientras que el 50% de los valores centrales osciló entre 55% y 85,7%.
En los estudios incluidos se evaluó la eficacia de los diferentes tratamientos en 15.949 pacientes, en la Tabla 4 se presenta la eficacia de los diferentes medicamentos identificados en los grupos de tratamiento y control, en estos se obtuvo en rango de eficacia entre 57,4% (IC 95%=44,9-69,8) en azitromicina y 80,0% (IC 95%=76,8-83,1) en pentamidina. Al agrupar por tipos de tratamiento se halló una eficacia del 76,6% (IC 95%=73,4- 79,9) para los antimoniales, 75,4% (IC 95%=73,2-77,7) para las terapias físicas, 64,9% (IC 95%=62,1-67,8) en antibióticos, 65,3% (IC 95%=60,8-69,8) para antifúngicos y 78,1% (IC 95%=75,0-81,2) para antiparasitarios diferentes a los convencionalmente usado para leishmaniasis (Tabla 4).
| |
Eficacia Tratamientos |
Eficacia Controles |
| |
N |
%(n) |
IC 95% |
N |
%(n) |
IC 95% |
| Miltefosina |
386 |
72,5(280) |
68,0–77,1 |
213 |
75,1(160) |
69,1–81,2 |
| Paromomicina |
672 |
64,6(434) |
60,9-68,3 |
273 |
70,0(191) |
64,3–75,6 |
| Pentamidina |
659 |
80,0(527) |
76,8–83,1 |
361 |
86,4(312) |
82,7–90,1 |
| Crioterapia |
546 |
72,7(397) |
68,9–76,5 |
-- |
-- |
-- |
| Termoterapia |
906 |
77,0(698) |
74,2–79,8 |
-- |
-- |
-- |
| Ketokonazol |
146 |
58,9(86) |
50,6–67,3 |
-- |
-- |
-- |
| Itrakonazol |
218 |
64,7(141) |
58,1–71,2 |
-- |
-- |
-- |
| Imiquimod |
119 |
58,8(70) |
49,6–68,1 |
-- |
-- |
-- |
| Alopurinol |
338 |
60,1(203) |
54,7–65,4 |
-- |
-- |
-- |
| Azitromicina |
68 |
57,4(39) |
44,9–69,8 |
-- |
-- |
-- |
| Ácido tricloacético |
92 |
73,9(68) |
64,4–83,4 |
-- |
-- |
-- |
| Anfotericina |
69 |
76,8(53) |
66,1–87,5 |
-- |
-- |
-- |
| Rifampicina |
92 |
66,3(61) |
56,1–76,5 |
-- |
-- |
-- |
| Sulfato de Zinc |
81 |
58,0(47) |
46,7–69,4 |
61 |
95,1(58) |
86,3–99,0 |
| Otros |
574 |
62,0(356) |
58,0-66,1 |
174 |
44,8(78) |
37,2-52,5 |
| Agrupados |
| Antimonial |
676 |
76,6(518) |
73,4–79,9 |
3227 |
72,9(2353 |
71,4–74,5 |
| Físico |
1452 |
75,4(1095) |
73,2–77,7 |
-- |
-- |
-- |
| Antibiótico |
1104 |
64,9(717) |
62,1–67,8 |
335 |
67,2(225) |
62,0–72,3 |
| Antifúngico |
444 |
65,3(290) |
60,8–69,8 |
-- |
-- |
-- |
| Antiparasitario |
707 |
78,1(552) |
75,0–81,2 |
361 |
86,4(312) |
82,8–90,1 |
| Antineoplásico |
386 |
72,5(280) |
68,0–77,1 |
213 |
75,1(160) |
69,1–81,2 |
| Placebo |
-- |
-- |
-- |
996 |
41,0(408) |
37,9–44,1 |
Tabla 4 Eficacia de los tratamientos usados en el tratamiento de leishmaniasis cutánea.
A partir de la sumatoria de los pacientes que recibieron diversas opciones terapéuticas en el brazo de tratamiento y de control, se halló una eficacia del 82,3% (IC 95%=79,9-84,6) en pentamidina siendo estadísticamente mayor a los demás tratamientos, del 66,1% (IC 95%=63,1-69,2) en paromomicina la cual fue estadísticamente menor, y de 73,5% (IC 95%=69,8-77,1) y 73,6% (IC 95%=72,2-75,0) para miltefosina y antimoniales, respectivamente (Figura 2).
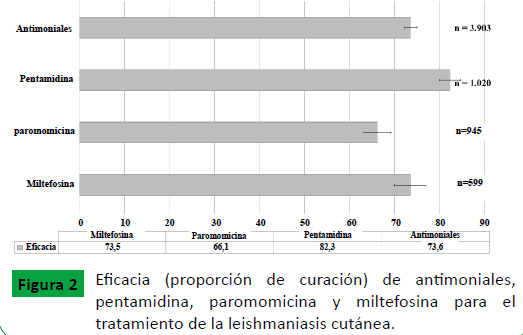
Figure 2: Eficacia (proporción de curación) de antimoniales, pentamidina, paromomicina y miltefosina para el tratamiento de la leishmaniasis cutánea..
Sólo en el 26,1% (n=30) de los estudios se hacen alusión explícita a los análisis de seguridad, aunque estos solo son enunciados de manera secundaria y sin presentar, en la mayoría de estudios, la proporción de pacientes que presentaron efectos adversos.
Discusión
A partir de esta revisión sistemática se identificaron 25 intervenciones diferentes para el tratamiento de leishmaniasis cutánea evaluadas entre los años 1985 y 2014; se describió la eficacia de terapéutica de los principales tratamientos en 15.949 pacientes, en su mayoría de Irán, Brasil y Colombia. En general, los datos de eficacia terapéutica fueron satisfactorios para las terapias físicas, antibióticos, anti fúngicos y antiparasitarios diferentes a los convencionalmente usados para leishmaniasis, con una proporción de pacientes curados entre 65% y 82%. Por medicamentos específicos se halló una mayor eficacia en pentamidina, seguido de miltefosina y antimoniales, los dos últimos con una proporción de curación estadísticamente igual. Esta información evidencia el elevado interés en la investigación de medicamentos contra la enfermedad y la elevada validez externa de esta revisión al incluir un alto número de pacientes, de opciones terapéuticas, de especies infectantes y de sitios endémicos del mundo.
La leishmaniasis es un problema en salud pública por la alta morbilidad que genera en países de América central, América del sur, entre otros. Dicha enfermedad se encuentra distribuida en todos los continentes y es endémica en 98 países [22]. Su incidencia y prevalencia no es muy clara, debido a que en solo 52 de los países endémicos existe una notificación obligatoria de ésta, entre ellos los tres países en los que se presentó la mayor proporción de ensayos clínicos de esta revisión, es decir, Irán, Brasil y Colombia; los cuales presentan una elevada circulación del vector y están incluidos entre los países que informan el 90% de los casos de leishmaniasis cutánea [3,23].
Desde la perspectiva parasitológica, es pertinente precisar que en el 33,9% de los estudios no se hizo explícita la especie causante, lo cual es de gran relevancia para conocer patrones clínicos asociados con algunas de ellas y elegir algunos esquemas terapéuticos, dado el reporte de resistencia a medicamentos en algunas especies. Además es claro que las diferencias bioquímicas y moleculares de cada especie proporcionan un dato importante para la elección del tratamiento por la potencial resistencia de algunas especies, por lo que debe mejorarse el reporte de esta variable en todos los ensayos clínicos posteriores [24].
Asimismo, es importante resaltar que las leishmaniasis son enfermedades complejas en la que están implicadas alrededor de 20 especies de protozoos de las cuales algunas están más asociadas a leishmaniasis cutánea como L. major y L. tropica en el Viejo Mundo, L. mexicana y L. braziliensis en el Nuevo Mundo. Del mismo modo L. infantum y L. donovani también están relacionadas con leishmaniasis cutánea en países como Etiopía y Kenia [25], lo que concuerda con las especies identificadas en esta revisión.
Por otra parte, existen varios factores importantes en la elección del tratamiento para la leismaniasis, entre los cuales están el lugar geográfico donde se encuentra el paciente, la especie de parásito implicado, la localización de las lesiones, la presencia de eventos adversos del medicamento, entre otros; es así como en la leishmaniasis cutánea se han utilizado diferentes tipos de tratamientos como se indica en las líneas siguientes [26].
En primera instancia están los antimoniales pentavalentes los cuales son los más usados para el tratamiento de los diferentes tipos de leishmaniasis, su composición es un metal pesado llamado antimonio, el cual puede afectar la acción de la topoisomerasa I y la Tirosín fosfatasa, interrumpiendo la replicación del parásito [27]. El uso de este compuesto puede presentar una eficacia cercana al 80% [28] aunque también se han documentado proporciones de curación tan bajas como del 35% [29]; de forma global en esta revisión fue del 73,6% a partir de la evaluación de 3.903 pacientes, aunque se debe aclarar que aproximadamente un 25% de los pacientes deben interrumpir el esquema debido a los diferentes efectos adversos como fiebre, fatiga, cefalea, artralgias, dolor abdominal, pancreatitis, entre otros [26].
Por lo anterior se han desarrollado estudios en los cuales se ha demostrado que la aplicación intralesional de este medicamento presenta una mejor proporción de curación y menor toxicidad, aunque no existen guías que hagan explícita la cantidad del compuesto que debe ser usado. También es importante destacar que el tratamiento intralesional puede presentar mayor eficacia al combinarlo con otros tratamientos como la crioterapia [8,26]. A pesar de lo anterior, la presencia de efectos adversos, así como las recaídas atribuibles a la resistencia del parásito contra los antimoniales, ha derivado en la necesidad de investigar otras opciones terapéuticas [27].
Se ha recomendado el uso de miltefosina el cual es un compuesto fosfolipídico que tiene como mecanismo de acción inhibir la biosíntesis de los esteroles y fosfolípidos del parásito, afectando la permeabilidad de la membrana. El tratamiento con miltefosina es administrado por vía oral, usando un esquema con una dosis de entre 133 y 150 mg/día por 28 días [5,30]. Según los diferentes estudios, la proporción de curación con este tratamiento va desde 66% [30] hasta un 93% [31] con una eficacia global en esta revisión del 73,5% en 599 pacientes. Dado que no es un medicamento inyectable, no genera dolor en los pacientes, pero por la duración del tratamiento completo, puede presentar una mayor proporción de abandono de la terapia, disminuyendo su eficacia [5]. Generalmente es bien tolerada, pero puede llegar a causar cefalea, náuseas, vómito o diarrea [26]. Posee gran eficacia en el tratamiento de L. panamensis [4], pero no está indicado para el tratamiento de leishmanasis causada por L. mexicana debido a que esta ha generado resistencia a este medicamento [25]. Además, de su potencial teratogénico [5].
Por su parte, el isotionato de pentamidina es usado como tratamiento alternativo con tasas de curación entre 35% [29] y 96% [32] siguiendo el esquema de tratamiento recomendado de 4 mg/Kg/día cuatro dosis, una cada tercer día, requiriéndose entre 7 y 15 dosis [5], para los estudios sistematizados en esta revisión se encontró una eficacia del 82,3% en 1.020 pacientes. Presenta una mayor seguridad debido a su bajo número de efectos adversos, los cuales incluyen dolor en sitio de administración, cefalea, fiebre [5], pero puede presentar una mayor proporción de abandonos al ser un esquema de tratamiento largo, además su valor comercial es mayor que el de los compuestos antimoniales por lo que se convierte en una clara desventaja, máxime al tener presente que esta enfermedad presenta una mayor ocurrencia en países de bajo ingresos [5].
Adicional a lo anterior están los antibióticos, de los cuales es más usado es la anfotericina B (liposomal), se ha utilizado para el tratamiento de L. braziliensis, con un esquema terapéutico que generalmente se realiza por 30-45 días con una dosis de 0,5 a 1 mg/ Kg/día. Se ha reportado una tasa de curación hasta un 85% [33] y en esta revisión fue del 76,8%, aunque en un bajo número de pacientes (n=69). Este medicamento puede presentar efectos adversos tales como fiebre y escalofríos en el lugar de infusión del medicamento, dolor de espalda y nefrotoxicidad [4]. La principal desventaja de este tratamiento es el costo, debido a que puede ser hasta el doble con respecto al de los compuestos antimoniales.
Otro antibiótico usado es la paramomicina, de uso generalmente tópico, este ha mostrado una mejor respuesta terapéutica que la forma intramuscular [34], la toxicidad es rara, pero cuando se usa en modo intramuscular, puede llevar a hepatotoxicidad con elevación de las enzimas hepáticas [35]. Se ha encontrado una eficacia de este medicamento desde un 17% [36] hasta un 86% [37] con un resultado global en esta revisión del 66,1% en 945 pacientes.
Otro grupo importante incluye los imidazoles los cuales se pueden administrar de manera oral, parenteral o tópica. El esquema de tratamiento dura generalmente 28 días. Entre sus mecanismos de acción está el inhibir la citocromo p450, afectando la formación de esteroles de la membrana celular y con ello su permeabilidad, de ahí la toxicidad que generan estos medicamentos ya que al no ser selectivos, interfieren, por ejemplo, en la formación de enzimas hepáticas, produciendo hepatitis [38]. De este tipo de medicamentos se ha reportado tasas de curación bajas como del 15,7% con ketoconazol [39] y hasta un 89% de eficacia con este mismo medicamento [14], la proporción de curación hallada en esta sistematización fue del 65,3% en 444 pacientes. En un metánalisis basado en 25 estudios con 799 pacientes tratados con diferentes azoles, se reportó una eficacia del 54,8% con ketoconazol, 70,5% en fluconazol y 68,9% para itraconazol; la eficacia del ketoconazol fue similar a a la del glucantime mientras que en itraconazol fue estadísticamente mayor que en los controles basados en placebo [40].
Los tratamientos físicos basados en calor y frío se han evaluado con el fin de disminuir las reacciones adversas de los anteriores tratamientos. Además, cabe resaltar que en los diferentes estudios en los que se usa algún medicamento, el reporte de los efectos adversos es deficiente, contrario a lo que ocurre con estos tratamientos físicos en los cuales se resaltan los pocos efectos tóxicos.
En el caso de la termoterapia, se busca limitar la replicación de los amastigotes del parásito, debido a que son afectados por el calor; las especies más sensibles son L. major, L. tropica y L. mexicana. Este tratamiento tiene diferentes métodos como el uso de compresas calientes, calor con rayos infrarrojos alternados con luz ultravioleta, y aumento de la temperatura de la piel mediante el uso de ultrasonido [41]. Es por esto que se han creado instrumentos controlados para generar calor como es el Thermomed TM, el cual es capaz de generar un calor de hasta 50°C. Es importante aclarar que la termoterapia presenta ventajas sobre los antimonios como el menor número de efectos adversos y contraindicaciones, y su bajo costo; esto lo puede hacer más costo-efectivo en zonas endémica. Este tratamiento se aplica en la lesión por 10 segundos, en 10 días consecutivos, visualizando la efectividad del tratamiento luego de dos meses [42]. En los ensayos clínicos se han reportado proporciones de curación que van de 19% [43] hasta un 98% [44], con un porcentaje global de un 77,0% en 906 pacientes.
La crioterapia usa generalmente nitrógeno líquido sobre la herida. Este tratamiento es usado debido a la termosensibilidad de los parásitos, y al hecho de presentar un mejor proceso de cicatrización de las heridas. El modo de uso es generalmente con un Spray el cual esparce en la lesión el nitrógeno por un tiempo de entre 10 a 15 segundos, asegurando la congelación. Luego se inicia una segunda fase con periodos más largos de aplicación de nitrógeno. El tiempo por el cual se aplica el tratamiento depende del tamaño de la lesión y puede ser de entre una a siete sesiones. Entre los efectos adversos encontrados están quemaduras, cambio de color de piel y dolor por las frecuentes sesiones [45]. La eficacia ha sido hasta del 91,7% [46] con un mínimo de 52,5% [47] y un porcentaje global de 72,7% en 546 pacientes.
Sumado a la eficacia de las monoterapias se debe hacer explícito el reporte de algunos estudios que han indicado cómo la combinación de terapias mejora la eficacia y la seguridad, en este sentido, se ha propuesto el uso de crioterapia con antimonio tópico, a pesar de que ambas usadas como monoterapia son eficaces, en terapia combinada generan una mayor proporción de curación [8]. También se ha visto que la termoterapia es una buena alternativa terapéutica combinada con antimonio, pero su utilización requiere equipos de difícil acceso o que pueden ser costosos. La terapia combinada también está indicada en la infección por L. donovani o L. infantum, pero se ha visto que el tratamiento único con crioterapia trae resultados satisfactorios. Para el tratamiento de L. chagasi y L. mexicana, se ha propuesto este mismo esquema de intervenir la lesión de manera local con antimonio intralesión más crioterapia, siempre y cuando el paciente no tenga riesgo de generar leismaniasis mucocutánea [25].
Para L. braziliensis, el tratamiento tópico no está indicado, debido al riesgo de este parásito de generar leishmaniasis mucocutánea, por esto la terapia de elección es sistémica, mostrando buena respuesta cuando el tratamiento se realiza con antimoniales, aunque con la miltefosina se ha visto una respuesta terapéutica similar a estos. Asimismo, el tratamiento con anfotericina B se usa para el manejo de leishmaniasis mucocutánea causada por L. braziliensis y se ha propuesto para el manejo de la leishmaniasis cutánea generada por esta misma especie [25].
Un punto difícil de resolver en este momento es la respuesta tan variable a los medicamentos por las distintas especies que circulan en los países, sumado a las divergencias en el reporte de efectos adversos, el tiempo de tratamiento y la duración de la respuesta terapéutica. En este sentido, los ensayos clínicos sistematizados resultan limitados dado que el reporte de estos aspectos fue exiguo, aunque algunos autores han documentado que los tratamientos prolongados tienden a presentar tasas de curación bajas [48], mientras que en terapias cortas estas pueden mejorar [30].
Conclusión
En esta revisión se identificaron 25 intervenciones diferentes para el tratamiento de leishmaniasis cutánea, los cuales incluyen terapias físicas, antibióticos, anti fúngicos y antiparasitarios diferentes a los convencionalmente usados para leishmaniasis, evaluadas entre los años 1980 y 2015; se incluyeron 15.949 pacientes en los cuales se halló una mayor eficacia para pentamidina, seguido de miltefosina y antimoniales.
Declaración de conflictos de interés
Ninguno de los autores declara conflicto de interés para la publicación del manuscrito.
Financiamiento
Recursos en especie de la Universidad de Antioquia y Universidad Cooperativa de Colombia
Conflicto de Interés
Los autores declaran no tener conflictos de interés con la publicación de este artículo.
10939
References
- Organización Mundial de la Salud OMS (2015) Leishmaniasis. Ginebra: OMS.
- Ministerio de la Protección Social República de Colombia, Instituto Nacional de Salud, Organización Panamericana de la Salud (2003) Guía Protocolo para la vigilancia en salud pública de leishmaniasis. Bogotá.
- Alvar J, Vélez I, Bern C, Herrero M, Desjeux P, et al. (2012) Leishmaniasis worldwide and global estimates of its incidence. PLoS One 7(5): e35671.
- Organización Mundial de la Salud OMS (2010) Control de las leishmaniasis. Informe de una reunión del Comité de expertos de la OMS sobre el control de la Leishmaniasis. Ginebra: OMS.
- Ministerio de la Protección Social República de Colombia, Instituto Nacional de Salud, Organización Panamericana de la Salud (2010) Guía para la atención clínica integral del paciente con leishmaniasis. Bogotá.
- Blanco V, Cossio A, Martinez J, Gore S (2013) Clinical and epidemiologic profile of cutaneous leishmaniasis in colombian children: considerations for local treatment. Am J Trop Med Hyg 89: 359-364.
- Bailey M (2013) Editorial commentary: local treatments for cutaneous Leishmaniasis. Clin Infect Dis 57:381-383.
- Asilian A, Sadeghinia A, Faghihi G (2004) Comparative study of the efficacy of combined cryotherapy and intralesional meglumine antimoniate (Glucantime) vs. cryotherapy and intralesional meglumine antimoniate (Glucantime) alone for the treatment of cutaneous leishmaniasis. Int J Dermatol 43: 281-283.
- Nilforoushzadeh M, Fatemi F, Sattar N, Haftbaradaran E, Jaffary F, et al. (2012) The effect of intralesional meglumine antimoniate (glucantime) versus a combination of topical trichloroacetic acid 50% and local heat therapy by non-ablative radiofrequency on cutaneous leishmaniasis lesions. J Res Med Sci 1: S97-S102.
- Safi N, Davis G, Nadir M, Hamid H, Robert Jr C (2012) Evaluation of Thermotherapy for the Treatment of Cutaneous Leishmaniasis in Kabul, Afghanistan: A Randomized Controlled Trial. Mil Med 177: 345-351.
- Layegh P, Yazdanpanah M, Vosugh E, Pezeshkpoor F, Shakeri M (2007) Efficacy of azithromycin versus systemic meglumine antimoniate (Glucantime) in the treatment of cutaneous leishmaniasis. Am J Trop Med Hyg 77: 99-101.
- Weinrauch L (1987) Dapsone in the treatment of cutaneous leishmaniasis. Int J Dermato 26: 200.
- Navin T, Arana B, Arana F, Berman J (1992) Placebo-controlled clinical trial of sodium stibogluconate (Pentostam) versus ketoconazole for treating cutaneous leishmaniasis in Guatemala. J Infect Dis 165: 528-534.
- Salmanpour R, Handjani F (2001) Comparative study of the efficacy of oral ketoconazole with intra-lesional meglumine antimoniate (Glucantime) for thetreatment of cutaneous leishmaniasis. J Dermatolog Treat 12: 159-162.
- Green S (2005) Systematic reviews and meta-analyses. Singapore Med J 46: 270-274.
- Welch V, Petticrew M, Tugwell P, Moher D, O’Neill J, et al. (2013) Extensión PRISMA-Equidad 2012: guías para la escritura y la publicación de revisiones sistemáticas enfocadas en la equidad en salud. Rev Panam Salud Publica 34: 60-67.
- Mapar M, Kavoosi H (2001) Assessment of the effect of topical Opium in treatment of cutaneous Leishmaniasis. Iran J Dermatology 4.
- Soto J, Grogl M, Berman JOP (1994) Limited efficacy of injectable aminosidine as single-agent therapy for Colombian cutaneous leishmaniasis. Trans R Soc Trop Med Hyg 88: 695-698.
- Firooz A, Khatami A, Khamesipour A, Nassiri-Kashani M, Behnia F, et al. (2005) Intralesional injection of 2% zinc sulfate solution in the treatment of acute old world cutaneous leishmaniasis: a randomized, double-blind, controlled clinical trial. J Drugs Dermatol 4: 73-79.
- Oster C, Chulay J, Hendricks L, Pamplin C, Ballou W, et al. (1985) American cutaneous leishmaniasis: a comparison of three sodium stibogluconate treatment schedules. Am J Trop Med Hyg 34: 856-860.
- Ballou W, McClain J, Gordon D, Shanks G, Andujar J, et al. (1987) Safety and efficacy of high-dose sodium stibogluconate therapy of American cutaneous leishmaniasis. Lancet 2: 13-16.
- Organización Panamericana de la Salud (2007) Update of American Trypanosomiasis and Leishmaniasis Control and Research: Final Report. Rio de Janeiro, Brazil; 2007. Rio de Janeiro: Organización Panamericana de la Salud.
- Instituto Nacional de Salud (2014) Protocolo de vigilancia en salud pública leishmaniasis. Bogotá.
- Croft S, Sundar S (2006) Drug resistance in leishmaniasis. Clin Microbiol Rev 19: 111-126.
- Hodiamont C, Kager P, Bart A, de Vries H, van Thiel P, et al. (2014) Species-Directed Therapy for Leishmaniasis in Returning Travellers: A Comprehensive Guide. PLoS One 8: 1-16.
- Eiras D, Kirkman L, Murray H (2015) Cutaneous Leishmaniasis: Current Treatment Practices in the USA for Returning Travelers. Curr Treat Options Infect Dis 7: 52-62.
- Henao H, Osorio Y, Gore S, Nancy G, Arlen T (2004) Eficacia y toxicidad de los antimoniales pentavalentes (Glucantime® y Pentostam®) en un modelo animal de leishmaniasis cutánea americana: aplicación de la luminometría. Biomédica 24.
- Munir A, Janjua S (2008) Clinical efficacy of intramuscular megluminean timoniate alone and in combination with intralesional meglumine antimoniate in the treatment of Old World cutaneous leishmaniasis. Acta Dermatovenerol Croat 16: 60-64.
- Andersen E, Cruz M, Llanos A, Luz M, Echevarria J, Miranda C, Colina O (2005) Comparison of meglumine antimoniate and pentamidine for Peruvian cutaneous leishmaniasis. Am J Clin Oncol Cancer Clin Trials 72: 133-137.
- Soto J, Toledo J, Gutierrez P, Nicholls R, Padilla J, Engel J, et al. (2001) Treatment of American Cutaneous Leishmaniasis with Miltefosine. an Oral Agent. Clin Infect Dis 33: 57-61.
- Rahman S, ul Bari A, Mumtaz N (2007) Miltefosine in cutaneous leishmaniasis. J Coll Physicians Surg Pak 17: 132-135.
- Soto J, Grogl M, Berman J (1993) Evaluation of pentamidine for the treatment of cutaneous leishmaniasis in Colombia. Clin Infect Dis 16: 417-425.
- Solomon M, Pavlotzky F, Barzilai A, Schwartz E (2013) Liposomal amphotericin B in comparison to sodium stibogluconate for Leishmania braziliensis cutaneous leishmaniasis in travelers. J Am Acad Dermatol 68: 284-289.
- Dos Santos A, Ferreira E, Miranda L, Carranza C, Cupolillo E, et al. (2008) Efeito de uma formulação hidrofílica de paromomicina tópica na leishmaniose cutânea em pacientes com contra-indicações de tratamento com antimonial pentavalente. Rev Soc Bras Med Trop 41: 444-448.
- Ben Salah A, Zakraou H, Zaatou A, Ftait A, Zaafouri B, et al. (1995) A randomized, placebo-controlled trial in Tunisia treating cutaneous leishmaniasis with paromomycin ointment. Am J Trop Med Hyg 53: 162-166.
- Faghihi G, Tavakoli R (2003) Treatment of cutaneous leishmaniasis with either topical paromomycin or intralesional meglumine antimoniate. Clin Exp Dermatol 28: 13-16.
- Arana B, Mendoza C, Rizzo N, Kroeger A (2001) Randomized, controlled, double-blind trial of topical treatment of cutaneous leishmaniasis with paromomycin plus methylbenzethonium chloride ointment in Guatemala. Am J Trop Med Hyg 65: 466-470.
- Tapia C (2005) Mecanismos de acción, reacciones adversas y nuevos antimicóticos. Medwave 5: e3548.
- Momeni A, Aminjavaheri M, Omidghaemi M (2003) Treatment of cutaneous leishmaniasis with ketoconazole cream. J Dermatolog Treat 14: 26-29.
- López L, Palacio M, Cardona J (2016) Eficacia de los azoles en el tratamiento de la leishmaniasis cutánea. Arch de Medi 12.
- Aronson N, Wortmann G, Byrne W, Howard R, Bernstein W, et al. (2010) A randomized controlled trial of local heat therapy versus intravenous sodium stibogluconate for the treatment of cutaneous Leishmania major infection. PLoS One 4: 1-8.
- López L, Robayo M, Vargas M, Vélez I (2012) Thermotherapy. An alternative for the treatment of American cutaneous leishmaniasis. Trials 13: 1-7.
- Vega J, Sanchez B, Montero L, Montaña R, Mahecha M, et al. (2009) The efficacy of thermotherapy to treat cutaneous leishmaniasis in Colombia: a comparative observational study in an operational setting. Trans R Soc Trop Med Hyg 103: 703-736.
- Bumb R, Prasad N, Khandelwal K, Aara N, Mehta R, et al. (2013) Long-term efficacy of single-dose radiofrequency-induced heat therapy vs. intralesional antimonials for cutaneous leishmaniasis in India. Br J Dermatol 168: 1114-1119.
- Mosleh I, Geith E, Natsheh L, Schönian G, Abotteen N, Kharabsheh S (2008) Efficacy of a weekly cryotherapy regimen to treat Leishmania major cutaneous leishmaniasis. J Am Acad Dermatol 58: 617-624.
- Ranawaka R, Weerakoon H, Opathella N (2011) Liquid nitrogen cryotherapy on Leishmania donovani cutaneous leishmaniasis. J Dermatolog Treat 22: 241-245.
- Layegh P, Pezeshkpoor F, Soruri A, Naviafar P, Moghiman T (2009) Efficacy of Cryotherapy versus Intralesional Meglumine Antimoniate (Glucantime) for Treatment of Cutaneous Leishmaniasis in Children. Am J Trop Med Hyg 80: 172-175.
- Bumb R, Mehta R, Ghiya B, Jakhar R, Prasad N, Soni P, et al. (2010) Efficacy of short-duration (twice weekly) intralesional sodium stibogluconate in treatment of cutaneous Leishmaniasis in India. Br J Dermatol 163: 854-858.







