Palabras clave
Sindrome de Lyell, síndrome de necrólisis epidérmica tóxica, reacción adversa medicamentosa, signo de Nikolsky.
Key words
Lyell´ syndrome, toxic epidermal necrolysis syndrome, drug adverse reaction, Nikolsky´s sign.
Introducción
Las reacciones cutáneas se encuentran entre los tipos más comunes de efectos adversos medicamentosos que ocurren en el 2% de todos los tratamientos. Entre los síndromes cutáneos más graves se encuentra el síndrome de necrólisis tóxica epidérmica (NET) o síndrome de Lyell. Es una dermatitis exfoliativa rara y devastadora, que se presenta como una reacción mucocutánea severa, aguda y episódica relacionada generalmente por fármacos y en menor proporción por infecciones. Su curso natural involucra la piel con una re-epitelización lenta y gradual.
Se caracteriza por áreas maculares de erupción cutánea rápidamente expansivas, con lesiones atípicas que involucran uno o más sitios mucosos (oral, conjuntival, urogenital, anal); la erupción coalesce hasta convertirse en eritema, necrosis y desprendimiento buloso de la epidermis de amplia distribución, semejando quemaduras de segundo grado.1 El cuadro dermatológico se acompaña de afección sistémica severa con daño a órganos internos.
Desde que fue descrita por Allan Lyell en 1956, se han presentado avances importantes en su tratamiento, pero continúa siendo una condición aguda, que pone en riesgo la vida con una mortalidad del 20 al 60%.2,3
Reporte de caso
Masculino de 65 años de edad, sin antecedentes patológicos conocidos, con historia de 1 mes de evolución de artralgia en rodilla derecha, asociado a limitación para la deambulación. Es manejado ambulatoriamente con prednisona 5 mg (1 tab v.o. c/d por 10 días, luego ½ tab v.o. c/d por 10 días, luego ¼ tab v.o. c/d por 10 días).
Refiere que posterior al tratamiento cursa con eritema y prurito generalizado y es manejado ambulatoriamente con metilprednisolona #1 dosis de 40 mg I.V. desarrollando descamación y flictenas generalizadas afectando también las mucosas.
Al examen físico, paciente en mal estado general, taquicárdico, febril (39 °C), hipertenso, con apariencia de gran quemado (90.5 % de superficie corporal total), con lesiones descamativas generalizadas que evolucionan a lesiones ampollares y úlceras que afectan tanto la piel como las mucosas conjuntival, oral, genital. (Figura 1, 2, 3)
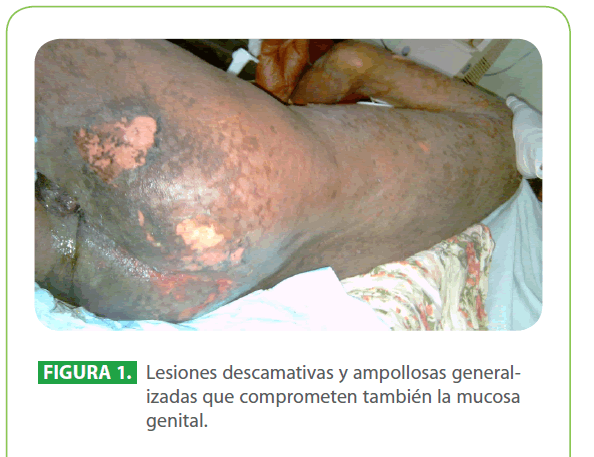
Figura 1: Lesiones descamativas y ampollosas generalizadas que comprometen también la mucosa genital.
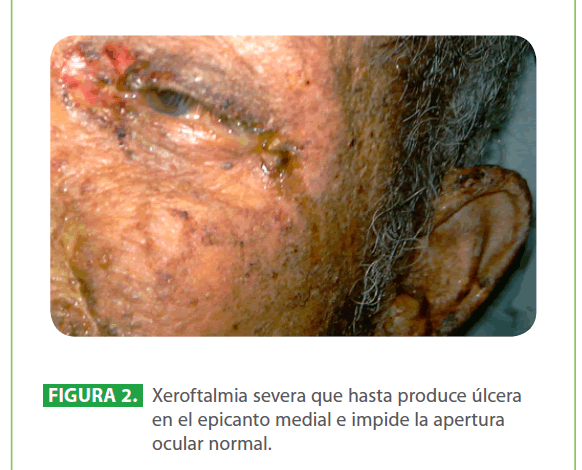
Figura 2: Xeroftalmia severa que hasta produce úlcera en el epicanto medial e impide la apertura ocular normal.
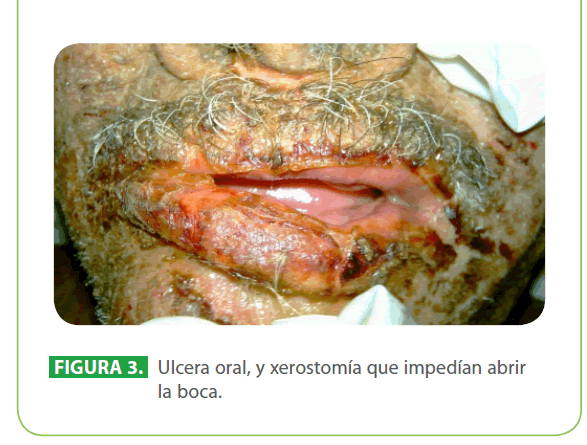
Figura 3: Ulcera oral, y xerostomía que impedían abrir la boca.
Se maneja intrahospitalariamente con antibioticoterapia intravenosa. Adicionalmente se instauró cuidados generales de soporte como colocación de sonda nasogástrica para la alimentación oral, solución oftálmica de acetato de metilcelulosa para las úlceras oftálmicas, y cuidados de las úlceras en piel.
Posteriormente se traslada a la unidad de quemados en donde tiene una evolución tórpida y fallece a las 2 semanas.
Discusión
El síndrome de Lyell, Eritrodermia bulosa con epidermiólisis, Epidermiólisis aguda tóxica universal, Epidermiólisis aguda conbustiforme, Toxicodermis bulosa (Enfermedad de Ritter Lyell), Dermatitis bulosa aguda, Síndrome de Brocq-Lyell, Eritrodermia penfigoide o Necrólisis Epidérmica Tóxica como se conoce actualmente, es una enfermedad rara, de aparición súbita, que se caracteriza por la aparición de ampollas y la descamación extensa de la piel.4 Es la forma más severa de un espectro de síndromes, en donde se emplea cuando afecta ≥ del 30% de la superficie corporal.5
Este caso representa el primer caso clínico reportado en Panamá hasta el momento. Esta enfermedad tiene una incidencia a nivel mundial de 0.5-1.4 casos/millón de habitantes/año.6,7 El pico de edad se da entre 46 – 63 años. En cuanto al sexo, hay un predominio en el sexo fenemino (relación hombre:mujer, 1.6; 2) 6,7 dato que difiere de nuestro caso, que corresponde a un paciente de 65 años, de sexo masculino.
Casi todos (sino todos) los casos son inducidos por fármacos.8 Del 80 al 95% de los casos de NTE son producidos por fármacos, principalmente anticonvulsivos, como la fenitoína y la carbamacepina, barbitúricos, antiinflamatorios no esteroideos derivados del oxicam, sulfonamidas, macrólidos y quinolonas y en menor proporción por infecciones, vacunas y por la enfermedad injerto-contra-huésped.9 En menos del 5% de los casos de NET no se identifican causas, considerándose idiopática. Esto difiere de nuestro caso, en el que la causa medicamentosa fue por un corticoide o un antiparasitario, medicamentos etiológicos poco frecuentes causantes de este padecimiento.
Los mecanismos patogénicos que conducen a la muerte de las células epidérmicas en áreas extensas son poco conocidos. Se han implicado factores genéticos y metabólicos, pero los aspectos inmunológicos son los que imperan. La apoptosis parece ser el mecanismo por el que las células citotóxicas inducen la muerte celular epidérmica.10 Los queratinocitos normales expresan en su superficie el antígeno Fas (CD95), un receptor transmembrana que al unirse al ligando de Fas (LFas) desencadena la apoptosis de la célula. Los pacientes con NET presentan grandes cantidades de LFas en sus queratinocitos.11
Los síntomas iniciales son no específicos e incluyen fiebre, astenia, cefalea, odinofagia, náuseas, vómitos, mialgias y artralgias. La característica fundamental es la aparición posterior de una reacción cutánea papular súbita, eritematosa, en forma de diana, dolorosa, generalizada. Aparecen lesiones vesiculobullosas en la mucosa de las conjuntivas, nasal, oral, regiones vulvovaginales, anorrectales, uretrales, con formación de seudomembranas comprometiendo la alimentación y micción.12-14 La piel se vuelve friable, que el menor roce ocasiona su desprendimiento, llamado signo de Nikolsky positivo15,16 (Figura 4). La extrema facilidad con que las ampollas se rompen, hacen que el paciente prontamente alcance el aspecto de un quemado de 2° grado.6 La piel cabelluda rara vez se afecta, similar a lo ocurrido en nuestro paciente.
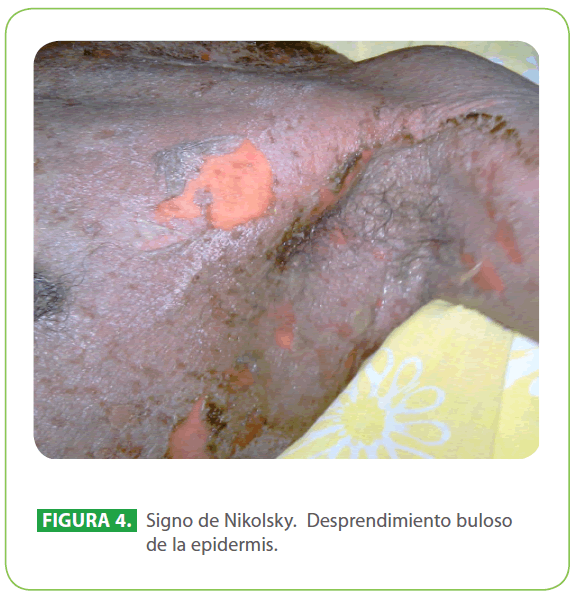
Figura 4: Signo de Nikolsky. Desprendimiento buloso de la epidermis.
El diagnóstico es más que todo clínico. Se realiza biopsia en donde se evidencia abundante queratinocitos necróticos dispersos a lo largo de la unión dermoepidermal, así como células mononucleares dentro de la epidermis.15 Estudios de inmunohistoquímica,se llevan a cabo para descartar enfermedades autoinmunes.17
No existe un tratamiento unificado en el mundo debido a la baja incidencia del NET, los recursos en diferentes partes del mundo son variables y el abordaje terapéutico depende de los insumos con los cuales se disponga.6
1. Remoción inmediata de posibles desencadenantes. La identificación y retiro temprano del agente ofensor mejora el pronóstico.18 Esto no se dio en nuestro caso ya que el paciente fue re-intervenido con corticoide sin haber sido éste descartado como agente causal.
2. Cuidados de soporte.
a. Transferencia a unidad de quemados. Los principios de manejo son similares a la de los pacientes con quemadura. El pronóstico es mejor para los pacientes transferidos prontamente a unidad de quemados disminuyendo la mortalidad global versus aquellos transferidos más de 1 semana después.19 En nuestro caso fue transferido en menos de una semana.
b. Cuidados de la herida. La extensión de la lesión epidérmica debe ser evaluada diariamente y puede ser expresada como porcentaje del área de superficie corporal. El manejo óptimo no ha sido determinado.20 Algunos centros especializados realizan desbridamiento quirúrgico e irrigación para remover epidermis necrótica,21 otros centros mantienen la piel lesionada intacta para que actúe como una cobertura biológica.22 Ambos manejos tienen equivalente tasas de supervivencia y re-epi-telización. En este paciente se optó por conservar la piel intacta. Evitamos la aplicación de sulfadiazina de plata debido a que las sulfonamidas son uno de los agentes etiológicos más frecuentes.
c. Fluidos y nutrición. Desbalances de fluidos y electrolitos pueden ocurrir de acuerdo a la pérdida transepidérmica de agua, pero el remplazo de volumen es típicamente menor al de los pacientes quemados.23,24 Deben usarse calentadores corporales para evitar las pérdidas calóricas. La alimentación oral vía sonda nasogástrica es necesaria y debe ser iniciada tempranamente.
d. Cuidado ocular. La atención inmediata y continua del compromiso ocular es recomendada para evitar complicaciones permanentes.25 Se sugiere una consulta oftalmológica temprana, con exámenes regulares subsecuentes. Como mínimo debe ofrecerse lubricación diaria con gotas o ungüento, tal como se hizo con este paciente.
e. Infecciones. Estos pacientes presentan un alto riesgo de infección y sepsis conllevando un aumento en la mortalidad. La profilaxis con antibióticos sistémicos no es rutinaria en los centros de quemados, sin embargo, esto controversial.19 Se utilizan, en cambio,: manejo estéril y procedimientos de aislamiento, cultivos seriados de piel, sangre, catéteres, y tubos urinarios y gástricos. Los antibióticos tópicos son comúnmente usados. Al paciente se le realizaron hemocultivos y urocultivos seriados. Durante su evolución intrahospitalaria, presentó datos de SIRS y el hemocultivo tomado al ingreso reportó crecimiento de bacilos Gram negativos a las 24 horas por lo que se hace el diagnóstico de sepsis y se inicia tratamiento con piperacilina + tazobactam y amikacina ajustado a su filtración glomerular.
3. Terapia adyuvante.
Más allá del cuidado de soporte no se han establecidos terapias universalmente efectivas para el NET.26,27 Sin embargo, hay experiencias extensas con diversas terapias, incluyendo glucocorticoides y gamaglobulina intravenosa. Sin embargo, ninguna de ellas ha sido estudiada en ensayos controlados. La Tabla N° 1 muestra un resumen de las terapias más utilizadas.28 No contamos con tratamiento de inmunoglobulina, otra de las razones por la cual fue trasladado a centro especializado.
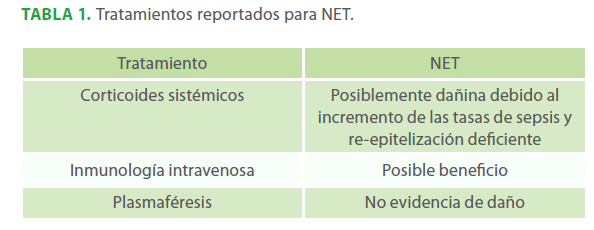
Tabla 1. Tratamientos reportados para NET.
Para estandarizar el grado de severidad y a la vez el pronóstico, se ha diseñado el SCORTEN, que es la más aceptada, evalúa los siguientes parámetros: edad, malignidad, taquicardia, superficie corporal incial afectada, BUN, glucosa, y bicarbonato.29 (Tabla N° 2) Nuestro paciente presentaba 5 puntos que corresponden a una mortalidad > 90%.
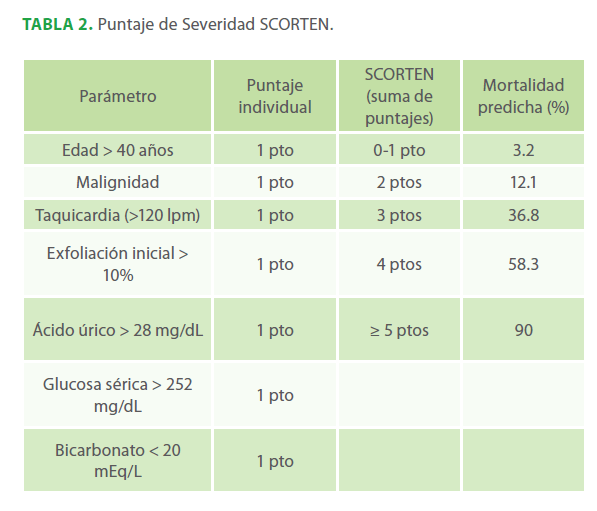
Tabla 2. Puntaje de Severidad SCORTEN.
759
References
- Avakian R, Flowers FP, Araujo O et al. Toxic epidermal necrolysis: a review. J Am AcadDermatol 1991; 25: 69-79
- McGee T, Munster A. Toxic epidermal necrolysis syndrome: Mortality rate reduced with early referral to Regional Burn Center. PlastReconstrSurg 1998; 102(4): 1018.
- Ducic I, Shalom A, Rising W, Nagamoto K, Munster A. Outcome of patients with toxic epidermal necrolysis syndrome revisited. PlastReconstrSurg 2002; 102(3): 768.
- Dolan PA, Flowers FP, Sheretz EF. Toxic epidermal necrolysis. Journal of Emergency Medicine 1989; 7(1): 65-9.
- Ruiz M. R. Acute disseminated toxic epidermal necroylisis types 1, 2, and 3: study of 60 cases. J Am AcadDermatol 1895: 13: 623- 625.
- Ortiz J, Moreno M, Guadarrama E, et al. Necrólisistóxicaepidérmica. An Med Asoc Med Hosp ABC 2001; 46 (1): 40-46.
- Lyell A. Toxic epidermal necrolysis: an eruption resembling scalding of the skin. Br J Dermatol 1956: 68: 355-361.
- García I, Roujeau J. Necrólisisepidérmicatóxica y Síndrome de Stevens-Johnson: clasificación y actualidadterapéutica. ActasDermosifiliogr 2000: 91: 541-551.
- Revuz JE, Roujeau JC. Advances in toxic epidermal necrolysis. SeminCutan Med Surg 1996; 15: 258-266.
- Paul C, Wolkenstein P, Adle H, Wechsler J, Garchon HJ, Revuz J, Roujeau JC. Apoptosis as a mechanism of keratinocyte death in toxic epidermal necrolysis. Br J Dermatol 1996;134:710-4.
- Peñas PF, Ríos L, Buezo GF, García-Díez A. Apoptosis. Revisión de mecanismosmoleculares e implicaciones en dermatología. ActasDermosifiliogr 1998;89:3-13.
- Magnelli M, Flores P, et al. Necrólisisepidérmicatóxicainducidaporfármacos. CasoClínico. CirugíaPlásticaIberoamericana 2008: 34 (4): 305-312.
- Pacheco L., Sánchez MA., Sánchez DL.: “Síndrome de Stevens Johnson. Presentación de un caso”. Rev. CubanaPediatr. 2001, 73 (4): 240.
- Ringheanu M. Et al.: “Toxic epidermal necrolysis in children. An update”. Clin. Pediatr. 2000, 39 (12): 687.
- Díaz De León M, Moreno-Santillán A, González-Díaz J. Necrólisisepidérmicatóxica. Cir Ciruj 2006; 74: 37-40.
- Gutiérrez-Salgado J, Argüelles J, González M. Necrólisisepidérmicatóxica (síndrome de Lyell). Cir Plast 2005: 15(3): 158- 162.
- Harr T, French L. Severe Cutaneous Adverse Reactions: Acute Generalized ExanthematousPustulosis, Toxic Epidermal Necrolysis and Stevens-Johnson Syndrome. Med Clin N Am 94 (2010) 727–742
- Garcia-Doval I; LeCleach L; Bocquet H; Otero XL; Roujeau JC. Toxic epidermal necrolysis and Stevens-Johnson syndrome: does early withdrawal of causative drugs decrease the risk of death?. Arch Dermatol. 2000 Mar;136(3):323-7.
- Palmieri TL; Greenhalgh DG; Saffle JR; Spence RJ; Peck MD; Jeng JC; Mozingo DW; Yowler CJ, et al. A multicenter review of toxic epidermal necrolysis treated in U.S. burn centers at the end of the twentieth century. J Burn Care Rehabil. 2002 Mar- Apr;23(2):87-96.
- Ying S; Ho W; Chan HH. Toxic epidermal necrolysis: 10 years experience of a burns centre in Hong Kong. Burns. 2001 Jun;27(4):372-5.
- Spies M; Sanford AP; Aili Low JF; Wolf SE; Herndon DN. Treatment of extensive toxic epidermal necrolysis in children. Pediatrics 2001 Nov;108(5):1162-8.
- Dorafshar AH; Dickie SR; Cohn AB; Aycock JK; O’Connor A; Tung A; Gottlieb LJ. Antishear therapy for toxic epidermal necrolysis: an alternative treatment approach. PlastReconstr Surg. 2008 Jul;122(1):154-60.
- Mayes T; Gottschlich M; Khoury J; Warner P; Kagan R. Energy requirements of pediatric patients with Stevens-Johnson syndrome and toxic epidermal necrolysis. NutrClinPract. 2008 Oct-Nov;23(5):547-50.
- Chang YS; Huang FC; Tseng SH; Hsu CK; Ho CL; Sheu HM. Erythema multiforme, Stevens-Johnson syndrome, and toxic epidermal necrolysis: acute ocular manifestations, causes, and management. Cornea. 2007 Feb;26(2):123-9.
- Schneck J; Fagot JP; Sekula P; Sassolas B; Roujeau JC; Mockenhaupt M. Effects of treatments on the mortality of Stevens-Johnson syndrome and toxic epidermal necrolysis: A retrospective study on patients included in the prospective EuroSCAR Study. J Am AcadDermatol. 2008 Jan;58(1):33-40. Epub 2007 Oct 4.
- Khalili B; Bahna SL. Pathogenesis and recent therapeutic trends in Stevens-Johnson syndrome and toxic epidermal necrolysis. Ann Allergy Asthma Immunol. 2006 Sep;97(3):272-80; quiz 281-3, 320.
- Revuz JE, Roujeau JC. Advances in toxic epidermal necrolysis. SeminCutan Med Surg 1996; 15: 258-266.
- Bastuji-Garin S, Fouchard N, Bertocchi M, et al. SCORTEN: a severity-of-illnesss score for toxic epidermal necrolysis. J Invest dermatol 2000: 115-149.











