Introducción
Las Zoonosis son enfermedades transmisibles entre los
animales y el hombre [1,2], en particular, la triquinelosis
es una enfermedad zoonótica descrita por Owen en 1835,
[3] y es causada por el nematodo T. spiralis. Esta
enfermedad se ha reportado en casi todo el mundo, su
prevalencia es alta en Europa y Asia, y se asocia con la
ingesta de carne infectada, sobre todo de cerdo [4,5,6,7].
El ciclo biológico de T. spiralis incluye tres fases: a nivel
intestinal, sistémico y muscular, correspondiendo a los
estadíos de adulto, larva recién nacida (LRN) y larva
infectante (LI) [8,9].
El medio ambiente es un factor estresante para todos los
organismos, y en particular las infecciones a que son
blancos. En el presente proyecto se estudió uno de los
mecanismos fisiológicos que utiliza un hospedador para
eliminar y/o contrarrestar el estrés impuesto por la
infección del nematodo T. spiralis. Este estudio enfoca a
un grupo de proteínas conocidas como proteínas de
choque calórico (Hsp), las cuales se expresan de manera
constitutiva y ubicua en las células eucariotas y
procariotas y su síntesis se incrementa con diversas
formas de estrés [10,11,12,13,14,15]. En condiciones
adversas, la función de éstas proteínas es proteger a la
célula del daño producido por el estrés, mediante la
unión a proteínas parcialmente desnaturalizadas,
disociando agregados de proteínas y regulando el doblez
correcto y la traslocación intracelular de proteínas
sintetizadas de novo [16]. Así mismo, las Hsp se unen al
citoesqueleto y ayudan a su función y estabilización en
condiciones normales y de estrés [17].
Una gran variedad de factores son capaces de inducir la
síntesis de las proteínas de estrés, entre los que están:
hipoglucemia, anoxia, calor, frío, etanol, peróxido de
hidrógeno, iones de metales pesados, arsenicales,
infecciones con ciertos virus [18,19,20,21,22],
enfermedades autoinmunes como el lupus eritematoso
sistémico [23], privación de agua y alimento [24],
radiación ultravioleta, radiación electromagnética de baja
frecuencia, campos intensos de radiación gamma[25,26]
y rayos gamma de baja intensidad [27,28].
Las familias de las Hsp están altamente conservadas y se
han clasificado en seis familias: a).- Las Hsp de 100-110
kDa, b).- Las Hsp de 83-90 kDa. c).- Las Hsp de 66-78
kDa, d).- Las Hsp de 60 kDa, e).- Las Hsp de 40 kDa, f).-
Las Hsp pequeñas de 13-25 kDa. Algunas de estas Hsp
son necesarias todo el tiempo, por lo que se expresan de
manera continua, y sirven básicamente en funciones
vitales como moléculas chaperonas [14,15,29,30].
Se ha encontrado que durante la infección por T. spiralis
en ratas Wistar a nivel hepático, se expresan de manera
significativa las Hsp25 y 70, con una expresión normal
de la Hsp60 y una disminución de la Hsp90, así mismo,
en el tejido muscular estriado se encontró un incremento en la expresión de las Hsp25 y 60, y no se encontraron
cambios en la expresión de las Hsp70 y 90 [31]. En otros
estudios realizados en ratas Wistar infectadas con T.
spirallis, se encontró un incremento en la expresión de
Hsp25 y 60 en bazo, y de Hsp70 en cerebro. En cuanto a
la expresión de Hsp90 en tejido de bazo fue reducida
significativamente durante la infección [32].
En un estudio realizado en ratas con infecciones primaria
y secundaria de T. spiralis, se detectó un incremento en
la expresión de Hsp en intestinos en ambos casos.
Mientras que los nódulos linfáticos mesentéricos sólo
presentaron incremento en los niveles de Hsp en ratas
reinfectadas, y en pulmones a los días 7 ó 14, únicamente
[33].
Por lo anterior, en el presente estudio se observó, cuales
son las proteínas de choque calórico (Hsp) que expresan
las ratas Long Evans en la fase intestinal y muscular por
la presencia del nematodo T. spiralis.
El Objetivo fue: Determinar el grado de expresión de
Hsp25, 27, 60, 70 y 90 en tejido intestinal (delgado) y
muscular (pierna, masetero, lengua, diafragma) de ratas
Long Evans infectadas con T. spiralis.
Material y Métodos
Animales e infección.
Se utilizaron ratas Long Evans hembras con una edad promedio
de dos meses y medio, con un peso aproximado de 250 gramos.
Cada animal fue infectado con 500 LI de T. spiralis por vía oral
(trozo de carne infectada; Xenodiagnóstico). Los animales se
mantuvieron en condiciones normales de bioterio.
Determinación del ciclo biológico de T. spiralis en tejido de
rata.
Del lote de ratas infectadas con T. spiralis, se sacrificó un
animal cada día, desde el primer día hasta el 35 post-infección.
Se obtuvo suero, tejido intestinal (duodeno, yeyuno e íleon) y
muscular (pierna, masetero, lengua y diafragma). El suero se
obtuvo para llevar a cabo la determinación de la respuesta
inmune de la rata durante el ciclo biológico de T. spiralis. El
tejido obtenido se dividió en 3 partes: una parte se utilizó para
Western blot (5 mg), otro para compresión en placa (20 mg de
tejido entre 2 portaobjetos) y otro para digestión artificial (60
g).
Compresión en placa (Triquinoscopía).
El trozo de carne infectada (20 mg de tejido) se colocó entre
dos portaobjetos fuertemente unidos para después observar al
microscopio. Si es positivo, se ven los quistes con larvas en su
interior o éstos pueden estar calcificados si corresponden a la
fase clínica de un estado mayor de 24 meses [8,9,34].
Obtención de LI por la Técnica de Digestión Artificial.
Las LI viables se obtuvieron del músculo de ratas Long Evans
infectadas con T. spiralis, las cuales al sacrificarlas, se obtuvo
el tejido muscular (pierna, masetero, lengua, diafragma) que fue
molido. Se pesaron 60 gramos de carne y se colocaron en un
costal de tela de tul, el cual se introdujo en un embudo de
separación para ser sometida a digestión con jugo gástrico artificial, preparado con 1 litro de agua d estilada conteni endo pepsina a una concentració n de 10,000 U , 3% de HCl 0.2 N (pepsina 3.5 grs. más 7 ml de HCl), manteniéndolo en incubación por 24 horas a 37º C. Después se recolectó el paquete larv ario, mismo que fue resuspendido en una solución tamponada de fosfatos (PBS; pH de 7.2) (Gibco BRL, Grand Island NY, USA, 21300 -058) [35]. Después, se hacen diluciones del paquete larva rio y se lleva a cabo un recuento de los nematodos en una cámara de Neubauer. Con esta técnica, al igual que c on la de compr esión en placa, pudimos detectar la presencia d e los nematodos en el tejido d e la rata infectada y con ello c orroborar el paulatino estab lecimiento de los nematodos de T. spiralis durante los 35 días post-infec ción, determinand o así, el ciclo bi ológico de T. sp iralis.
Obtención del antígeno sol uble total (AST ).
A partir de LI obtenidas por digestión a rtificial de músculo estriado de rata infectada c on T. spiralis, e l paquete larvari o se lavó 3 vece s con solución tamponada de fo sfatos (PBS; p H de 7.2) (Gibco BRL, Grand I sland NY, USA , 21300-058), se le añadió 1ml de solución de lisis que contiene: Triton X-10 0 al 1%, NaCl 140 mM, EDTA 1 mM, Tris-H Cl 10 mM pH 7 .6 e inhibidor de proteasas 1 mM, PMSF (Sig ma Chemical C o, St Louis MO, USA, P-7626). En frío, las lar vas con el buffe r de lisis se hom ogenizaron. El lisado se centrifu gó por 10 minutos a 1600 g y el sobrenadan te fue recupe rado. Este mi smo procedimien to fue utilizado para obtener extracto total soluble del tejido de duodeno, yeyuno, íleon, pierna, masetero, leng ua y diafragma [36]. A los ex tractos solubles obtenidos se les determinó la concentración de proteínas mediante la téc nica descrita po r Bradford ( 1976) [37]. D e cada condición experimenta l, 30 µg de proteína se caracterizaron por electroforesis en geles de po liacrilamida (P AGE-SDS al 12. 5%) de acuerdo a la técnica descrita por Laemmli (1970) [38].
Western Blot y análisis.
Las proteín as en los geles de poliacrilamida-SDS fueron transferidas a papel de nitrocelulosa(Amersham Laboratories, Buckingham shire, England, RPN303C) , como desc ribió Towbin (1979) [39]. Para id entificar a las proteínas Hsp, el blot fue tratado con anticuerpos monoclonales específicos contra las Hsp25, 27, 60, 70 y 90 (S igma Chemical Co, St Louis MO, USA, I -139 5, T-6674, H- 4149, H-5147) con una dilución 1:1000. U n anticuerpo anti-IgG de ratón conjugado a peroxidasa (Sigma Chemic al Co, St Louis MO, USA, A-9044) dilución 1:1500, fue usado como segundo anticuerpo, seguido por un si stema de dete cción quimioluminiscente (E CL, RPN2106, Amersham, Little Chalfont, Buckinghamshire, England), que fue detectado en una película radiogr áfica BioMax (Ea stman Kodak C o, Rochester, N Y, USA, 870-1302) en un tiempo de 1 minuto [40].
Determinac ión de la canti dad de Hsp:
Las autorradiografías obtenidas por el método de EC L se analizaron por densitom etría (Eagle Eye, Estrata gene Mitsubishi), con el fin de cuantificar la cantidad de prot eína tanto de la c ondición contro l (tejidos sin infectar), como d e los problemas (tejidos infectado s).
Análisis estadístico:
A cada ban da de proteína H sp25, 27, 60, 7 0 y 90 obtenida bajo las condici ones control (tejido sin infec tar) e infectad o y analizados por densitometrí a, los resultados obtenidos de esta, son expresados como medi a ± s.e.m., donde n es el número de observaciones.
Resultados
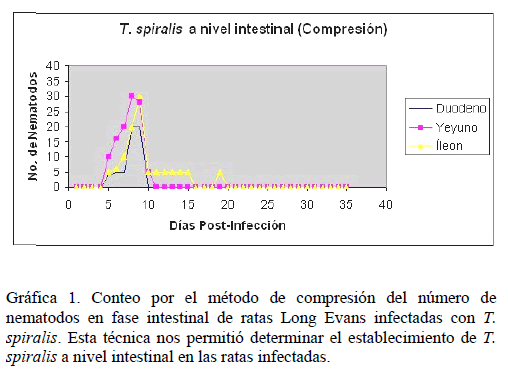
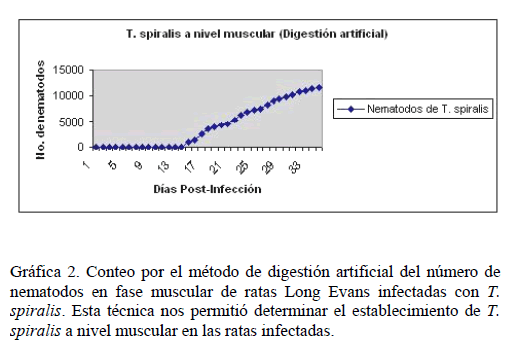
Ciclo Biológico d e T. spiralis. Es conocido q ue el ciclo bio lógico de T. spiralis incluye tres fases, intestinal, sistémica y musc ular. Para corroborar la infec ción de las ratas con T. spir alis tanto en la fase intestinal como la mu scular, analiza mos el estable cimiento de la s larvas por me dio de compresión en placa y digestión artificial. Se encontró, un establecimiento de las larvas en duodeno, yeyuno e íleon a partir del quinto día (Gráfica 1), y a par tir del décimo sexto día, s e localizan la s larvas en pier na, masetero, lengua y diafr agma (Gráfica 2).
Gráfica 1. Conteo p or el método de compresión de l número de nematodos en fase in testinal de ratas Long Evans infectadas con T. spir alis. Esta técnica nos permitió determinar el establec imiento de T. spir alis a nivel intestin al en las ratas inf ectadas.
Gráfica 2. Conteo por el método de di gestión artificial d el número de nematodos en fase m uscular de ratas Long Evans infectadas con T. spir alis. Esta técnica nos permitió determinar el establec imiento de T. spir alis a nivel muscu lar en las ratas inf ectadas.
Res puesta inmun e a T. spiralis
Al analizar la re spuesta inmune de las ratas infectadas con T. spralis, se encontró u n reconocimiento de los det erminantes antigénicos a par tir del sexto día (antígeno de 67 Kd corr espondiente a cutícula), mismo que cor relaciona con el establecimi ento de las larvas a nivel intestinal. Este re conocimiento c onforme pasa ron los días post-infección fu e en aumento, detectándose con mayor claridad los an tígenos de 4 8, 45, 42 y 32 Kd, cor respondiente a cavidad celóm ica (Figura 1).
Figura 1. Respuesta inmune a la infección con T. spiralis en ratas Long Evans. Se e ncontró una resp uesta a partir del sexto día (67 Kd, correspondien te a cutícula y 48, 45, 42 y 32 Kd, correspondie nte a cavidad celó mica), con un incremento en el reco nocimiento antig énico en el vigésimo día. D=días. Técnica de PAGE-S DS, utilizando AS T de T. spiralis, y como anticuerpos, el suero de rat a infectada por 6 y 20 días pos-infec ción.
Expresión de Hsp en t ejido de rata sana e infectada con T. spiralis
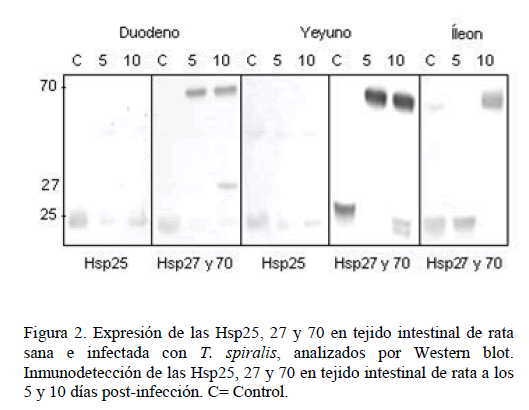
La expresión de las proteínas Hsp en t ejido intestina l se analizó por Western blot, encontrando que el duoden o de rata sana, e xpresa de ma nera constituti va las Hsp25, 27 y 70, y el ye yuno e íleon, expresan las Hsp25 y 70. En el tejido intes tinal infectado con T. spiral is analizado en los días 5 y 1 0 pos-infecció n, se incrementa la expresió n de las Hsp, siendo más evidente para la Hsp70 en las tres porciones de intestino de lgado (Figura 2, Gráfica 3). No se encontr aron cambios en la expresió n de las Hsp6 0 y 90 en el tejido sano ni en el infectado (datos no presentados).
Figura 2. Ex presión de las Hs p25, 27 y 70 en tejido intestinal de rata sana e infe ctada con T. sp iralis, analizados por Western blot. Inmunodetec ción de las Hsp25, 27 y 70 en tejido intestinal de rata a los 5 y 10 días po st-infección. C= Control.
Gráfica 3. Análisis cu antitativo por dens itometría de las H sp25, 27 y 70 expresadas en el tejid o intestinal de rata infectada con T. spiralis. A las band as obtenidas por Western blot-ECL , se les realizó d ensitometría y su d ensidad óptica fue graficada.
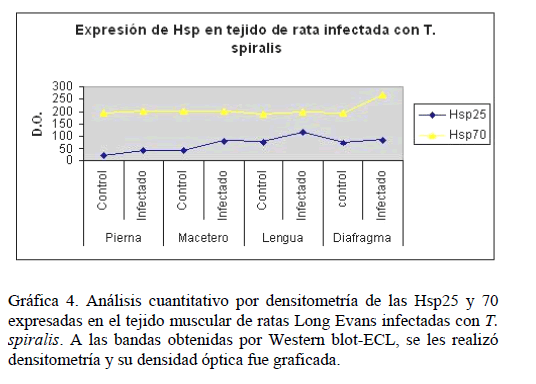
Al analizar la expresión de las proteínas Hsp en tejido incr ementa la expresión de las H sp25 y 70, sie ndo mayor en lengua para la Hsp25 y en diafragma para la Hsp70 (Figura 3, Gráfica 4). En el pre sente estudio, el grado de expresión de las proteínas Hsp6 0 y 90 no ca mbió por la infe cción con T. spiralis (datos no presen tados). Así mismo, no enco ntramos la expresión de la Hsp27 en teji do muscular.
Figura 3. Expresión d e Hsp25 y 70 en tejido muscular de ratas Long Eva ns infectadas con 500 LI de T. spir alis. El estudio fue en el día 25 post-infección. C= Control; I= Infectado .
Gráfica 4. Análisis c uantitativo por densitometría de las Hsp25 y 70 expresadas en el tejid o muscular de rata s Long Evans inf ectadas con T. spir alis. A las bandas obtenidas por W estern blot-ECL, se les realizó densitometría y su den sidad óptica fue graficada.
Discusión
En el presente estudio se analizaron las proteínas de choque calórico (Hsp) que expresa el tejido de las ratas Long Evans cuando son infectadas con T. spiralis.
El Objetivo fue determinar el grado de expresión de Hsp25, 27, 60, 70 y 90 en tejido intestinal (delgado) y muscular (pierna, masetero, lengua, diafragma) de ratas Long Evans infectadas con T. spiralis.
Lo primero que se analizó, fue la infección de las ratas con T. spiralis para lo cual, se analizó el ciclo biológico utilizando el conteo de los nematodos a nivel intestinal y muscular por medio de las técnicas de compresión en placa y digestión artificial, así como, la respuesta inmune de las ratas contra el parásito. Se encontró que la infección por T. spiralis, desencadena una respuesta del hospedador a partir del sexto día, correlacionado con el establecimiento de las larvas en la pared del intestino delgado. Las larvas de T. spiralis se establecen en músculo entre los días 15 y 16, en donde también se observa en el mismo periodo, un aumento del reconocimiento antigénico, datos que coinciden con lo reportado por Despommier, 2004 [9] y Sánchez-Rodríguez et al., 2006 [40].
Una vez que se corroboró que los animales estaban infectados y que existía una respuesta inmune del hospedador contra T. spiralis, obtuvimos el tejido intestinal entre los días 5 y 10 que se conoce que se encuentra el nematodo alojado en la pared intestinal, donde se reproduce, y analizamos el grado de estrés que produce la presencia de este nematodo en el tejido epitelial intestinal medido a través de la expresión de las Hsp, encontrando la expresión basal de las Hsp25, 27 y 70 en las tres porciones de intestino delgado sano, con un incremento significativo de la Hsp70 en el tejido infectado. Es importante resaltar la sobreexpresión de la Hsp70, ya que se conoce que participa como un mecanismo de respuesta celular ante agentes estresantes [41,42]. Para el caso particular, se conoce que este nematodo a nivel intestinal, secreta una gran cantidad de agentes estresantes como son productos bioactivos que están relacionados con la falla de las barreras mecánica y humoral del hospedador, ayudando a que el parásito se aloje en el hospedador [43], por lo que el incremento de la Hsp70 se puede deber a la presencia de estos productos bioactivos secretados por T. spiralis.
Después, analizamos la expresión de las Hsp en el tejido muscular en el día 25 post-infección, donde tuvimos la certeza de que estaba invadido de nematodos, los cuales empezaron a establecerse entre los días 15 y 16 post-infección. La expresión basal de las Hsp en el tejido muscular sano (pierna, masetero, lengua y diafragma) fue principalmente de las Hsp25, 60, 70 y 90 y en el infectado se incrementa ligeramente la expresión de las Hsp25 y 70, siendo mayor en lengua y diafragma. En el presente estudio, es importante resaltar que las proteínas Hsp60 y 90 no mostraron cambios en su expresión con respecto al control debido a la infección por T. spiralis en el tejido muscular (datos no presentados).
En el presente estudio la sobreexpresión de las Hsp se da por la infección de la T. spiralis, y para el caso particular, esta parasitosis produce fiebre en el hospedador, por lo que podemos entender la sobreexpresión de la Hsp70 ya que esta proteína se expresa principalmente por calor y otras formas de estrés [28]. Así mismo, la sobreexpresión de las Hsp se puede deber a la gran cantidad de productos bioactivos como enzimas que produce y secreta el nematodo T. spiralis en su entorno durante su ciclo biológico, sobre todo para cruzar del intestino a la linfa y durante su implante en músculo, generando estrés celular [43,44,45,46].
Conclusiones
La infección por T. spiralis, desencadena una respuesta del hospedador a partir del sexto día, mismo que se correlaciona con el establecimiento de las larvas en la pared del intestino delgado. Las larvas de T. spiralis se establecen en músculo entre los días 15 y 16, en donde se observa en el mismo periodo, un reconocimiento mayor de los determinantes antigénicos (67, 48, 45, 42 y 32 kDa).
El tejido intestinal sano, duodeno, yeyuno e íleon, expresa a las Hsp25, 27 y 70, y en el infectado se incrementa su expresión, siendo más evidente para la Hsp70.
El tejido muscular sano, pierna, masetero, lengua y diafragma, expresa, a las Hsp25, 60, 70 y 90, y en el infectado se incrementa la expresión de la Hsp25 y la Hsp70.
Agradecimientos
Apoyo del CONACYT. Dr. Sergio Hugo Sánchez Rodríguez.
Contrato: 499100-5-I31456-N.
Bibliografía
- Schwalbe CW. Medicina veterinaria y salud pública. México, DF. Editorial Novaro. 1969.
- Martínez-Conde J. Guía del inspector veterinario titular. Epizootiología y zoonosis. Barcelona: Biblioteca Veterinaria Aedos. 1975.
- Owen R. Description of a microscopic entozoan infesting the muscle of the human body. Trans. Zool. Soc. 1835;1:315-324.
- Krivokapich SJ, Molina V, Bergagna HF, Guarnera EA. Epidemiological survey of Trichinella infection in domestic synantrhopic and sylvatic animals from Argentina. J. Helminthol. 2006;80 (3):267.
- Luna SB, Sánchez-Rodríguez SH. Triquinelosis Humana. Archivos de medicina. 2006;2(4).Sánchez-Rodríguez SH, Luna SB. Triquinelosis: modelo de estudio y técnicas de diagnostico clínico. Archivos de Medicina. 2006;2(6).
- Reiterova K, Kincekova J, Snabel V, Marucci G, Pozio E, Dubinsky P. Trichinella spiralis-outbreak in the Slovak Republic. Infection. 2007;35(2):89-93.
- Pozio E. World distribution of Trichinella ssp. infections in animals and humans. Vet Parasitol. 2007;149:3-21.
- Despommier D, Gwadz WR, Hotez JP. Parasitic disease. Springer Verlag. Third edition. 1994. pp.32 – 40.
- Despommier D. Trichinella spiralis. Apple Trees Productions., New York, 2004.
- Lindquist S. The heat shock response. Annual Review of Biochemistry. 1986;55:1151-1191.
- Lindquist S, Craig EA. The heat shock proteins. Annu. Rev Genet. 1988;22:631-637.
- Morimoto RI, Milaski KL. In Estress Proteins in Biology and Medicine. pp. 1-36. Marimoto, RI, Tissieres A, Georgopoulos C., eds. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York. 1990. pp. 332-359.
- Welch WJ. Stress Proteins in Biology and Medicine, Morimoto RI., et al., (eds). Cold Spring Harbor Lab. Cold spring Harbor, N.Y. 1990. pp. 223-278.
- Hendrick JP, Harti FU. Molecular chaperone functions of heat-shock proteins. Annual Review of Biochemistry. 1993;62:349-384.
- Harti FU. Molecular chaperones in cellular protein folding. Nature. 1996;381:571-580.
- Goodman R, Blank M. Magnetic field stress induces expression of Hsp 70. Cell Stress & Chaperones. 1998;3(2):79-88.
- Liang P, MacRae TH. Molecular chaperones and the cytoskeleton. Journal of Cell Science. 1997;110:1431-1440.
- Guerreiro V. Jr, Raynes DA. Synthesis of heat stress proteins in lymphocytes from livestock. J. Anim. Sci. 1990;68:2779.
- Ciocca DR, Oesterreich S, Chammess GC, McGuire WL, Fuqua SAW. Biological and clinical implications of heat shock protein 27000 (Hsp27): a review. Journal of National Cancer Institute. 1993;85:1558-1569.
- Lin H, Li H, Blank M, Head M, Goodman R. Magnetic field activation of protein-DNA Binding. Journal of Cellular Biochemestry. 1998;70:279-303.
- Bañuelos-Valenzuela R, Sánchez-Rodríguez SH. La proteína de estrés calórico hsp70 funciona como un indicador de adaptación de los bovinos a las zonas áridas. REDVET. 2005;VI(3).
- Sánchez-Rodríguez SH, Ramírez-Alvarado ED., Barajas- Vásquez GE., Cardona-Félix CS. El efecto estresante del tabaco, alcohol, sobrepeso y exceso de ejercicio físico, es manifestado a través de la expresión de la hsp70. Archivos de Medicina. 2006;2(4).
- Villalobos-Hurtado R, Sánchez-Rodríguez SH, Avalos-Díaz E, Herrera Esparza R. Possible role of hsp70 in autoantigen shuttling to the dermo-epidermal junction in systemic lupus erythematosus. Reumatismo. 2003;55:155-158
- Barajas-Vásquez GE, Baldwin-Sevilla C, Barbosa-Cisneros OY, Sánchez-Rodríguez SH. Las proteínas de estrés calórico hsp60, 70 y 90 participan en la adaptación de los caprinos a las zonas áridas. REDVET. 2005;VI(3).
- Saran M, Bors W. Radiation chemistry of physiological saline reinvestigated: evidence that chloride-derived intermediates play a key role in cytotoxicity. Radiation Research. 1997;147:70-77.
- Feder EM, Hoffmann EG. Heat-Shock proteins, molecular Chaperones, and the stress response: Evolutionary and Ecological physiology. Annu Rev. Physiol. 1999;61:243.282.
- Vega-Carrillo HR, Bañuelos-Valenzuela R, Manzanares- Acuña E, Sánchez-Rodríguez SH. Response of human lymphocytes to low gamma ray doses. Alasbimn Journal. 2001;3(12).
- Sánchez-Rodríguez SH, Ramírez AED, Barbosa COY. El estrés impuesto por los rayos gamma, peróxido de hidrógeno y calor es amortiguado por cambios en la expresión y localización de la HSP70 en células HeLa. Archivos de Medicina.2007;3(3).
- Hass YG. BiP-A Heat Shock Protein involved in immunoglobulin chain assembly. Curr. Top. Microbiol. Immunol. 1991;167:71.
- Leppa S, Sistonen L. Heat shock response pathopysiological implications. Annals of Medicine. 1997;29:73-78.
- Martínez J, Pérez SJ, Bernadina W, Rodríguez CF. Influence of parasitation by Trichinella spiralis on the levels of heat shock proteins in rat liver and muscle. Parasitology. 1999a;118:201-209.
- Martínez J, Pérez-Serrano J, Bernadina WE, Rodríguez- Caabeiro F. Shock response induced rat brain and spleen during primary infection with Trichinella spiralis larvae. Parassitology. 1999b;118:605-613.
- Pérez-Serrano J, Martínez J, Regal P, Bernardina WE, Rodríguez-Caabeiro F. Prior immunity to Trichinella spirallis prevents (re)occurrence of an explicit stress response in intestines but not in mesenteric lymph nodes, Herat and lungs from reinfected rats. Parasitology. 2000;121(5):565-573.
- De la Rosa JL, Gómez A. “Trichinella y triquinosis”. Ed. Mc. Graw Hill, México. 2004.
- Del Río A, Herrera RM, Herrera R. “Triquinosis experimental I: extracción de antígenos y procedimiento para detectar anticuerpos”, Arch. Invest. Med. 1986;17:359- 367.
- Harlow E, Lane D. Antibodies a laboratory manual. Cold Spring Harbor Laboratory. Cold Spring Harbord, N.Y. 1988.
- Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical. Biochemistry. 1976;72:248-254.
- Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature (London). 1970;227:680.
- Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of protein from polyacrilamide geles nitrocellulose sheets: procedure and aplications. Proc. Natl. Acad. Sci. USA. 1979;76:4350-54.
- Sánchez-Rodríguez SH, Luna SB. Triquinelosis: modelo de estudio y técnicas de diagnostico clínico. Archivos de Medicina. 2006;2(6).
- Morimoto RI, Tissieres A, Georgopoulos C. The biology of the heat shock proteins and molecular chaperones. New York: Cold Spring Harvor Laboratory Press, 1994; pp-610.
- Terlecky SR. Hsp70s and lysosomal proteolysis. Experientia. 1994;50:1021-1025.
- Moczon T, Wranicz M. Trichinella spiralis proteinases in the larvae. Parasitol. Res. 1999;85:47-58.
- Polzer M, Conradt V. Identification and partial characterization of the proteases from diferent developmental stages of Schistocephalus solidus (cestoda: Pseudophyllidea). Int. J. Parasitol. 1994;24:967-973.
- Criado FA, Armas SC de, Jiménez PC, Casado EN, Jiménez GA, Rodríguez CF. Proteolytic enzymes from Trichinella spiralis larvae. Vet. Parasitol. 1992;45:133-140.
- Armas SC, Jiménez PC, Jiménez GA, Bernadina WE, Rodríguez CF. Purification and preliminary characterization of a protease from the excretion-secretion products of Trichinella spiralis muscle-stage larvae. Vet. Parasitol. 1995;59:157-168.
1095