Keywords
Cuttlefish, Sepia officinalis, spawning, egg, development, incubation
Giriş
Son yıllarda kafadanbacaklı yetiştiriciliğinin
önemi artmıştır. Kafadanbacaklılar, fizyoloji, sinirbilim,
besin biyokimyası, yaşlanma, moleküler
biyoloji ve immünoloji alanlarında olduğu gibi
tıbbi ve biyolojik araştırmalarda sinir sistemleri
ve duyu organlarından dolayı tercih edilen araştırma
modelleridir (Lee, 1994; Oestmann vd.,
1997; Koueta ve Bouchaud-Camou, 1999). Dünyanın
birçok bölgesinde yüksek fiyatlarla insan
gıdası olarak tüketilen değişik türleri vardır
(González vd., 1996; Sánchez vd., 1998; Rocha
vd., 1999).
Kafadanbacaklılar tüm yaşamları boyunca %3
ile %10 arasında hızlı gelişim oranlarına
(Forsythe ve Van Heukelem, 1987), kısa bir yaşama
ve yüksek büyüme kabiliyetine sahip canlılardır
(Lee, 1994). Günlük olarak vücut ağırlıklarının
%20-50’si oranlarında beslenebilirler
(Boucher-Rodoni vd., 1987). Bu yüzden yetiştiricilik
için potansiyelleri yüksektir (Lee vd., 1998).
Sübye (Sepia officinalis) Akdeniz’ de ve Kuzey
Denizi’nden Doğu Atlantik’e kadar dağılım
göstermesine rağmen güneydeki sınırları bilinmemektedir
(Roper vd., 1984; Nixon ve
Mangold, 1998). Sübye, balık ve krustaselerle
beslenir (Blanc vd., 1999). Daha büyük boylara
ulaştıkça beslenmede balığın önemi artarken
krustaselerin önemi azalmaktadır (Castro ve
Guerra, 1990).
Sepia officinalis en kolay yetiştirilebilen kafadanbacaklı
türlerindendir. Bu tür, dünya üzerinde
1960’ların sonundan bu yana akvaryumda bakılmakta
ve yetiştirilmektedir (Richard, 1971;
Pascual, 1978; Boletzky ve Hanlon, 1983;
Forsythe vd., 1994; Lee vd., 1998; Domingues
vd., 2001a,b,2002,2003a). Laboratuardaki ömrü,
su sıcaklığı, beslenme rejimi ve yetiştiricilik yoğunluğuna
göre büyük değişkenlik gösterir.
Forsythe ve diğerleri (1994), 20°C’de ortalama
ömürlerinin 17 ay olduğunu ve üreme dönemlerinin
2 ay sürdüğünü bildirmişlerdir. Richard
(1971), 15°C’de bir yıldan fazla yaşayabildiklerini
ve hayatlarının son çeyreğinde üremenin gerçekleştiğini
belirmiştir. Bu bulguların aksine
Domingues ve diğerleri (2006) 40 gramdan küçük
ve 30 günden az süren üreme dönemleri ile
ömürlerinin 6 aydan kısa sürdüğünü rapor ederken,
Skyes ve diğerleri (2006) sübyelerin 2 ayda
olgunlaşabileceğini, ağırlıklarının 40 gramdan az
ve 1 aydan daha kısa üreme dönemi gösterdiklerini
bildirmişlerdir. Domingues ve diğerleri
(2002) 25°C’de yetiştirilen sübyelerin 45 günde cinsel olgunluğa eriştiklerini ve üreme dönemlerinin
20 gün sürdüğünü bildirmişlerdir. Doğada,
sübye ortalama 2 yıl yaşar ve yumurtlama dönemi
sıcaklığa bağlı olarak değişir (Guerra,
2006), yumurtlama başladığında dişiler laboratuarda
yetiştirilenlerden daha büyük ve daha yaşlıdır.
Son 15 yıl boyunca, kafadanbacaklıların
beslenmesi için yaş ve kuru peletler (Lee vd.,
1991; Castro vd., 1993) ile surimi (yoğunlaştırılmış
balık kas-lifi proteini; Castro vd., 1993;
Castro ve Lee, 1994; Domingues, 1999;
Domingues vd., 2005) test edilmiştir ve önemli
bir başarı elde edilememiştir. Bu durum sübye
yetiştiriciliği için çözülmesi gereken en önemli
konudur. En son elde edilen sonuçlar, kafadanbacaklıların
yapay besinlerin emilimi ve özümsenmesiyle
ilgili bazı sınırlara sahip olduğunu yani
besinsel lipidlerin en az sindirilebilir bileşenler
olduğunu göstermiştir (Miliou vd., 2005; Petza
vd., 2006).
Sepia officinalis yetiştiricilik için ideal özelliklere
sahip bir türdür. Çeşitli ebatlarda ve şekillerdeki
yetiştiricilik tanklarına kolaylıkla uyum
sağlar, aşırı yetiştiricilik yoğunluklarını en az
hastalık yan etkileriyle atlatır ve ömrünün son
%75’lik diliminde donmuş karides ve balıkla
beslenerek gelişebilir (Forsythe vd., 1994). Bu
çalışmada doğadan olta ile yakalanan ergin sübyelerin
kontrollü koşullarda yumurtlaması, bazı
davranışlarının ve yumurtalarının gelişimi ile
açılım oranları incelenmiştir.
Materyal ve Metot
Çalışmalar 16.03.2008–16.06.2008 tarihleri
arasında yapılmıştır. Çalışmada kullanılan 7 adet
olgun (2 erkek, 250–425 gr; 5 dişi, 210–390 gr) Sepia officinalis, 16.03.2008 tarihinde İzmir Körfezi’
nden olta ile avlanmıştır. İçinde 20 L deniz
suyu olan yarı şeffaf dikdörtgen plastik 2 adet
kapaklı taşıma kabına (55×35×30 cm; 50 L su
hacmi) konulan sübyeler, su değişimi ve havalandırma
yapılmaksızın, arabayla yaklaşık 1 saatte
Ege Üniversitesi Su Ürünleri Fakültesi’ nin
Urla Akuakültür Ünitesi’ ne nakledilmiştir. Sübyeler,
filtre edilmiş akışkanlı deniz suyuna sahip
ve içinde havalandırma bulunan dibi kumlu 2
tonluk kare polyester tanka (2×2×1m) konulmuştur.
Yumurtlama periyodu boyunca, aydınlatma
tankın merkezinde bulunan 4 adet 33 W lık
beyaz flüoresan lamba ile doğal fotoperiyotta yapılmıştır.
Tanktaki deniz suyunun ortalama su sıcaklığı
17.4 ±1.1°C ve ortalama tuzluluğu ‰ 37
±0.5 olarak ölçülmüştür. Bu dönemde sübyeler, taze cansız sardalye (Sardina pilchardus), hamsi
(Engraulis encrsicolus), kupes (Boops boops),
canlı ve taze cansız horozbina (Parablennius
gottorugine), Kömürcü karası (Gobius niger),
canlı ve taze cansız yengeç (Goneplax
rhomboides) ve canlı teke (Paleomon sp.) ile ad
libitum olarak beslenmiştir. Yenmeyen yemler ve
artıklar ortamdan uzaklaştırılmıştır.
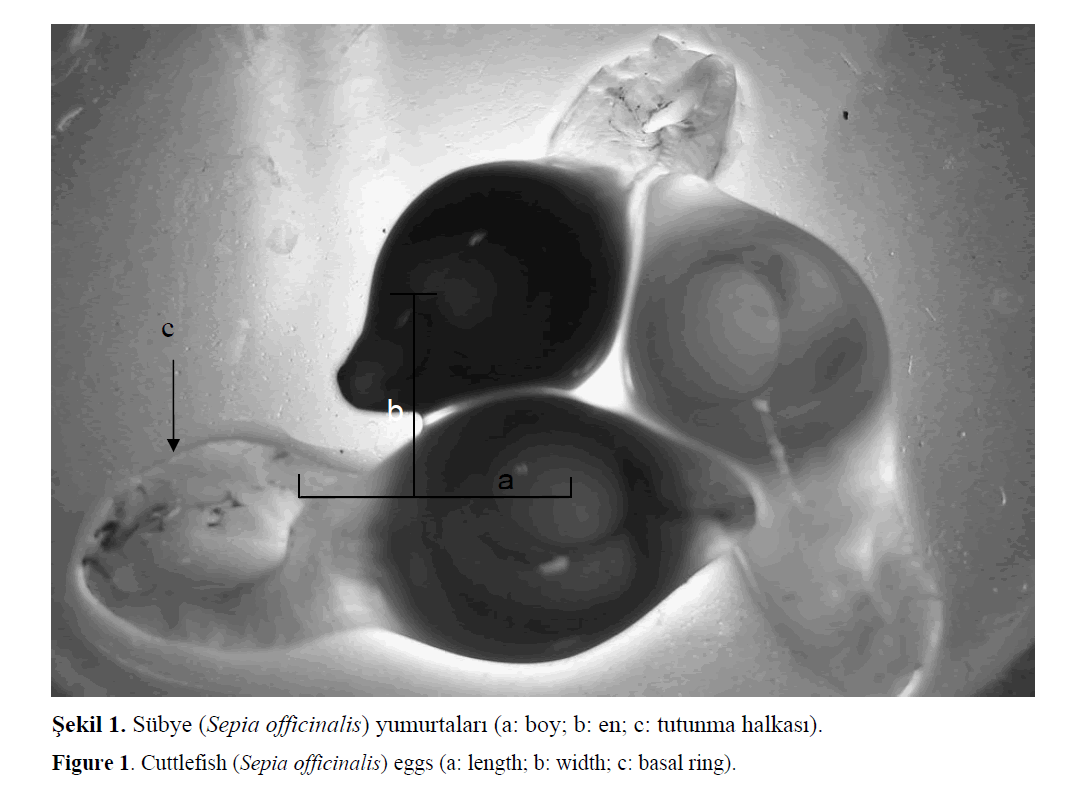
Sübye yumurtalarının (n=30), boyu ve eninin
ölçümleri milimetrik cetvelle yapılmıştır (Şekil
1). Ayrıca, embriyonik gelişimi gözlemlemek
için 200 adet yumurta ve inkübasyon süresi ile
açılım oranını tespit etmek için de 96 adet aynı
dönemde yumurtlanmış yumurta kullanılmıştır.
Bu işlemler için yumurtalar, filtre edilmiş sürekli
su giriş sistemine (%80/gün su akışı) ve havalandırmaya
sahip 14 tonluk dairesel polyester tank
içine yerleştirilen ve içinde havalandırma bulunan,
su giriş çıkışını sağlamak için 500 μ göz
açıklığına sahip plankton bezi ile çevrili, 10 litrelik
kovalara konulmuşlardır. Aydınlatma tankın
merkezinde bulunan 4 adet 33 W lık beyaz flüoresan
lamba ile doğal fotoperiyotta yapılmıştır.
Şekil 1. Sübye (Sepia officinalis) yumurtaları (a: boy; b: en; c: tutunma halkası).
Figure 1: Cuttlefish (Sepia officinalis) eggs (a: length; b: width; c: basal ring).
Yumurtaların embriyonik gelişim safhaları
Naef (1928) ve Lemaire (1970)’e göre tanımlanmıştır Deneme süresince yumurtaların
embriyonik gelişimleri, rasgele örnekleme yöntemiyle
günlük olarak binokülerden (7.5X-30X
büyütme) yapılmıştır. Bazı kritik gelişim safhalarının
tespiti yumurta kapsülünün ve koryonunun
alınması ile canlı embriyolar kullanılarak, Sony
DSC W5 model dijital kamerayla, binokülerden
direkt fotoğraf çekim tekniği ile yapılmıştır. Çalışma
boyunca ortalama su sıcaklığı 19.6 ±1.7°C
ve ortalama tuzluluk ‰37 ±0.5 olarak saptanmıştır.
Yumurtaların inkübasyon süresinin ve açılım
oranının incelenmesi için 96 adet yumurta 3
gruba (her birinde 32 adet yumurta) bölünerek
inkübasyona alınmıştır. Yumurtaların açılım
oranı [YAO=(Açılan Yumurta Sayısı / İnkübe
Edilen Yumurta Sayısı)*100], inkübasyon süreleri
ve yumurtadan çıkış yüzdeleri ile süreleri hesaplanmıştır
(Şen, 2004). Deneme süresince ortalama
su sıcaklığı 21.8 ±1.7°C ve ortalama tuzluluk
‰37 ±0.5 olarak tespit edilmiştir. Makale
içerisinde değerler, ortalama±standart sapma olarak
verilmiştir.
Bulgular ve Tartışma
Yumurtlama, 17.4 ±1.1°C su sıcaklığında, 46
günlük bir dönemde aralıklı olarak 32 kez olmuştur.
Deneme boyunca tankta çiftleşme davranışı
tespit edilmemiştir. Ancak erkek sübyenin
dişi bireyi koruduğu ve yumurtlamaya teşvik ettiği
gözlenmiştir. Sabahın erken saatlerinde ve
akşamüstü sübyelerin havalandırma hortumunun
üzerine yumurtalarını bıraktıkları tespit edilmiştir
(Şekil 2). Beş adet dişi sübye deneme süresince
toplam 1567 adet yumurta yumurtlamışlardır ve
dişi başına ortalama 313.4 adet yumurta elde
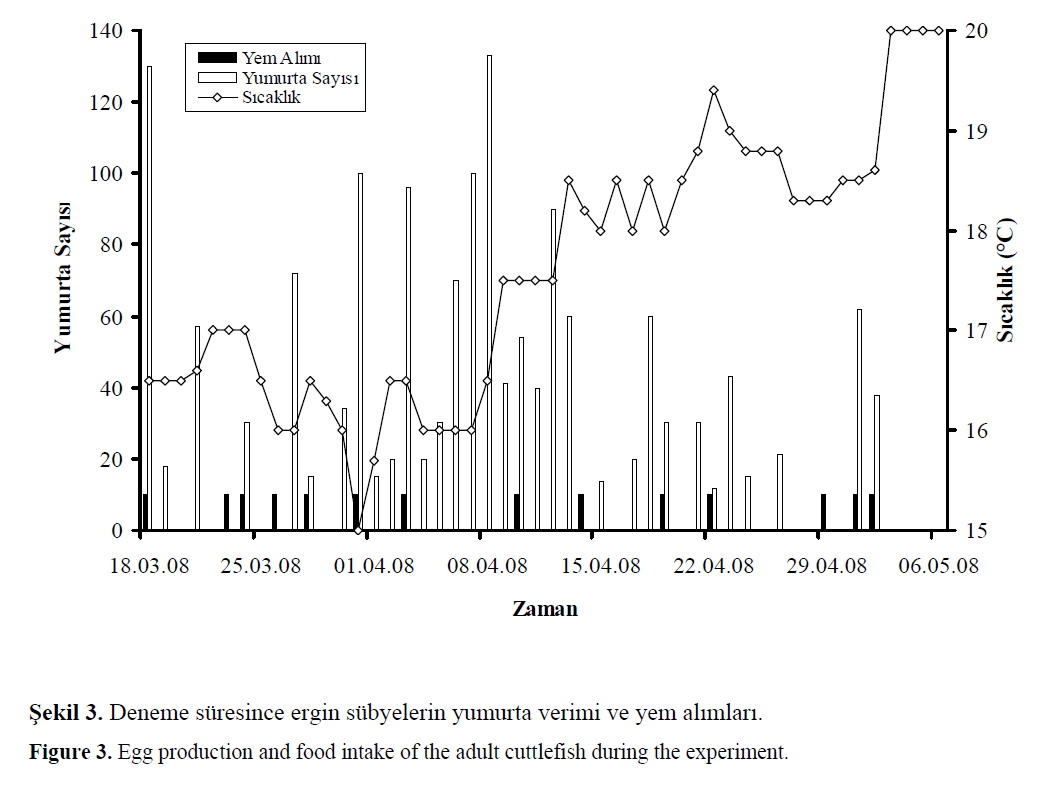
edilmiştir. Şekil 3’de sübyelerin yumurtlama sıklıkları,
yumurta sayıları ile beslenme sıklıkları
verilmiştir. Tablo 1 de yumurta büyüklükleri verilmiştir.
Şekil 2. Dişinin üzerinde yüzen bir erkek sübyenin diğer erkeğe karşı dişiyi koruma davranışı ve
havalandırma hortumunun üzerine yumurtlanmış sübye yumurtaları.
Figure 2: A male hovering on a female shows agonistic behavior against another male, and cuttlefish eggs
spawned on air pipe.
Şekil 3. Deneme süresince ergin sübyelerin yumurta verimi ve yem alımları.
Figure 3: Egg production and food intake of the adult cuttlefish during the experiment.
Tablo 1. Sepia officinalis yumurtalarının bazı
meristik özellikleri.
Table 1:Some meristic characteristics of Sepia officinalis’ eggs.
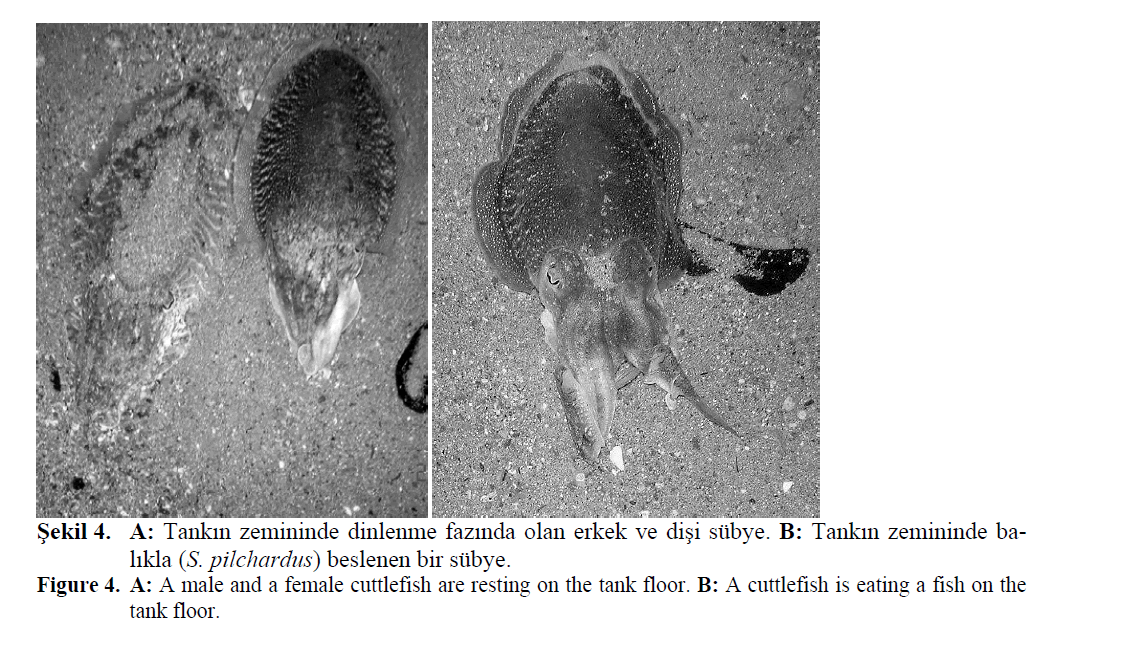
Sübyelerin gün boyu tankın zemininde bulunan
kuma kendilerini gömerek kamufle ettikleri
ve beslenme, yumurtlama ve erkek sübyenin diğer
erkeğe karşı dişiyi koruma ve dişiyi yumurtlamaya
teşvik etme davranışının olduğu zamanlar
hariç, genellikle dinlenme fazında oldukları gözlenmiştir
(Şekil 4 A). Tanka konulan sübyelerin 2
gün içinde yem almaya başladıkları ve 1 hafta
içinde de hepsinin yem aldığı gözlenmiştir. Yumurtlama
evresinde olan sübyelerin genel olarak
yeme karşı isteksiz olmalarına rağmen, verilen
yemleri canlı veya cansız olarak ayırmaksızın hem tentakülleri ile hem de kolları ile yakalayarak
tankın zemininde sakin bir şekilde (yüzmeksizin)
yedikleri tespit edilmiştir (Şekil 4 B). Sübyelere
bütün olarak verilen taze cansız ve canlı
balıkların kafası hariç vücutlarının tamamı tüketilmiştir.
Canlı tekelerin tamamının tüketildiği
tespit edilirken, taze cansız ve canlı yengeçlerin
kıskaçları, bacakları ve karapaksları yenmemiştir.
Şekil 4. A: Tankın zemininde dinlenme fazında olan erkek ve dişi sübye. B: Tankın zemininde balıkla
(S. pilchardus) beslenen bir sübye.
Figure 4: A: A male and a female cuttlefish are resting on the tank floor. B: A cuttlefish is eating a fish on the
tank floor.
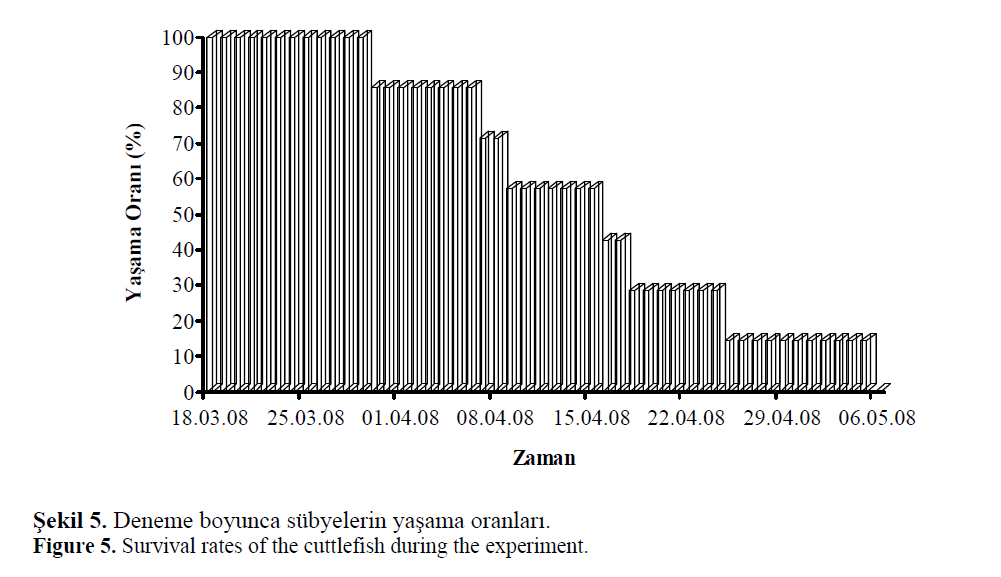
Deneme süresince üstü herhangi bir materyalle
kapatılmamış olan tanktan dışarı atlama vakası
gözlenmemiştir. Tankta ilk ölüm
30.03.2008’ de bir erkek bireyle başlamıştır ve
06.05.2008 tarihinde son dişi bireyin ölümüne
kadar değişen aralıklarla devam etmiştir (Şekil
5). Öldükten sonra gonadlarına bakılarak cinsiyet
tespiti yapılan bir erkek ve bir dişi sübyenin kafa
ve kolları tamamen yenmiştir, ancak ölüm sebeplerinin
tam olarak kanibalizmden olup olmadığı
anlaşılamamıştır. Diğerlerinin ise yumurtlamayı
takiben öldükleri tespit edilmiştir. Ölmek
üzere bulunan bireylerin su sathına yakın pasif
yüzer konumda oldukları, renk değiştirme kabiliyetlerini
yitirerek vücutlarının beyaz ağırlıklı,
sarı ve kahverengi parçalı desenlerde kaldığı,
tentaküllerini geri çekemedikleri ve aşağıya
doğru sarkıttıkları gözlenmiştir. Bu durumda bulunan
bireylerin yaklaşık 2-4 saat içerisinde öldükleri
saptanmıştır.
Şekil 5. Deneme boyunca sübyelerin yaşama oranları.
Figure 5: Survival rates of the cuttlefish during the experiment.
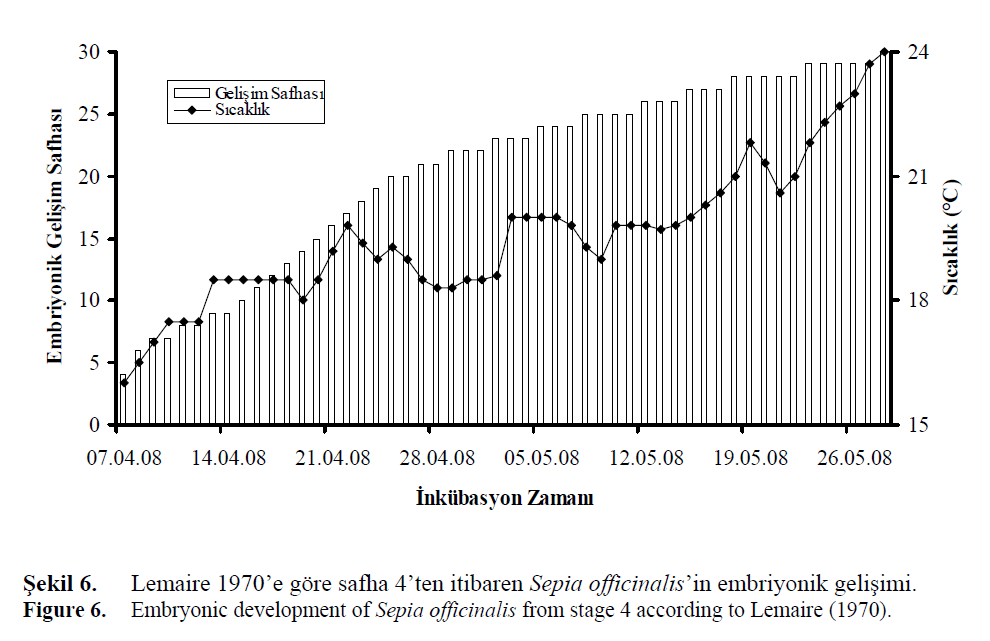
Sübye yumurtaları, 19.6 ±1.7°C su sıcaklığında,
hücre bölünme safhasını (safha 1–9,
Lemaire, 1970; safha I, Naef, 1928) 8 günde,
gastrulasyon evresini (safha 10–17, Lemaire,
1970; safha II-VIII, Naef, 1928) 8 günde ve
organogenes (organların oluşumu ve yumurtadan
çıkış) evresini (safha 18–30, Lemaire, 1970;
safha XIX-XX, Naef, 1928) 36 günde tamamlamışlardır.
Embriyonik gelişim toplam 52 gün
sürmüştür (Şekil 6). Embriyonik gelişim serisi
içinde gözün renklenmesi ile paralel dorsal mantonun
ön ucunda ve her iki yarısında birer soluk
turuncu renkte kromatoforun oluşumu ilk kez
safha 23 (Lemaire, 1970); safha XII (Naef,
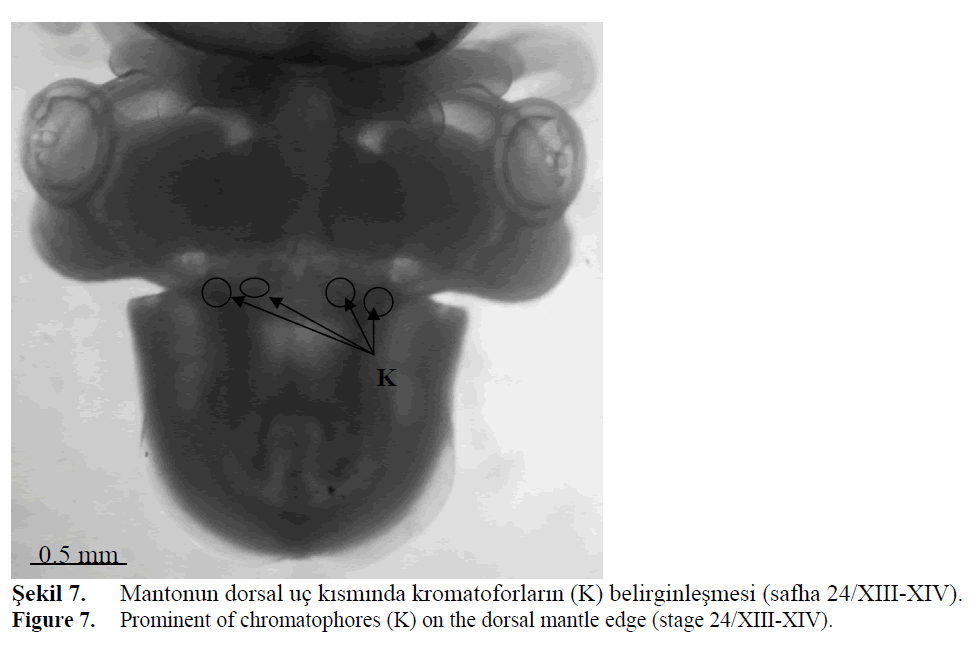
1928)’de tanımlanmıştır. Safha 24 (XIII)’te
dorsal mantonun ön uçlarında 2-3 adet (toplam 4-
6 adet) soluk turuncu renkte kromatofor belirgin hale gelir (Şekil 7). Kafanın ventralinde ve yüzgeçlerde
ilk kromatoforlar safha 28 (XVIIIXIV)’
de görülebilmektedir. Sifon organının sol
lateral yüzeyinde bir sıra 5–6 adet turuncu-kestane
renginde kromatofor ilk kez safha 28+
(XVIII-XIX)’da tespit edilmiştir. Safha 29
(XIX)’da huni organının özellikle sağ ve sol
lateralleri olmak üzere ventralinde kromatoforların
sayısında artış kolaylıkla görülebilmektedir ve
tüm vücuttaki kromatoforlar aktiftir.
Şekil 6. Lemaire 1970’e göre safha 4’ten itibaren Sepia officinalis’in embriyonik gelişimi.
Figure 6: Embryonic development of Sepia officinalis from stage 4 according to Lemaire (1970).
Şekil 7. Mantonun dorsal uç kısmında kromatoforların (K) belirginleşmesi (safha 24/XIII-XIV).
Figure 7: Prominent of chromatophores (K) on the dorsal mantle edge (stage 24/XIII-XIV).
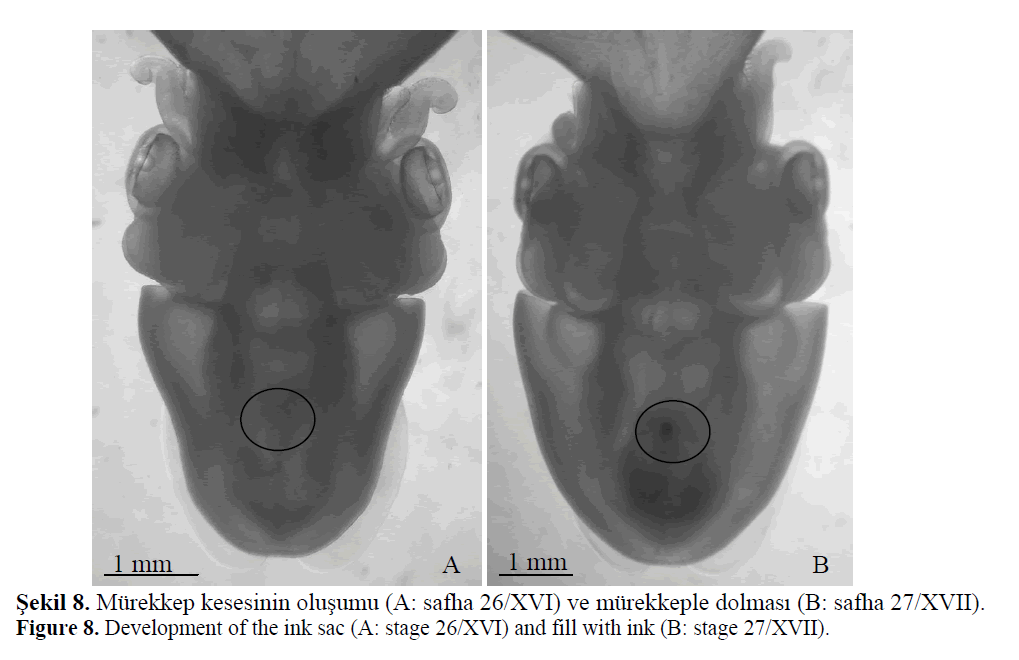
Ayrıca, safha 26 (XVI)’da oluşan mürekkep
kesesi, sübye kemiğinde ilk odacığın oluşumuna
paralel olarak safha 27 (XVII)’de mürekkeple
dolmaya başlar (Şekil 8). Safha 28 (XVIII)’de
%50’den fazlası dolan mürekkep kesesi aktif hale
gelir. Safha 29 (XIX)’da mürekkep kesesinin
%100’ünün dolu ve aktif olduğu tespit edilmiştir.
Şekil 8. Mürekkep kesesinin oluşumu (A: safha 26/XVI) ve mürekkeple dolması (B: safha 27/XVII).
Figure 8: Development of the ink sac (A: stage 26/XVI) and fill with ink (B: stage 27/XVII).
Yumurtaların embriyonik gelişimi tamamlaması
ve paralarvaların yumurtadan çıkışı, 21.8
±1.7°C su sıcaklığında toplam 45 gün sürmüştür.
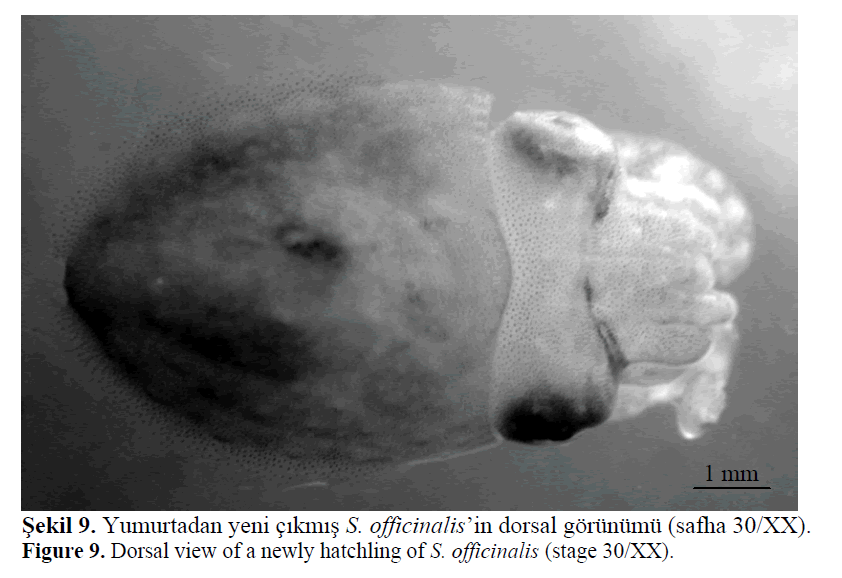
Dorsal manto boyları 5-6 mm olan üreme özelliği
hariç her şeyi ile ergin sübyeye benzeyen
paralarvaların (yumurtadan yeni çıkmış sübye
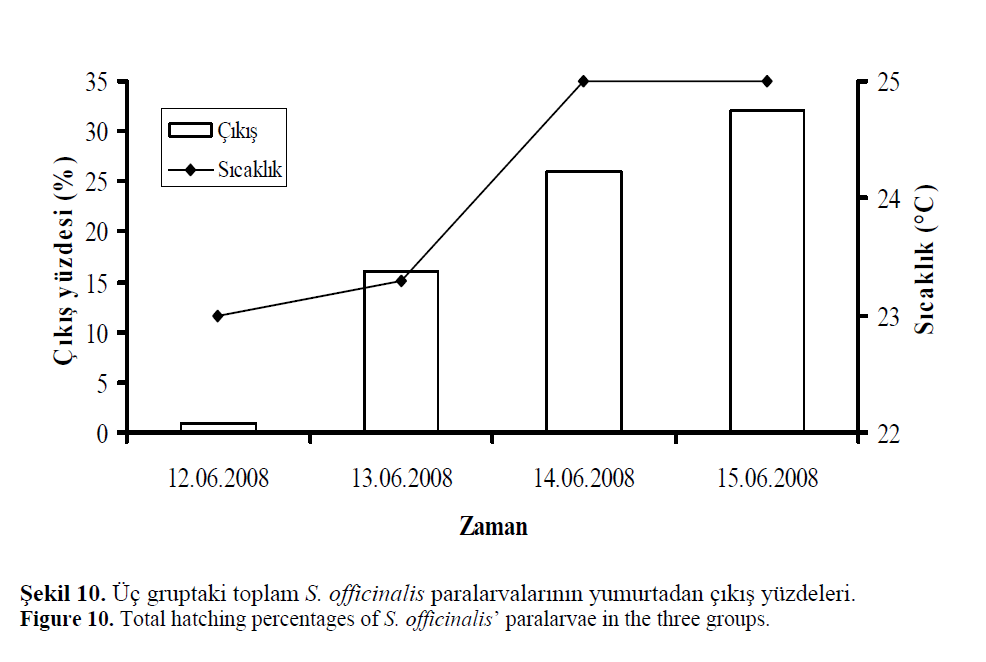
yavruları) yumurtadan çıkışı 2–4 gün sürmüştür
(Şekil 9–10). Ortalama yumurta açılım başarısı
%78.1 ±6.3 olarak hesaplanmıştır. Deneme boyunca
prematüre çıkış gözlenmemiştir.
Şekil 9. Yumurtadan yeni çıkmış S. officinalis’in dorsal görünümü (safha 30/XX)..
Figure 9: Dorsal view of a newly hatchling of S. officinalis (stage 30/XX).
Şekil 10. Üç gruptaki toplam S. officinalis paralarvalarının yumurtadan çıkış yüzdeleri.
Figure 10: Total hatching percentages of S. officinalis’ paralarvae in the three groups.
Sübyeler aralıklı dönemlerde (kesikli) yumurtlama
özelliğine sahip canlılardır (Boletzky,
1987a). Bu yüzden şimdiki çalışmada da ergin
sübyelerin yumurtlaması, 17.4 ±1.1°C su sıcaklığında,
46 günlük bir dönemde aralıklı olarak 32
kez gerçekleşmiş ve yumurtlamayı takiben sübye
ölümleri gözlemlenmiştir. Toplam fekondite hesaplanamamıştır.
Çünkü bireyler üreme döneminde
doğadan yakalanmışlardır ve doğadayken
muhtemelen yumurtlamış olabileceklerinden dolayı
bu konuyla ilgili yorumdan özellikle kaçınılmıştır.
Ancak sübyelerin 500–2000 adet yumurta
yumurtlayabildikleri bilinmektedir
(Mangold-Wirz, 1963). Bu çalışmada gözlenen
ergin erkek sübyenin dişiyi diğer bir erkeğe karşı
koruma davranışı, daha önce Tinbergen (1939),
Hanlon ve Messenger (1988) ve Adamo ve
Hanlon (1996) tarafından da gözlenmiştir. Bu
davranış “agonistic behavior” olarak tanımlanmıştır.
Ergin erkeğin “zebra deseni” ne bürünmesiyle
tanımlanan karakteristik siyah beyaz çizgili
vücut desenine sahip olmasıyla ayırt edilir ve savunmada
olan veya yaklaşmak isteyen erkek dördüncü
kolunu diğer bireye doğru uzatır. Bu davranışın
iki sebebi olduğu düşülmektedir; a) diğer
erkeğe kendinin de bir erkek olduğunu göstererek
gözdağı vermek ve b) çiftleşme döneminde dişinin
diğer erkekle çiftleşmesini engelleyerek kendi spermlerinin yumurtaları döllemesini garanti altına
almak. Şimdiki çalışmada gözlenen davranış
daha çok ikinci sebebi kapsar görünmektedir.
Yumurta büyüklüğü materyale tutunma kısmı
hariç maksimum 2.5–3 cm boy ve 1.2–1.4 cm en
(ortalama 2 cm boy ve 1 cm en) olarak bildirilmiştir
(Jecklin, 1934). Bu araştırmada elde edilen
ortalama yumurta büyüklüğü, bildirilen ortalama
değerden küçüktür. Bu farkın sebepleri yumurtlayan
sübyelerin büyüklüğü ve bölgesel
ekomorfolojik faklılıklar olarak düşünülmektedir.
Kafadanbacaklılarda embriyonik gelişim süresi
sıcaklığa göre değişkenlik gösterir; sıcaklık
arttıkça süre kısalır, sıcaklık düştükçe süre uzar
(Boletzky, 1983,1987b,2003; Boletzky vd., 2006;
Şen, 2004,2005). Sübyenin embriyonik gelişimi
20°C’de 40-45 gün, 15°C’de 80-90 gün sürebilir
(Boletzky, 1983). Mangold- Wirz (1963) bu sürenin
21.4°C’de 31 gün, 18.4°C’de 47 gün,
17.2°C’de 52 gün, 15.9°C’de 69 gün ve 15°C’de
87 gün olduğunu bildirmiştir. Domingues ve diğerleri
(2003b), 16.6 ±1.2°C’de bu sürenin 48
gün ve 18.8 ±0.8°C’de 34 gün olduğunu rapor
etmiştir. Sykes ve diğerleri (basımda), 21.7
±0.9°C’de embriyonik gelişimin laboratuarda yetiştirilen
sübyelerden elde edilen yumurtaları için
25 gün ve doğadan elde edilen anaçlardan temin edilen yumurtalar için 30 gün sürdüğünü belirtmiştir.
Şimdiki çalışmada elde edilen embriyonik
gelişim süreleri, sıcaklıklar göz önüne alındığında
araştırmacıların bildirdiklerinden daha
uzundur.
Genel olarak kafadanbacaklı embriyolarının
gelişiminde önemli kriterlerden biri olan ilk kromatofor
oluşumu sübye için Naef (1928) tarafından
safha XIV-XV/25 ve Lemaire (1970) tarafından
safha 26/XV- XVI olarak tanımlanmıştır. Bu
çalışmada ise ilk kromatoforun oluşumu bildirilen
safhalardan daha erken safhada (safha 23/XII)
tanımlanmıştır. Ayrıca yine ilk kez sifon organı
üzerindeki kromatofor oluşumu ve kromatoforların
aktivasyon safhası bu çalışmada tanımlanmıştır.
Kafadanbacaklı embriyolarının gelişiminde
diğer önemli bir kıstasta mürekkep kesesinin oluşumu
ve mürekkeple dolmasıdır. Sübye için mürekkep
kesesi oluşumunu Naef (1928) safha XVIXVII/
27 ve Lemaire (1970) safha 26/XV-XVI
olarak tanımlamışlardır. Ancak araştırıcılar mürekkep
kesesinin mürekkeple dolduğu ve aktive
olduğu safhaları belirtmemişlerdir. İlk kez bu çalışmada
daha detaylı olarak mürekkep kesesinin
gelişimi incelenmiştir; safha 26/XV-XVI’da
oluştuğu, safha 27/XVI-XVII’de mürekkeple
dolmaya başladığı ve safha 28 (XVIII)’de aktif
hale geldiği tanımlanmıştır.
Forsythe ve diğerleri (1994) yumurtaların
inkübasyon sıcaklığını net olarak belirtmemekle
birlikte yumurta açılımını İngiliz Kanalı’ndan
temin ettiği yumurtalar için %98 ve Fransa kıyılarından
temin ettiği yumurtalar için %47 olarak
vermiştir. Domingues ve diğerleri (2003b) laboratuarda
yetiştirdikleri sübyelerden elde ettikleri
yumurtaların 16.6 ±1.2°C’de açılım oranını %33
ve 18.8 ±0.8°C’de %85 olarak rapor etmişlerdir.
Bildirilen bu değerler şimdiki çalışmada hesaplanan
yumurta açılım oranı (%78.1±6.3) ile uyumlu
bulunmuştur. Sykes ve diğerleri (basımda) laboratuarda
yetiştirilen sübyelerden elde edilen yumurtalardan
yavru çıkışını 5 gün ve doğadan temin
edilerek laboratuarda yumurtlatılan anaçlardan
alınan yumurtalardan yavru çıkışını 2 gün
(sıcaklık 21.7 ±0.9°C) olarak bildirmişlerdir. Bu
veriler şimdiki bulgularla paraleldir.
Sonuç
Doğadan olta ile yakalanan ve canlı olarak tesise
getirilen sübyelerin taşıma ve ellemeye karşı
son derece dayanıklı oldukları, kontrollü koşullara
kolaylıkla adapte olarak yumurtladıkları ve beslendikleri yapılan bu çalışmayla bir kez daha
görülmüştür. Ayrıca, detaylı embriyonik gelişimleri
incelenen sübyenin (S. officinalis) ilk
kromatofor oluşum evreleri ve mürekkep kesesi
gelişimi yeniden tanımlanmıştır.
Kaynaklar
Adamo, S.A., Hanlon, R.T., (1996), do cuttlefish (Cephalopoda) signal their intentions to conspecifics during agonistic encounters? Animal Behavior, 52: 73-81.
Blanc A., Pincznon du Sel G.,Daguzan J., (1999), Relationships between length of prey/predator for the most important prey of the cuttlefish Sepia officinalis L. (Mollusca: Cephalopoda). Malacologia, 41: 139–145.
Boletzky, S.v., (1983). Sepia officinalis, in Boyle P.R.. ed, Cephalopod Life Cycles. Vol. I., 31–52, Academic Press, London, UK.
Boletzky, S.V, Hanlon, R.T., (1983), A Review of the Laboratory Maintenance, Rearing and Culture of Cephalopod Molluscs. Memoirs of the National Museum Victoria, 44: 147– 187.
Boletzky, S.V. (1987a), Fecundity variation in relation to intermittent or chronic spawning in the cuttlefish, Sepia officinalis (Mollusca, Cephalopoda). Buletin of Marine Science, 40: 382–387.
Boletzky, S.V., (1987b), Embryonic phase, in Boyle, P.R. ed Cephalopod Life Cycles, Vol. II., 5–31, Academic Press, London, UK.
Boletzky, S.V., (2003), Biology of early life stages in cephalopod molluscs. Advances in Marine Biology, 44: 143–203.
Boletzky, S.V., Erlwein, B., Hofmann, D.K., (2006), The Sepia egg: a showcase of cephalopod embryology.Vie et Milieu, 56: 191–201.
Boucher-Rodoni R., Boucaud-Camou, E., Mangold, K., (1987), Feeding and digestion, in: Boyle P.R. ed, Cephalopod Life Cycles, Vol. II, 85-108, Academic Press, London, UK.
Castro, B.G., Guerra, A., (1990), The diet of Sepia officinalis (Linnaeus, 1758) and Sepia elegans (Blainville, 1827) (Cephalopoda, Sepioidea) from the Ría de Vigo (NW Spain). Scientia Marina, 54: 375–388.
Castro, B, DiMarco, P., DeRusha, R., Lee, P., (1993), The effects of surimi and pelleted diets on the laboratory survival, growth and feeding rate of the cuttlefish Sepia officinalis L. Experimental Marine Biology and Ecology, 170: 241–252.
Castro, B., Lee, P., (1994), The effects of semipuripied diets on growth and condition of Sepia officinalis L. (Mollusca: Cephalopoda). Comperative Biochemistry and Physioogyl, 109A(4): 1007–1016.
Domingues, P., (1999), Development of alternative diets for the mass culture of the European cuttlefishSepia officinalis. PhD thesis, University of the Algarve, Portugal.
Domingues, P., Kingston, T., Sykes, A., Andrade, J., (2001a), Growth of young cuttlefish, Sepia officinalis (Linnaeus, 1758) at the upper end of the biological distribution temperature range. Aquaculture Research, 32: 923–930.
Domingues, P., Sykes, A., Andrade, J., (2001b), The use of Artemia or mysids as food for hatchlings of the cuttlefish Sepia officinalis Linnaeus, 1758; effects on growth and survival throughout the life cycle. Aquaculture International, 9: 319–331.
Domingues, P., Sykes, A., Andrade, J., (2002), The effects of temperature in the life cycle of two consecutive generations of the cuttlefish Sepia officinalis (Linnaeus, 1758), cultured in the Algarve (South Portugal). Aquaculture Inernational, 10: 207–220.
Domingues, P., Poirier, R., Dickel, L., Almansa, E., Sykes, A., Andrade, P., (2003a), Effects of culture density and live prey on growth and survival of juvenile cuttlefish, Sepia officinalis. Aquaculture International, 11: 225–242.
Domingues, P., Sykes, A., Sommerfield, A., Almansa, E., Lorenzo, A., Andrade, J., (2003b), Effects on feeding live or frozen prey on growth, survival and the life cycle of the cuttlefish Sepia officinalis (Linnaeus, 1758). Aquaculture International, 11: 397– 410.
Domingues, P., DiMarco, F., Andrade, J., Lee, P., (2005), The effects of diets with amino acid supplementation on the survival, growth and body composition of the cuttlefish Sepia officinalis. Aquaculture International, 13(5): 423–440.
Domingues, P.M., Bettencourt, V., Guerra, A., (2006), Growth of Sepia officinalis in captivity and in nature. Vie et Milieu, 56: 109–120
Forsythe, J.W., Van Heukelem, W.F., (1987), Growth, in Boyle P.R. ed, Cephalopod Life Cycles. Vol. 2. 135–155, Academic Press, London, UK.
Forsythe, J., DeRusha, R., Hanlon, R., (1994), Growth, reproduction and life span of Sepia officinalis (Cephalopoda: Mollusca) cultured through seven consecutive generations. Journal of Zoolology London 233: 175–192.
González, A., Rasero, M., Guerra, A., (1996), La explotácion de omastréfidos Illex coindetii y Todarodes eblanae (Mollusca: Cephalopoda) en aguas de Galícia. Nova Acta Científica de Compostela (Bioloxía) 6: 191–201.
Guerra, A., (2006). Ecology of Sepia officinalis. Vie et Milieu, 56: 97–107. Hanlon, R.T., Messenger, J.B., (1988), Adaptive coloration in young cuttlefish (Sepia officinalis L.): the morpholog and development of body patterns and their relation to behavior. Philosophical Transactions of Royal Society London,. Ser. B. 320: 437–487.
Jecklin, L., (1934), Beitrag zur Kenntnis der Laichgallerten und der Biologie der Embryonen decapoder Cephalopoden. RevueSuisse Zooogie, 41: 593–673.
Koueta, N., Boucaud-Camou, E., (1999), Food intake and growth in reared early juvenile cuttlefish Sepia officinalis L. (Mollusca: Cephalopoda). Journal of Experimental Marine Biology and Ecology, 240: 93–109.
Lee, P.G., (1994), Nutrition of cephalopods: fueling the system. Marine and Freshwater Behaviour and Physiology, 25: 35–51.
Lee, P.G., Forsythe, J.W., DiMarco, F.P., DeRusha, R., Hanlon, R.T., (1991), Initial palatability and growth trials on pelleted diets for cephalopods. Buletin of Marine Science, 49: 362–372.
Lee, P., Turk, P., Forsythe, J., DiMarco, F., (1998), Cephalopod culture: physiological, behavioural and environmental requirements. Suisanzoshoku, 46(3): 417– 422.
Lemaire, J., (1970), Table de développement embryonnaire de Sepia officinalis L. (Mollusque Céphalopode). Bulletin de la Société Zoologique de France, 95: 773–782.
Mangold-Wirz, K., (1963), Biologie des cephalopodes bentiques et nectoniques de la mer Catalone. Vie et Milieu, Supp. 13: 1- 285.
Miliou, H., Fintikaki, M., Kountouris, T., Verriopoulos, G., (2005), Combined effects of temperature and body weight on growth and protein utilization of the common octopus Octopus vulgaris. Aquaculture, 249: 245–256.
Naef, A., (1928), Die cephalopoden. fauna flora Golfo Napoli, 35. monogr., part I, vol. 2, 357, 37 pl.(first publ. 1923).
Nixon, M., Mangold, K., (1998), The early life of Sepia officinalis, and the contrast with that of Octopus vulgaris (Cephalopoda). Journal of Zoology, London, 254: 401–425.
Oestmann, D.J., Scimeca, J.W., Forsythe, J.W., Hanlon, R.T., Lee, P.G., (1997), Special considerations for keeping cephalopods in laboratory facilities. Contemporary Topics Laboratory Animal Science, 36: 89– 93.
Pascual, .,E (1978), Crecimiento y alimentacion de tres generaciones de Sepia officinalis en cultivo. Investagaciones Pesqueras, 42(2): 421–442.
Petza, D., Katsanevakis, S., Verriopoulos, G., (2006), Experimental evaluation of the energy balance in Octopus vulgaris, fed ad libitum on a high-lipid diet. Marine Biology, 148: 827–832.
Richard, A., (1971), Contribution a` l’e´tude expe´rimentale de la croissance et de la maturation sexuelle de Sepia officinalis L. (Mollusque, Ce´phalopode). The`se 248, Univ. Lille,
France. Rocha, F., Guerra, A., Prego, R., Piatkowski, U., (1999), Cephalopod paralarvae and upwelling conditions off Galician waters (NW Spain). Journal of Plankton Research, 21: 21–33.
Roper, C.F.E., Sweeney, M.J., Nauen, C.E., (1984), F.A.O. Species Catalogue, Cephalopods on the World. An Annotated and Illustrated Catalogue of Species of Interest to Fisheries, in F.A.O. Fisheries Synopsis, 1–277.
Sánchez, F.J., Iglesias, J., Otero, J.J., (1998), Growth of octopus (Octopus vulgaris) males and females under culture conditions. Aquaculture Europe 98, 3 pp. 330 Bordeaux.
Sykes, A., Domingues, P.M., Correia, M., Andrade, J.P., (2006). Cuttlefish culture – State of the art and future trends. Vie et Milieu, 56: 129–137.
Skyes, A.V., Almansa, E., Lorenzo, A., Andrade, J.P., (in press), Lipid charaqcterization of both wild and cultured eggs of cuttlefish (Sepia officinalis L.) throughout the embryonic development. Aquaculture Nutrition, DOI: 10.1111/j.1365- 2095.2008.00566.x
Sen, H., (2004), Sicakligin kalamar (Loligo vulgaris Lamarck, 1798) yumurtalarinin gelisimine ve inkübasyonuna etkisi. EgeÜniversitesi Su Ürünleri Dergisi, 21(1– 2): 89–92.
Sen, H., (2005), Temperature tolerance of Loliginid squid (Loligo vulgaris Lamarck, 1798) eggs in controlled conditions. Turkish Journal of Fisheries and Aquatic Sciences, 5: 53–56.
Tinbergen, L., (1939), Zur Fortpflanzungsethologie von Sepia officinalis L. Archives Neerlandaises de Zoologie, 3: 323–364.
1465