Keywords
RNAi, gene therapy, gene transfer, prenatal gene therapy
Introducción
Revolucionando el campo de la medicina, la terapia génica se ha convertido en una alternativa cada vez más plausible a los tratamientos convencionales. Básicamente, consiste en la modificación específica de un gen para prevenir o remediar trastornos hereditarios o adquiridos que deriven en una condición patológica para el organismo. Esta técnica se basa en la interferencia, corrección o sustitución del gen defectuoso dentro de las células que expresan la patología por el gen normal y su correcta proteína funcional para enlentecer, estabilizar o revertir el curso de la enfermedad [1]. Se puede llevar a cabo tanto en células somáticas como germinales [2]. En las células germinales la modificación potencialmente puede transmitirse de manera mendeliana de una generación a otra.
La terapia génica ha podido desarrollarse en virtud de que la ciencia ha avanzado en el conocimiento en numerosos campos. Desde el descubrimiento del ADN en el ámbito académico y comercial el avance en el desarrollo y modificación de vectores, el perfeccionamiento de la clonación de genes en el laboratorio y el conocimiento de procesos subcelulares y moleculares que regulan la expresión génica, son pasos que deseamos remarcar desde una perspectiva histórica.
La biología molecular y la terapia génica, amplían el concepto de ADN ya que además de contener la información genética que define a los organismos y condiciona sus respuestas a la incidencia del ambiente, se pueden aislar sus genes, modificarlos y que actúen en tejidos donde la expresión y/o función del producto génico es defectuoso. El ADN en acción trasciende las barreras de las especies y los reinos, mediante la transferencia horizontal del material genético (entre especies diferentes o entre organismos de una misma especie) y su expresión en sistemas heterólogos. Los conceptos de replicación, transcripción y traducción no están enlazados mediante un camino unidireccional (un ejemplo es la retrotranscripción, mediante la cual se puede obtener ADN a partir de ARN), sino conectados por múltiples vías regulatorias. La terapia génica, al afectar la expresión de los genes introduce beneficios y nuevos factores de riesgo en relación a los conocidos tratamientos farmacológicos y quirúrgicos. En este trabajo ofrecemos una actualización de conceptos, avances y proyecciones de la terapia génica.
Perspectiva histórica
La terapia génica no solo es aplicada a ensayos clínicos y modelos de investigación en mamíferos superiores, sino que ya ha sido estudiada en otros seres vivos. Por ejemplo, en la mosca de la fruta Drosophila melanogaster se ha utilizado un elemento transponible, el factor P, para transferir un gen normal codificante de una enzima que produce el color de ojos rojo de tipo salvaje, a embriones que presentaban el gen defectuoso [3]. Las moscas nacidas tenían por lo tanto el color normal de ojos. En lugar de utilizar elementos transponibles en vertebrados, se han empleado retrovirus. El primer caso de transferencia génica se realizó en ratones con bajos niveles de hormona del crecimiento a los que se les incorporó el gen de la hormona de crecimiento de rata [4]. Hoy día el número de publicaciones en el área se ha incrementado notablemente. A partir de un relevamiento realizado para este trabajo en la base de datos de la red Europa de Avances en transferencia y terapia génica (CLINIGENE, European Network for the Advancement of Clinical Gene Transfer and Therapy) [5] se agruparon las publicaciones existentes por tipo de enfermedad explorada, fundamentalmente a través de ensayos clínicos. La figura 1 presenta el resultado de una búsqueda en la literatura científica de ensayos de terapia génica realizados, con el objeto de tratar enfermedades que incluyen desde desórdenes genéticos, metabólicos, neurodegenerativos y cáncer, hasta enfermedades infeccionas, inmunes, cardiovasculares y respiratorias. Se observan las contribuciones de las distintas investigaciones al tratamiento de estos grupos de enfermedades.
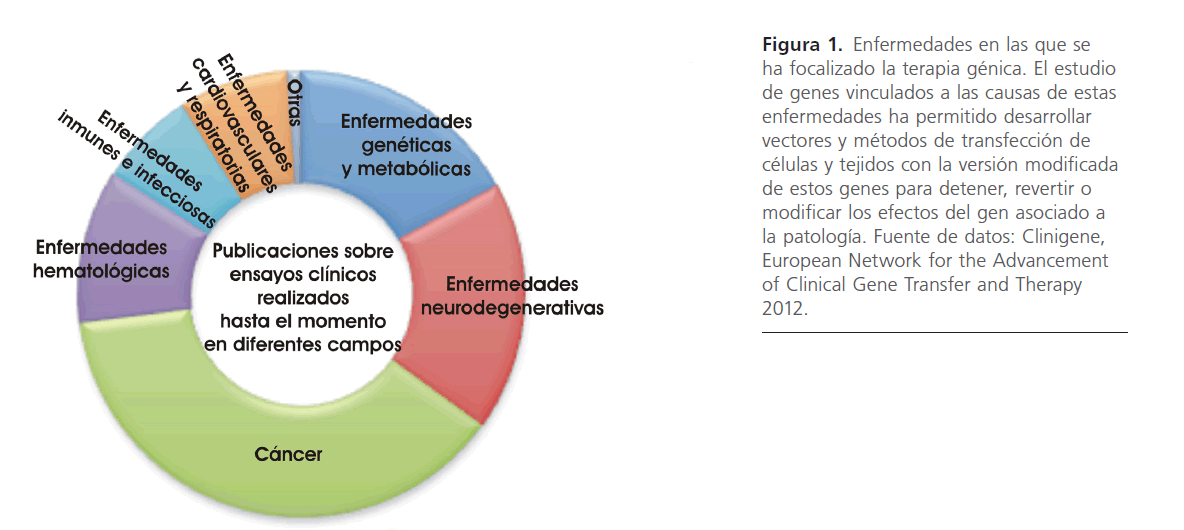
Figura 1: Enfermedades en las que se ha focalizado la terapia génica. El estudio de genes vinculados a las causas de estas enfermedades ha permitido desarrollar vectores y métodos de transfección de células y tejidos con la versión modificada de estos genes para detener, revertir o modificar los efectos del gen asociado a la patología. Fuente de datos: Clinigene, European Network for the Advancement of Clinical Gene Transfer and Therapy 2012.
¿Qué se desea lograr mediante la terapia génica?
Dependiendo del tipo de trastorno, la terapia génica se realiza a través de alguno de los siguientes abordajes [6]:
Adición génica: consiste en introducir una copia correcta del gen funcional para que se produzca en cantidades adecuadas la proteína correspondiente en el tejido a tratar. Es el procedimiento más utilizado.
Corrección génica: se busca corregir el gen alterado sustituyéndolo por el gen correcto mediante recombinación homó loga, aunque por el momento este método es poco eficiente. En su lugar, es posible intercambiar un nucleótido específico mutado, lo que es útil para tratar enfermedades con mutaciones puntuales.
Supresión génica: consiste en anular o reducir la expresión de un determinado gen. Esto se logra mediante el uso de ARNs de interferencia que inducen la degradación o silenciamiento del ARNm blanco.
Terapia génica basada en RNA de interferencia
La regulación génica mediada por ARN de interferencia merece una descripción un poco más detallada porque el conocimiento de este mecanismo se ha incrementado notablemente en los últimos años. La interferencia mediada por ARN (ARNi) consiste en el silenciamiento de la expresión génica a través de ARNs que se unen a una región específica del extremo 3 no traducido del ARNm a silenciar. Primero descrito en gusanos, insectos y plantas como defensa antiviral por parte de las células, luego se encontró también en vertebrados [7-9]. La interferencia mediada por ARN es un complejo proceso de regulación postranscripcional de la expresión génica conocido ampliamente en los organismos eucariontes. El silenciamiento del ARN blanco se asocia al remodelamiento de complejos ribonucleoproteicos específicos en cuerpos de procesamiento intracelular [10-11].
En el marco de la terapia génica, se ha ensayado la aplicación de ARNi mediante diversos vehículos entre los que se cuentan nanopartículas y liposomas. Un reciente trabajo expone la variedad de aplicaciones, ventajas y desventajas [12].
Las investigaciones se han concentrado en degeneración macular [13], cáncer [14, 15] y terapia antiviral, asma, hipercolesterolemia entre otras [16].
Un aspecto a optimizar en los ensayos clínicos con ARNi, ha sido la respuesta sistémica a la liberación localizada del ARNi y el modo de administrarlo en tejidos profundos. Otra limitación de la técnica es el efecto transitorio, ya que la concentración y silenciamiento mediados por ARNi decaen con el tiempo. Esto requeriría aplicaciones repetidas o expresión crónica y regulada del transgén. Un ejemplo de este caso es el uso de ARNi para bloquear la expresión del virus de la hepatitis B (HBV). Mediante estudios en ratones se evaluaron los efectos de la terapia de inhibición del HBV mediada por ARNi. Se utilizaron adenovirus y se logró una supresión sostenida de al menos 120 días luego de la administración del vector [17].
Al tiempo en que se trabaja para superar estos obstáculos, la tecnología de ARNi presenta otro uso potencial: el descubrimiento de nuevos blancos para tratamientos farmacológicos. Con este objetivo, se realizaron ensayos mediante los cuales se transfectan células normales y cancerosas con ARNi y se examina la muerte celular. Así se puede realizar un barrido del genoma (genome wide RNAi screens) y encontrar posibles genes cuya interferencia afecte a las células cancerosas y no a las normales. Si la pérdida de estos genes requeridos por células cancerosas puede ser tolerada en células normales, se podrían convertir en blancos para otras intervenciones [14].
¿Cuál es el vector adecuado para transferir el material genético?
El ADN puede ser administrado directamente por métodos físicos a través de fosfato de calcio, o mediante electroporación, microinyección, biobalística y ultrasonido. Alternativamente se pueden emplear vehículos virales o no virales [18].
Los vectores víricos poseen una mayor eficacia en la transferencia de ADN-ARN, pero son más propensos a generar una respuesta inmune no deseada en el paciente. La integración del gen de interés al vector requiere de la extracción de los genes que le confieren su virulencia incorporándose en su lugar la secuencia deseada. Dentro de los vectores víricos los más utilizados son los retrovirus, adenovirus, virus adenoasociados, lentivirus y virus de herpes simple [19].
Los vectores no víricos son menos efectivos en la transferencia, pero más seguros y más sencillos de elaborar, caracterizar y manipular [18, 20]. Entre los vectores no víricos los plásmidos han sido utilizados en varios ensayos. Los plásmidos son moléculas de ADN circulares doble cadena, presentes en la mayoría de las especies bacterianas, que poseen un gen de resistencia a antibióticos, un origen de replicación, un promotor seguido de la secuencia correspondiente al gen de interés y una señal de poliadenilación necesaria para la exportación del ARNm fuera del núcleo. Algunos plásmidos pueden codificar múltiples proteínas. En comparación con los virus recombinantes, los plásmidos son simples de propagar, más seguros e inducen una respuesta inmunológica más reducida en el paciente [21].
Otros sistemas no víricos son los liposomas, vesículas formadas por una bicapa lipídica catiónica, aniónica o neutral [22]. Los liposomas catiónicos (cargados positivamente) facilitan la unión y encapsulación del ADN cargado negativamente. Estos vehículos admiten gran cantidad de ADN (minicromosomas artificiales), poseen escaso efecto citotóxico y producen una reacción inmunológica reducida. Sin embargo son menos estables y específicos que los vectores virales, ofrecen una expresión transitoria y la eficiencia en la transfección es menor. Para optimizar su uso ha sido preciso incluir componentes estructurales que mimeticen aquellos portados por virus, con el objeto de vencer barreras sistémicas y celulares.
Además de los liposomas, un reciente trabajo mostró el uso de nanopartículas para liberar ARN anti sentido contra el MicroARN- 155 (miR-155), un microARN oncogénico que regula varias vías involucradas en la división celular y la inmuno-regulación. Se encuentra sobreexpresado en numerosos cánceres. La liberación de ácidos nucleicos antisentido encapsulados en un polímero de nanopartículas inhibe a miR-155 en ratones, sugiriendo avances promisorios en la terapéutica de este tipo de cáncer [23].
Cada caso contempla ventajas y desventajas asociadas. Elegir el vector apropiado es una instancia importante. La figura 2 resume información obtenida para este trabajo, a través de un relevamiento de los tipos de vectores virales empleados para un diverso grupo de enfermedades.
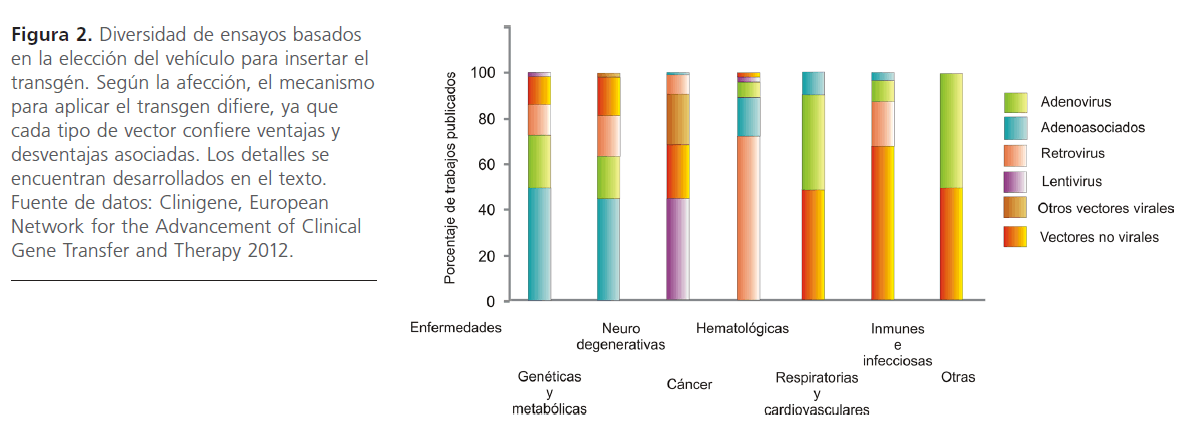
Figura 2: Diversidad de ensayos basados en la elección del vehículo para insertar el transgén. Según la afección, el mecanismo para aplicar el transgen difiere, ya que cada tipo de vector confiere ventajas y desventajas asociadas. Los detalles se encuentran desarrollados en el texto. Fuente de datos: Clinigene, European Network for the Advancement of Clinical Gene Transfer and Therapy 2012.
¿Cómo introducir el ADN recombinante en las células hospedadoras?
Existen dos modalidades para introducir el ADN en las células hospedadoras. Mediante el método ex-vivo se extraen las células del paciente para ser transformadas con el/los gen/es terapéutico/s mediante vectores víricos o no víricos. Luego, se realiza el trasplante autólogo de las células genéticamente modificadas en el paciente. Con esta metodología, la transfe- rencia de genes es más eficiente y se pueden generar grandes cantidades de células transformadas, pero sólo pueden trasplantarse al paciente del que provienen. Este método conlleva un gran costo económico y de calidad ya que constituye una terapia exclusiva, difícil de aplicar manteniendo las condiciones al resto de los pacientes que padecen la enfermedad.
Alternativamente, la terapia génica in-vivo consiste en la administración directa del vector en el paciente mediante infusión intravenosa e inyección estereotáctica. Este método presenta la ventaja de que se puede aplicar a varios pacientes con la misma patología, lo que reduce el costo y la infraestructura necesaria, pero resulta complicado controlar las respuestas a nivel individual y la eficiencia de la incorporación del transgén es mucho menor. El ADN contenido en plásmidos ha sido aplicado mediante este método [24].
La terapia génica y marcaje celular
El marcaje celular consiste en introducir junto con el gen terapéutico, uno o más genes para identificar y seleccionar las células diana que incorporaron el transgén. Por ejemplo, la inclusión de secuencias génicas en células madre hematopoyéticas y linajes sanguíneos maduros para marcar y rastrear su contribución en la hematopoyesis y la función inmune, es uno de los avances de la terapia génica actual. Los marcadores génicos empleados deben ser seguros, no tóxicos, no inmunogénicos y fácilmente monitoreables. Las células marcadas pueden seguirse por análisis de expresión del marcador. Entre los marcadores más utilizados se encuentran el gen que codifica para la resistencia a neomicina (neo) y proteína fluorescente verde (GFP) [25].
¿Qué tipo de enfermedades se tratan o están en vías de ser tratadas mediante terapia génica?
Tal como se menciona líneas arriba, los grupos de enfermedades en los que la terapia génica, tanto a nivel experimental como clínico se ha enfocado, son diversos. Aquí presentamos algunos ejemplos.
Enfermedades genéticas y metabólicas: se han llevado a cabo investigaciones sobre la diabetes y se desarrollaron experimentos mediante los cuales el gen codificante de insulina insertado en un vector retroviral dirigido al hígado en ratones, indujo una mejora en los niveles de glucosa en sangre [26]. Un estudio reciente ha evidenciado que un péptido que tradicionalmente se administra vía subcutánea para controlar la diabetes tipo II, ha sido sobreexpresado en glándulas salivales de ratones mediante un adenovirus asociado, mejorando significativamente el perfil metabólico [27]. Otra enfermedad estudiada es la aterosclerosis. Pacientes con enzimas vitales
defectuosas para el metabolismo lipoproteico, como la lipoproteína y la lipasa hepática, podrían beneficiarse mediante transferencia de los genes que las codifican. Recientemente se ha administrado en ratones el microARN-145, un modulador del músculo liso vascular con el objeto de limitar la morfología y composición de la placa aterosclerótica [28]. También se ha trabajado en el tratamiento de la hipercolesterolemia familiar, una enfermedad genética causada por una mutación en el gen que codifica para el receptor de lipoproteínas de baja densidad (LDL-R) que resulta en niveles de colesterol mayores a 600mg/dl. Los pacientes que padecen la enfermedad presentan una baja respuesta al tratamiento farmacológico. Se han probado protocolos para transferir el gen del LDL-R mediante vectores adenovirales y retrovirales [29].
Trastornos neurodegenerativos: el mal de Alzheimer es un desorden acompañado por la pérdida de la capacidad cognitiva, de la memoria y del resto de las capacidades mentales. La interleucina (IL)-10 es una citoquina anti-inflamatoria utilizada en terapia génica para el tratamiento de la enfermedad de Alzheimer y otros desórdenes relacionados. El gen que codifica para la IL-10 insertado en un virus adenoasociado, reduce la disfunción cognitiva y se estimula la neurogénesis según lo avalan experimentos realizados en modelos animales [30].
Cáncer: la elevada resistencia a la quimioterapia en el tratamiento del cáncer, ha llevado al desarrollo de prácticas inmunoterapéuticas, como el marcado de células T e infusión de estas células modificadas genéticamente en el tumor. Por ejemplo, se han diseñado vectores portadores de un gen suicida para transducir las células T, el cual es activado por la administración de una droga específica relativamente no tóxica. En las fases I y II de los tratamientos clínicos se demostró que este procedimiento es efectivo [31, 32, 33].
Enfermedades hematológicas: un caso dentro de este grupo de enfermedades, es el uso de adenovirus asociado para introducir el gen que codifica para el factor de coagulación IX en pacientes con hemofilia B. Luego de su administración, el factor de coagulación IX se detectó en niveles relevante. Sin embargo, un aspecto a resolver en el futuro es la modulación de la respuesta inmunológica [34].
Afecciones cardiovasculares y respiratorias: se han realizado ensayos para tratar los efectos de la isquemia, producidos por el bloqueo de las arterias ocasionando la falta local de nutrientes y oxígeno en los tejidos. Mediante terapia génica se han insertado en pacientes los genes codificantes del factor de crecimiento angiogénico (VEGF) en sitios afectados por isquemia en el miocardio [35]. Otra afección en la cual se ha enfocado la terapia génica es la trombosis. Existe una gran variedad de genes terapéuticos para el tratamiento an titrombótico. El más estudiado es el gen que codifica para el activador tisular de plasminógeno, por las propiedades anticoagulantes de esta proteína. La sobreexpresión local de este gen promueve la trombólisis en sitios específicos de la arteria y evita los efectos colaterales de los anticoagulantes convencionales [36, 37]. Otro caso es la hipertensión, en la cual un factor clave es el sistema renina-angiotensina, donde la terapia génica se concentra en los genes que regulan su función. Aunque esto todavía debe demostrarse clínicamente, muchas intervenciones fueron empleadas con éxito en modelos animales [36, 37].
Enfermedades infecciosas e inmunes: la inmunodeficiencia combinada severa ligada al cromosoma X es un desorden hereditario producido por la deficiencia de la subunidad γc que compone los receptores de citoquinas, siendo éstos necesarios para el desarrollo de células T y células NK (natural killer). Se ha estudiado la integración y expresión del transgen de γc insertado en un retrovirus transferido a células de médula ósea de niños con esta enfermedad. Los fueron exitosos, con una eficiente transferencia génica y una recuperación de las falencias del sistema inmune [38]. Los efectos adversos observados a lo largo del tiempo se asociaron a desarrollos de leucemias e inestabilidad genómica debidas a mutagénesis insercional y activación de proto-oncogenes [33, 33].
Enfermedades transmitidas a través del ADN mitocondrial: se han llevado a cabo experimentos novedosos para reemplazar el ADN mitocondrial mutado y eliminar la transmisión de enfermedades mitocondriales, mediante la transferencia de complejos cromosómicos asociados a microtúbulos de ovocitos detenidos en metafase II provenientes de mamíferos con defectos en las mitocondrias, a ovocitos de organismos sanos [40, 41]. Esto permite el desarrollo de ovocitos competentes para la fertilización, producción de células totipotenciales y gestación de descendientes sanos. Los experimentos realizados en primates podrían ser aplicados en otros organismos para tratar enfermedades vinculadas a disfunción mitocondrial.
Terapia génica en acción
La Agencia Europea del Medicamento recomendó aprobar la comercialización de un fármaco para tratar una condición hereditaria que provoca deficiencia de la lipoproteína lipasa debido a defectos en el gen que la codifica. Si esta proteína no funciona correctamente o su expresión es reducida, los niveles de grasas en sangre aumentan. El gen que codifica para la lipasa funcional, empaquetado en un virus adenoasociado, se inyecta en las células musculares del paciente, ya que este tejido es el mayor contribuyente a la producción de la enzima [42].
Por otra parte, en China la SFDA (State Food and Drug Administration) ha aprobado la utilización de un vector adenoviral que porta el gen que codifica para p53, una proteína supresora de tumores, en el tratamiento de carcinoma de cabeza y cuello. Estudios multicéntricos desarrollados en fase II y III han mostrado que la combinación de radioterapia y terapia génica condujo a una regresión total del tumor en el 64% de los pacientes tratados y una regresión parcial en el 29% de los casos [43].
Los Estados Unidos, a través del seguimiento de ensayos clínicos de terapia génica mediados por la FDA (Food and Drug Administration), promueven el desarrollo de investigaciones en el área pero aún no se ha aprobado la comercialización de producto alguno para utilizar mediante terapia génica [44].
Terapia génica prenatal
A diferencia de la terapia génica postnatal, la terapia prenatal puede dirigirse con mayor facilidad a una gran población de células indiferenciadas. La liberación temprana del transgén podría minimizar la intolerancia inmunológica y favorecer la aplicación postnatal del vector.
Las enfermedades a tratar incluirían trastornos monogénicos que son letales durante el período perinatal o la infancia temprana y que implican malformaciones estructurales en el feto, en donde el tratamiento antes de nacer representaría una ventaja terapéutica comparado con el tratamiento neonatal o sobre el adulto [45]. Por otra parte, las células del feto son más receptivas a la transducción y se necesitaría menor dosis del producto transgénico puesto que el tamaño de los órganos es menor [46]. Entre las patologías candidatas a ser tratadas se pueden mencionar la hemofilia, hernia diafragmática congénita, talasemia y fibrosis quística [45].
Partiendo de la ventaja que podría ofrecer la terapia génica en esta instancia, sería conveniente que se realizara antes de las 14 semanas de embarazo, porque el sistema inmune del nuevo individuo no está aún desarrollado. Para que esto sea posible, debería pensarse en embarazos programados.
Estudios en animales revelan que ciertos tipos de terapia génica prenatal traen como consecuencia el retraso del crecimiento y desarrollo intrauterino. Lo mismo sucede con ciertos fármacos como el sindenafil, que se administra con el objeto de incrementar el crecimiento fetal como vasodilatador pero que por el contrario, retrasa el crecimiento y potencialmente induce la muerte fetal por vasodilatación amplia e hipotensión materna [47].
Los riesgos potenciales de la terapia génica prenatal incluyen además de lo mencionado líneas arriba, la propagación transplacentaria del vector hacia el organismo materno y la mayor probabilidad de mutagénesis insercional, dado que en el feto abundan factores de crecimiento y genes transcripcionalmente activos que promueven el desarrollo y la diferenciación [48].
Debilidades y riesgos biológicos de la terapia génica
Un problema que se debe resolver es la expresión transitoria del transgén. De manera similar, los fármacos también están expuestos al mismo inconveniente y por ello se aplican en dosis repetidas. La terapia génica busca ambiciosamente sortear este obstáculo logrando una expresión estable y duradera, de manera semejante al estímulo que confieren las vacunas en el organismo.
Por otra parte, respecto de las enfermedades a tratar, por el momento es más factible pensar en los beneficios de la terapia génica para enfermedades monogénicas. Líneas arriba se mencionó el desarrollo de vectores para afecciones como la hipertensión y la aterosclerosis. Pero al tratarse de enfermedades multifactoriales, requerirían el empleo de un cocktail de genes terapéuticos [36].
Otro aspecto importante es lograr una expresión localizada del transgén. Para ello sería necesario diseñar vectores específicos de tejido con sus correspondientes promotores activables y llevar a cabo así una terapia local más eficiente [36]. Además, es importante estudiar la regulación de la expresión del transgén incorporado para evitar consecuencias adversas como la formación de tumores y hallar estrategias para atenuar la respuesta inmune del paciente. Por ejemplo, la terapia génica ex vivo permite seleccionar las células en las que la integración de un transgén ha tenido éxito, antes de re administrarla al paciente.
¿Qué consideraciones quedan por resolver?
Desde una perspectiva global, los avances en terapia génica han permitido a la ciencia y la medicina la capacidad de afrontar desde la modificación del componente genético de los individuos diversas problemáticas, incidiendo de esta manera en el destino evolutivo de la especie. Sin embargo, por un lado, no significa que la naturaleza no haga manipulación genética. Por el contrario, sucede todo el tiempo. Además, los cambios que la naturaleza imponga sobre nuestra constitución genética (a través del azar), no son ni más ni menos perjudiciales que los impuestos mediante la ingeniería genética. Aun así, en última instancia, la naturaleza seleccionará las modificaciones. Pero más allá de la perspectiva holística, la terapia génica con responsabilidad ética está enfocada en la mejora de la calidad de vida de los individuos.
No obstante, la comunidad científica y la sociedad en general necesitan adecuarse a una regulación ética apropiada para el desarrollo de la terapia génica. Hasta el momento, en el campo experimental y tratándose de modelos animales gran parte de esta regulación depende de la autolimitación de los científicos de acuerdo a sus creencias y convicciones. Los interrogantes más polémicos se generan sobre la utilización de la terapia génica prenatal y en la manipulación de células germinativas. En el primer caso se verá afectado el destino de los embriones, mientras que la manipulación de células germinativas incidiría potencialmente en toda su progenie.
En términos comparativos la terapia génica no difiere de otras terapias: altera la constitución genética del individuo como la quimioterapia, la radioterapia, la hemoterapia y el trasplante de órganos. Interfiere en el padecimiento natural de los individuos al igual que las vacunas, transfusiones y suministración de hormonas y otras sustancias químicas y puede modificar la expresión fenotípica con fines no terapéuticos como lo hace la cirugía estética, ortodoncia y otras intervenciones.
Una definición consensuada de “enfermedad también modula el debate sobre la ética de la terapia génica, debido a que no todo defecto génico puede considerarse como enfermedad [45].
Desde aspectos de naturaleza práctica se debe mejorar la relación costo-beneficio en función de poder aplicarla a un gran número de pacientes.
Recientemente, investigadores en Canadá realizaron un análisis sobre la percepción pública de la actividad científica y estudios clínicos en lo concerniente a los avances en terapia génica. Dicho estudio aporta información sobre el conocimiento existente, las expectativas y los interrogantes éticos en torno al desarrollo de la terapia génica [49].
De lo expuesto, se pueden resumir las siguientes consideraciones:
1. La terapia génica utiliza al ADN de manera análoga a los fármacos con el objeto de tratar enfermedades. Esto trasciende la barrera entre especies, porque la terapia génica necesita de vehículos que provean su propia información a las células hospedadoras.
2. Desde el aspecto biológico, debe optimizarse la durabilidad del efecto del transgén, su localización específica y las reacciones del organismo hospedador a la recepción del gen y su vehículo. Deben tenerse en cuenta los efectos epigenéticos, sobre el resultado deseado y las consecuencias colaterales.
3. Desde la perspectiva económica, una vez que los ensayos hayan superado las diversas etapas de análisis, debe es tudiarse el costo para que sea posible su aplicación a un grupo grande de destinatarios.
4. La terapia génica debe sustentarse en una plataforma de reglas éticas que permitan desarrollarla e implementarla con el menor conflicto posible.
Así, se vislumbra un campo promisorio para la ingeniería genética y la biomedicina en el tratamiento de las enfermedades.
Agradecimientos y financiación
Este trabajo ha sido financiado por PIP #318 a Paola Ferrero, CONICET, Argentina y SIB 2010-1011 a Paola Ferrero, UNNOBA, Argentina.
615
References
- Grimm, D., Kay, MA. RNAi and gene therapy: a mutual attraction. Hematology Am SocHematolEduc Program 2007; 473-81.
- Strachan, T., Read, AP. Gene therapy and other molecular genetics-based therapeutic approaches. Chapter 22. 2nd edition. New York: Wiley-Liss. 1999.
- Rubin, GM., Spradling, AC. Genetic transformation of Drosophila with transposable element vectors. Science 1982; 218 (4570): 348-53.
- Hammer, RE., Palmiter, RD., Brinster, RL. Partial correction of murine hereditary growth disorder by germ-line incorporation of a new gene. Nature 1984; 311 (5981): 65-7.
- CLINIGENE. European Network for the Advancement of Clinical Gene Transfer and Therapy. URL: https://www.clinigene.eu/.
- Fillat, C. Perspectivasactuales de la terapiagénica. BSCP Can Ped. 2004; 28: 203-7.
- Fire, A., Xu, S., Montgomery, MK., Kostas, SA., Driver, SE., Mello, CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditiselegans. Nature 1998; 39: 806-11.
- Obbard, DJ.,Jiggins, FM., Halligan, DL., Little, TJ. Natural selection drives extremely rapid evolution in antiviral RNAi genes. Curr Biol. 2006; 16 (6): 580-5.
- Ferrero, PV.,Layana, C., Paulucci, E., Gutiérrez, P., Hernández, G., Rivera-Pomar, RV. Cap binding-independent recruitment of eIF4E to cytoplasmic foci. BiochimBiophysActa. 2012; 1823 (7): 1217-24.
- Layana, C., Ferrero, P., Rivera-Pomar, R. Cytoplasmic Ribonucleoprotein Foci in Eukaryotes: Hotspots of Bio (chemical) Diversity. CompFunct Genomics. 2012.
- Guo, W., Chen, W., Yu, W., Huang, W., Deng, W. Small interfering RNA-based molecular therapy of cancers. Chin J Cancer. 2013.
- Luo, L., Zhang, X., Hirano, Y., Tyagi, P., Barabás, P., Uehara, H. et al. Targeted Intraceptor Nanoparticle Therapy reduces Angiogenesis and Fibrosis in Primate & amp; Murine Macular Degeneration. ACS Nano. 2013.
- Singhania, R., Khairuddin, N., Clarke, D., McMillan, NA. RNA interference for the treatment of papillomavirus disease. Open Virol J. 2012; 6: 204-15.
- Goldberg, MS. siRNA Delivery for the treatment of ovarian cancer. Methods. 2013 (13).
- Kubowicz, P., Zelaszczyk, D., Pekala, E. RNAi in Clinical Studies. Curr Med Chem. 2013.
- Chen, CC., Ko, TM., Ma, HI., Wu, HL., Xiao, X., Li, J. et al. Long term inhibition of hepatitis B virus in transgenic mice by double-stranded adeno-associated virus 8-delivered short hairpin RNA. Gene Ther. 2007; 14 (1): 11-9.
- Li, S., Huang, L. Nonviral gene therapy: promises and challenges. Gene Ther. 2000; 7 (1): 31-4.
- Kay, MA.,Glorioso, JC., Naldini, L. Viral vectors for gene therapy: the art of turning infectious agents into vehicles of therapeutics. Nat Med. 2001; 7 (1): 33-40.
- Niidome, T., Huang, L. Gene therapy progress and prospects: nonviral vectors. Gene Ther. 2002; 9 (24): 1647-52.
- Williams, PD., Kingston, PA. Plasmid-mediated gene therapy for cardiovascular disease. Cardiovascular Research 2011; 91: 565-76.
- Balazs, DA., Godbey, WT. Liposomes for Use in Gene Delivery. Journal of Drug Delivery 2011; 1-12.
- Xu, J., Lu, Y., Ding, F., Zhan, X., Zhu, M., Wang, Z. Reversal of diabetes in mice by intrahepatic injection of bone-derived GFP-murine mesenchymal stem cells infected with the recombinant retrovirus-carrying human insulin gene. World J Surg. 2007; 31 (9): 1872-82.
- Di Pasquale, G., Dicembrini, I., Raimondi, L., Pagano, C., Egan, JM., Cozzi, A. et al. Sustained exendin-4 secretion through gene therapy targeting salivary glands in two different rodent models of obesity/ type 2 diabetes. PLoS One 2012; (7): e40074.
- Lovren, F., Pan, Y., Quan, A., Singh, KK.,Shukla, PC., Gupta, N. et al. MicroRNA-145 Targeted Therapy Reduces Atherosclerosis. Circulation 2012; 126 (11) (Suppl. 1): 81S-90S.
- Kassim, SH., Li, H., Bell, P., Somathanan, S., Lagor, W., Jacobs, F. et al. AAV8 Gene Therapy Leads to Significant Lowering of Plasma Cholesterol Levels in Humanized Mouse Models of Homozygous and Heterozygous Familial Hypercholesterolemia. Hum Gene Ther. 2013; 24 (1): 19-26.
- Kiyota, T., Ingraham, KL., Swan, RJ., Jacobsen, TM., Andrews, SJ., Ikezu, T. AAV serotype 2/1-mediated gene delivery of anti-inflammatory interleukin-10 enhances neurogenesis and cognitive function in APP+PS1 mice. Gene Therapy 2012; 19 (7): 724-33.
- Manno, CS., Pierce, GF.,Arruda, VR., Glader, B., Ragni, M., Rasko, JJ. et al. Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response. Nat Med. 2006; 12 (3): 342-7.
- Shyu, KG., Chang, H., Wang, BW., Kuan, P. Intramuscular vascular endothelial growth factor gene therapy in patients with chronic critical leg ischemia. Am J Med. 2003; 114 (2): 85-92.
- Dishart, KL., Work, LM., Denby, L., Baker, AH. Gene Therapy for Cardiovascular Disease. Journal of Biomedicine and Biotechnology 2003; (2): 138-48.
- Ponder, KP. Systemic Gene Therapy for Cardiovascular Disease. Trens in Cardiovascular medicine 1999; 9 (6): 158-62.
- Hacein-Bey-Abina, S., Le Deist, F., Carlier, F., Bourneaud, C., Hue, C., De Villartay, JP. et al. Sustained correction of X-linked severe combined inmunodeficiency by ex vivo gene therapy. New England Journal of Medicine 2002; 346 (16): 1185-93.
- Hacein-Bey-Abina, S., Hauer, J., Lim, A., Picard, C., Wang, GP., Berry, CC. et al. Efficacy of gene therapy for X-linked severe combined immunodeficiency. N Engl J Med. 2010; 363 (4): 355-64.
- Tachibana, M., Sparman, M., Sritanaudomchai, H., Ma, H., Clepper, L., Woodward, J., Li, Y., Ramsey, C., Kolotushkina, O., Mitalipov, S. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature 2009; 461 (7262): 367-72.
- Tachibana, M., Sparman, M., Mitalipov, S. Chromosome transfer in mature oocytes. Nat Protoc. 2010; 5 (6):1138-47.
- Gaudet, D., Méthot, J., Déry, S., Brisson, D., Essiembre, C., Tremblay, G. et al. Efficacy and long-term safety of alipogenetiparvovec (AAV1- LPLS447X) gene therapy for lipoprotein lipase deficiency: an open-label trial. Gene Ther. 2012.
- David, AL., Waddington, SN. Candidate Diseases for Prenatal Gene Therapy. Coutelle, C., Waddington, SN. (ed.). Prenatal Gene Therapy: Concepts, Methods, and Protocols. Springer Protocols. 2012. pp. 9-39.
- Mattar, CN., Waddington, SN., Biswas, A., Davidoff, AM., Choolani, M., Chan, JK. et al. The case for intrauterine gene therapy.Best Practice & Research Clinical Obstetrics and Gynaecology 2012; 26 (5): 697-709.
- Gaspar, HB., Cooray, S., Gilmour, KC., Parsley, KL., Adams, S., Howe, SJ., Al Ghonaium, A., Bayford, J., Brown, L. et al. Long-term persistence of a polyclonal T cell repertoire after gene therapy for X-linked severe combined immunodeficiency. SciTransl Med. 2011; 3 (97): 97ra79.
- Miller, SL., Loose, JM., Jenkin, G., Wallace, EM. The effects of sildenafil citrate (Viagra) on uterine blood flow and well being in the intrauterine growth-restricted fetus. American Journal Obstetrics Gynaecology 2009; 200 (1): 102e1-7.
- Siders, WM., Shields, J., Kaplan, J., Lukason, J., Woodworth, L., Wadsworth, S. et al. Cytotoxic T Lymphocyte Responses to Transgene Product, Not Adeno-Associated Viral Capsid Protein, Limit Transgene Expression in Mice. Human Gene Therapy 2009; 20 (1): 11-20.
- European Medicines Agency. URL: https://www.ema.europa.eu/ema/ index.jsp?curl=pages/medicines/human/medicines/002145/human_ med_001480.jsp&mid=WC0b01ac058001d124.
- Zhang, SW., Xiao, SW., Liu, CQ., Sun, Y., Su, X., Li, DM., Xu, G., Zhu, GY., Xu, B. Recombinant adenovirus-p53 gene therapy combined with radiotherapy for head and neck squamous-cell carcinoma. ZhonghuaZhong Liu ZaZhi (Chinese journal of oncology) 2005; 27 (7): 426-8.
- FDA. URL: https://www.fda.gov/BiologicsBloodVaccines/ CellularGeneTherapyProducts/.
- Podhajcer, OL.,Boyesen, Mc., Reddie, CE., Pitossi, F., Roubiceck, M. Aspectoséticos de la terapiagénica. Medicina 1998; 58: 228-38.
- Suzuki, D., Knudtson, P. Terapiagénica: la «diferencia moral» entre célulassomáticas y germinales. Madrid: Tecnos. 1991. pp. 160-84.
- Miller, HI. Gene therapy for enhancement. Lancet 1994; 344 (8918): 316-7.
- Mehta, V., Abi-Nader, KN., Carr, D., Wallace, J., Coutelle, C., Waddington, SN., Peebles, D., David, AL. Monitoring for potential adverse effects of prenatal gene therapy: use of large animal models with relevance to human application. Methods Mol Biol. 2012; 891: 291-328.
- Robillard, JM., Whiteley, L., Johnson, TW., Lim, J., Wasserman, WW., Illes, J. Utilizing social media to study information-seeking and ethical issues in gene therapy. J Med Internet Res. 2013; 15 (3): e44.







