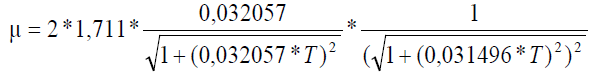Keywords
Hantzschia amphioxys, Growth rates, Half saturation constant, Carrying capacity, Light, Temperature, Nutrient
Giriş
Diyatomeler birçok sucul ekosistemler için fitoplanktonik organizmaların ana bileşenidir. Diyatome türlerinin tanımlanan sayısı 12000 ci-varında (Werner 1977; Gordon ve Drum, 1994; Norton ve ark., 1996) olup; toplam sayının çok daha fazla olduğu düşünülmektedir. Kıyısal alanlarda mikrofitobentoz olarak bilinen bu kommunitenin birçok haliçin gel-git zonlarında yüksek oranlarda yer almaktadır. Bentik diyato-meler total birincil üretimin %50’sine katkıda bulunmaktadır (Perrissinotto ve ark., 2000; Montani ve ark.,2003). Ayrıca azot ve karbonun global biyojeokimyasal döngüsünde diyatomele-rin oldukça önemli olduğu kanıtlanmıştır (Serodio, 2003). Kıyısal sular diyatome bolluğu ile karakterize edilmektedir (Nelson ve ark., 1995). Haliçlerin gel git zonu içinde sedimentin üst tabakasında görünen bentik mikro alglerin dalga ve günlük döngülerle birleşerek dikey göç ritimleri sergilediği bilinmektedir (Round ve Palmer 1966; Joint ve ark.,1982; Paterson, 1986). Sedimentin fotik zonunda hücre konsantrasyo-nunda büyük değişimlere yol açan ritmik dikey hareketler kommunitenin primer üretim hızların-daki değişimlerin nedeni olarak düşünülmektedir. Temporal kıyı sularındaki dalga, rüzgâr tatlı su girişi gibi üst su kolonundaki hidrodinamik ve kimyasal durumlarında kısa dönem değişime ne-den olarak primer üretimin bu zamanda arttığı gözlenmiştir (Fouilland ve ark., 2007). Haliçlerin gel-git zonunda mikrofitobentoz üretimi mevsim-sel, aylık, haftalık ve saatlik olarak değişme özelliğindedir (Shaffer ve Onuf, 1985; Pinckney ve Zingmark, 1991; Smith ve Underwood, 1998; Serodio ve Catarino, 2000).
Mikrofitobentoz grubu nutrient konsantras-yonu, ışık yoğunluğu, tuz ve su sıcaklıkları gibi çevresel faktörlerden etkilenmektedir (Thomas, 1975; Dempster ve Sammerfeld, 1998; Thessen ve ark., 2005). Özellikle mikrofitobentoz türleri-nin yaşadıkları yerden dolayı gel git etkisiyle gün içinde güneş ışığına direk maruz kalmasına ve günlük ısı değişimlerinin çok fazla olmasına karsı dayanıklı türlerdir. Sıcaklığın kısa dönemdeki değişimleri özellikle sıcaklığa bağlı olarak türün fotosentetik kapasitesi olarak adlandırılır. Mikrofitobentoz türleri çok geniş bir sıcaklık aralığında yaşamlarını sürdürebilmektedirler. Mevsimsel olarak farklı sıcaklığa karsı dayanık-lılık gösterme özelliğindedirler. Bu araştırmada optimal sıcaklığın amacı ise H. amphioxys geli-şimi üzerine etkisinin bulunması amaçlanmıştır.
Materyal ve Metot
Şubat 2006- Şubat 2007 tarihleri arasında, İzmir Homa Dalyanı’nda (İzmir Körfezi, Ege Denizi) bazı mikro alglerin büyüme kinetiklerini belirlenmek üzere tek istasyondan nutrient ana-lizleri, fiziko-kimyasal parametreler, biyolojik parametreler araştırılmış H. amphioxys türü izole edilebilmiştir. Hücreler soliter, frustüller isopolardır ve aynı zamanda dorsaventraldir. Valve yüzeyindeki çizgiler düz ve paralel olduğu için hücreler dikdörtgen şekilde görünür. Valveler iki yönlü asimetriktir. Hücrede biri ku-tupta olmak üzere iki kloroplast bulunmaktadır. Hücrelerin uzunluğu 20–100 μm genişliği 5–10 μm’dir. Nutrient zenginleştirme denemeleri ke-sikli kültür tekniği kullanılarak yapılmıştır. İzole edilecek türün kontamine olmasını engellemek amacıyla ve mevcut laboratuvar imkânları göz önüne alınarak, kesikli kültür tekniğinde kullanı-lan havalandırma sistemi kullanılmamıştır. Zen-ginleştirme denemeleri aydınlık periyotta (Ay-dınlık:Karanlık=24:0) gerçekleştirilmiştir. Nutrient zenginleştirme çalışmalarında İzmir kör-fezi Homa Lagünü bölgesinden (38 31’ 10’’kuzey enlemi, 26 49’50’’ doğu boylamı), alı-nan yüzey deniz suyu laboratuvara getirilmiştir. Zenginleştirme denemeleri +/-1°C duyarlıklı sa-bit sıcaklık odası kullanılmıştır. Sabit sıcaklık odası aydınlatılması 40 watt’lık day light floresans lambalarla yapılmıştır. Hazırlanan kül-tür ortamları, 52μmol/m2S sabit ışık şiddetinde aydınlık periyotta inkübe edilerek, üstel faz takip edilmiştir. Işık şiddeti Digital Light Meter Tes 1330 Digital/Light meter Quantum Insturments Photometer ile ölçülmüş ve denemeler süresince ışık şiddeti sabit tutulmuştur. Denemelerde kulla-nılan deniz suyu, yukarıda belirtilen koordinat-lardan alınmış ve laboratuarda 0,2μ’luk kartuş filtreden süzülmüştür. Süzülmüş deniz suyu, ça-lışmalar amacıyla uygun 1 lt’lik cam kaplara ko-nulmadan önce cam kaplar 121 °C sıcaklıkta 1.5 atm basınç altında otoklav edilmek suretiyle ste-rilizasyonları yapılarak çalışmaya hazır hale geti-rilmiştir (Guillard, 1975). Zenginleştirme çalış-maları f/2 ortamıyla yapılmıştır (Guillard, 1975).
Optimum Sıcaklığın Belirlenmesi
Araştırmada kullanılan H. amphioxys türünün optimal sıcaklığının belirlenmesi amacıyla, 7 ayrı sıcaklıkta çalışılmıştır (6°C, 12°C, 15°C, 16.5°C, 18°C, 20°C, 25°C). Araştırma deneme sıcaklık-ları, Homa Dalyanı’nın mevsimsel özellikleri göz önüne alınarak seçilmiştir.
Optimum sıcaklığın belirlenmesi ile optimum ışığın belirlenmesi eş zamanlı olarak yapılmıştır. Ölçümler günlük olarak Turner Design’s 10-AU Flourometre ile yapılmış ve her bir sıcaklık için elde edilen büyüme grafiklerinde exponansiyel faz için (üstel) Eşitlik 1 kullanılarak spesifik bü-yüme hızları hesaplanmıştır (Guillard, 1975).
μ=1/t2-t1)*log2 (N2/N1) (1)
Denklemede,
μ: Spesifik büyüme hızı
N1: Üstel büyüme fazının başlangıcındaki kl-a değeri μg/L
N2: Üstel büyüme fazının sonundaki kl-a değeri, μg/L
t1: N1 değerinin ölçüldüğü zaman dilimi
t2: N2 değerinin ölçüldüğü zaman dilimi olarak ifade edilmiştir.
Elde edilen spesifik büyüme hızları ile sıcak-lık arasında en küçük kareler yöntemi ile istatis-tiksel analiz yapılarak maksimum büyüme hızları ve yarı doygunluk katsayıları bulunmuştur (Eşit-lik 2).
Maksimum büyüme hızı ile sıcaklık arsındaki ilişkisi aşağıdaki denklemden bulunmuştur.
Y=2*1,711*((0,032057)*X88/((1+((0,032057)*X88)^2)^0,5))*(1/(((1+(0,031496*X88)^2)^0,5)^2))
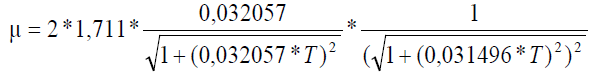
Bulgular ve Tartışma
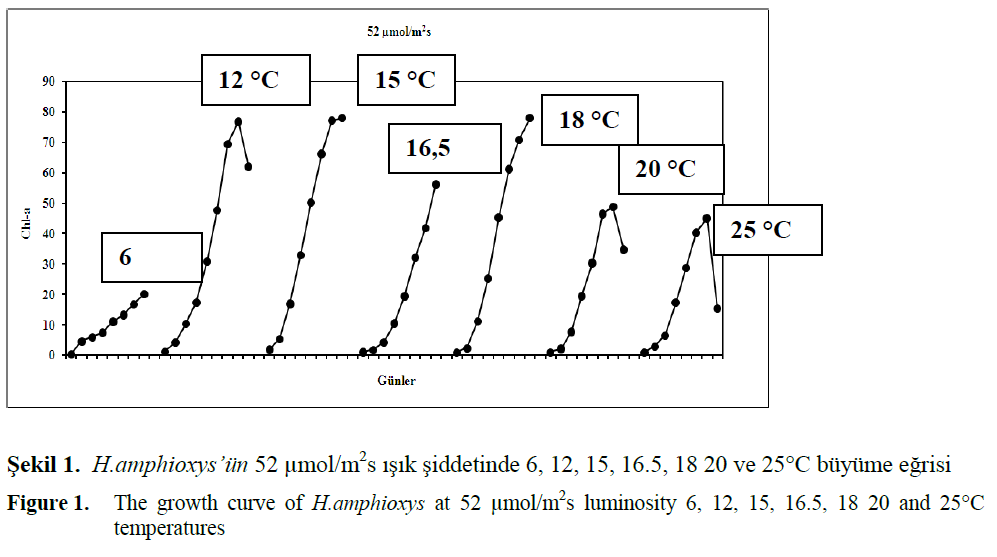
Kesikli kültür sisteminde 6 °C sıcaklığın H. amphioxys gelişimi üzerindeki etkileri araştırıl-mıştır (Sekil 1). 52 μmol/m2s için üstel büyüme fazına 1. günün sonunda ulaşmış ve hücreler 10 katı bir büyüme göstermiştir. Bu ışık şiddeti al-tında hesaplanan spesifik büyüme hızı 0.425 çiftlenme/gün ve üstel fazda ölçülen maksimum kl-a değeri 11.2 μ/L olarak ölçülmüştür. H. amphioxys türünün kesikli kültür sisteminde 12°C sabit ışık şiddetinde türün lag fazına girme-diği ve üstel büyüme fazına geçtiği gözlenmiştir. Bununla beraber her ışık şiddetinde türün yaş-lanma süresinin 8. günde dahil devam ettiği göz-lenmiştir. Spesifik büyüme hızı 0.949 gün-1 ola-rak hesaplanmıştır. Bu ışık şiddetinde üstel bü-yüme fazında ölçülen maksimum kl-a değeri 30.9 μg/L olarak gözlenmiştir. 45, 49, 52 μmol/m2 sa-bit büyüme eğrileri ve eksponansiyel büyüme fazı birbirlerine yakın değerdedir. 15°C’de yapı-lan denemelerden elde edilen büyüme eğrilerini gösteren sonuçlar şekil. 5.4’ de gösterilmektedir. Bu sıcaklıkta 52 μmol/m2s ışık şiddetinde lag faz gözlenmemektedir. Eksponansiyel faz 6. günün sonuna kadar devam etmiştir. Türün çoğalma pe-riyodu boyunca maksimum kl-a değeri 50.2 μg/L olarak ölçülmüştür. Hesaplanan büyüme hızı ise 1.367 çiftlenme/gün olarak bulunmuştur. 6.5°C derecede yapılan denemelerden elde edilen bü-yüme eğrileri sonuçlar Şekil.5.3’ de gösteril-mektedir. 16.5°C sıcaklıkta 52 μmol/m2s ışık şid-detinde üstel fazın 0. günün sonunda bittiği ve üstel büyüme fazında 52 μmol/m2s için 5. güne kadar olduğu görülmektedir (Şekil 1). Bu ışık şiddeti için büyüme fazında ölçülen maksimum kl a değeri 32.2 μg/L’dir. 52 μmol/m2S için he-saplanan spesifik 137 büyüme hızı 0.946 138 çiftlenme/gün olarak hesaplanmıştır. Sıcaklık 18°C’ye çıkarıldığında 52 μmol/m2s ışık şidde-tinde hesaplanan spesifik büyüme hızı 1.711 çiftlenme/gün olarak bulunmuştur. Bu ışık şiddeti için değeri diğer ışık şiddetlerinden daha büyük değere sahiptir. Ayrıca bu türün üstel fazda öl-çülen maksimum kl-a değeri 25.3 μg/L olmuştur (Sekil 1).
Figure 1: The growth curve of H.amphioxys at 52 μmol/m2s luminosity 6, 12, 15, 16.5, 18 20 and 25°C temperatures
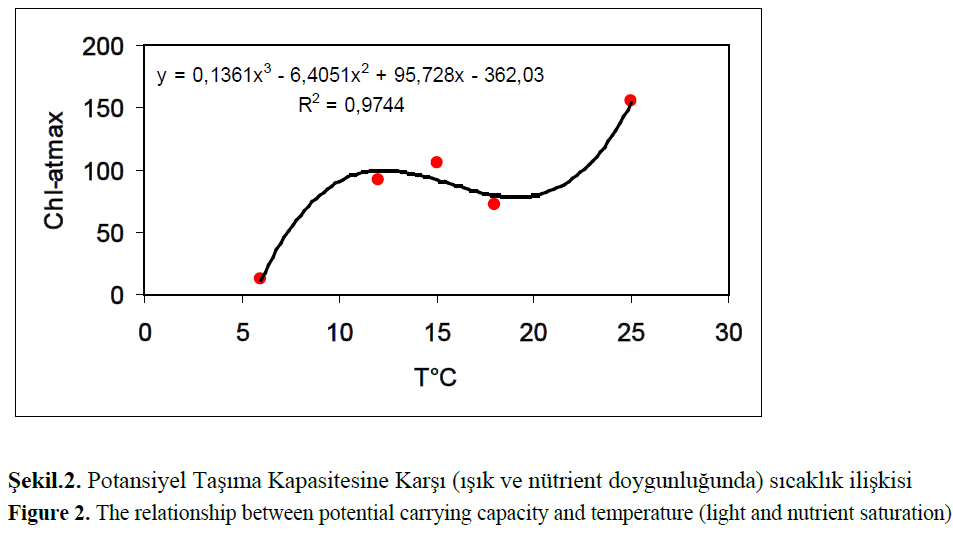
Figure 2: The relationship between potential carrying capacity and temperature (light and nutrient saturation).
Sıcaklık 18°C’ye çıkarıldığında 52 μmol/m2s ışık şiddetinde hesaplanan spesifik büyüme hızı 1.711 çiftlenme/gün olarak bulunmuştur. Bu ışık şiddeti için μ değeri diğer ışık şiddetlerinden daha büyük değere sahiptir. Ayrıca üstel fazda ölçülen maksimum kl-a değeri 25.3 μg/L olmuş-tur.
Sıcaklık 20°C’ ye çıkarıldığında H. amphioxys’ün 52 μmol/m2s ışık şiddetinde lag fazına 0. günün sonunda bittiği üstel faza 1. günde başladığı gözlenmiştir. Bu ışık şiddetinde eksponansiyel fazdaki en yüksek kl-a değeri 19.5 μg/L olarak ölçülmüştür. Hesaplanan spesifik büyüme hızı da 1.333 çiftlenme/gün olarak bu-lunmuştur. Bu sıcaklıktaki maksimum spesifik büyüme hızının değeridir.
Kesikli kültür sisteminde nütrient sınırlı şart-ları altında H.amphioxys’ün en yüksek sıcaklık olan 25°C 52 μmol/m2s ışık şiddetinde hücreler lag fazına girmeden üstel büyümeye geçmişler-dir. Altıncı günün sonunda üstel fazda hesaplanan spesifik büyüme hızı 0.945 çiftlenme/gün mak-simum kl-a değeri 40.3 5 μg/L dir. Lagün suyunun H.amphioxys türünü taşıma kapasitesi sıcaklıkla polinomiyal bir şekilde de-ğişmiştir (Şekil.5.8). 10°C altında azalan sıcak-lıkla erişilen maksimum kl-a değeri hızla azal-mıştır. 10–20 °C arasında sabit olduğu bulun-muştur. 20–25 °C ise tekrar bir artış olduğu sap-tanmıştır.
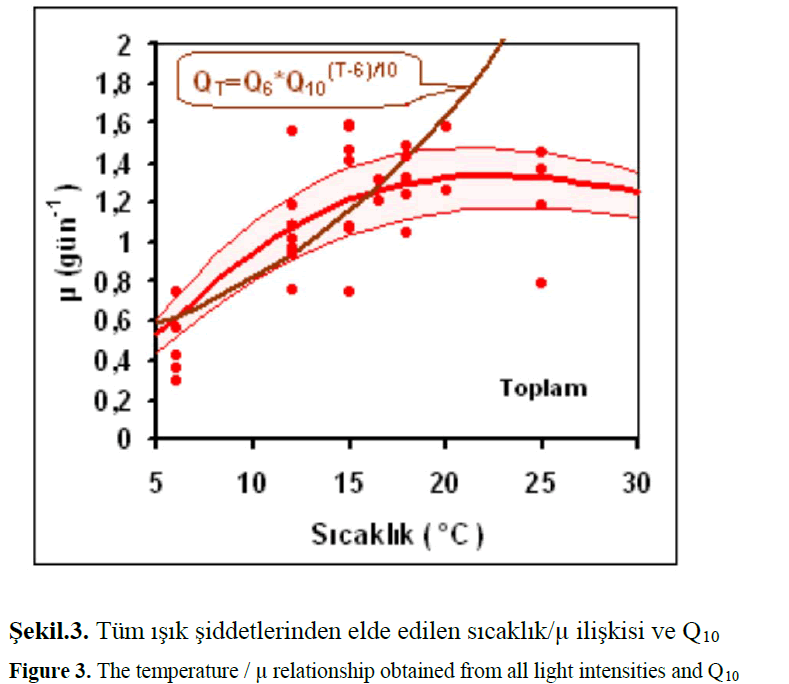
Yukarıdaki grafikle ifade edildi. Q10 ile sıcak-lılığa bağımlılığı ifade etmek istatistik olarak mümkün olmaktadır. Klasik olarak kullanılan Q10 sıcaklık katsayısı 1.995 olarak bulunmuştur. Lite-ratürlerde Skeletonema costatum (Greville) Cleve için Sakshaug (1977) 1.90, Smayda (1973) 2 ve Asterionellopsis glacialis (F. Castracane) F.E. Round için Sakshaug (1977) 2.3 hesaplamışlardır ve bu değerler yaptığımız çalışmadaki diyatome-ler için verilen değerlere yakındır. Fakat ilk denklemde bulunan μmax değerleri 20°C üzerinde Q10 ile bulunan değerden veriye daha iyi uyduğu görülmüştür. Vollenweider (1965)’ın eşitliğin-deki kareköklü 2. terim sıcaklık inhibisyonunu açıklamakta olup, daha doğru sonuçlar vermekte-dir. Şekil 3’deki grafikte Q10' dan hesaplanan bü-yüme hızı değerleri 20°C den sonra gözlenen de-ğerlerden önemli ölçüde sapmıştır.
Figure 3: The temperature / μ relationship obtained from all light intensities and Q10.
Büyüme hızı ile sıcaklık arasındaki ilişkiden 10°C üstündeki sıcaklıkta H. amphioxys’un lagün içerisinde daha iyi gelişim gösterebileceği anla-şılmaktadır. Biyomas olarak 10°C üzerinde lagün suyunun taşıma kapasitesi ≥100 μg/L olup 20°C’den büyük sıcaklıklarda maksimum olacağı anlaşılmaktadır. Seaburg ve ark., (1981) yaptıkları çalışmada türün 5-20°C arasındaki sıcaklıklarda yaşabildiğini belirtmişler ve bu nedenle stenoterm bir tür olarak dikkate almışlar ise de bizim çalışmamızda 6-25°C arasındaki sıcaklık aralığında büyümesi H. amphioxys euriterm bir tür olduğunu düşündürmektedir. Seaburg et al. (1981); çeşitli habitatlardan izole ettikleri antarktik alglerinin 2-34°C aralığında büyüme için denediğini, 75 μE/m2s sabit ışık şartlarında 5-24°C sıcaklıkları arasında H. amphioxys’un büyümediğini rapor etmişlerdir. Aynı araştırıcılara göre, H. amphioxys sıcaklık büyüme aralığı (5-20°C) olarak verilmiş olup bizim elde ettiğimiz veri sıcaklık-büyüme olarak (6–25 °C) bulunmuştur. Bu durum, söz konusu türün daha ılık sulara adapte olabildiğini açıklamaktadır. H. amphioxys, aynı zamanda eurihalin bir tür olarak da belirtilebilir (Fabricius De Martinez et. al., 2003). Tatlı su algleri daha çok stenohalin iken, deniz ve acısu türleri ise eurahalin durumundadır (McIntire, 1978).
Sonuç
Su sıcaklığı onun zamana veya mekana göre değişimi birçok fiziksel ve fizyolojik durumlar için kritik önem taşımaktadır. Sıcaklık bütün bi-yolojik olayların hızlarını kontrol eder. Hayatı imkânsız kılan maksimum ve minimum sınırları vardır. Bu olaylar doğrusunda bentik diyatome-nin büyüme ve çoğalma hızı üzerine sıcaklığın etkisi bulunmuştur. Sonuç olarak, H. amphioxys’un doğal ortamdan izole edilerek ya-pılan bu çalışma ile 6-25°C’de yaşayan euriterm bir tür olduğu gözlenmiştir. Ayrıca doğal fitoplankton tür kompozisyonu yönünde bulunan sonuçlarla sıcaklık aralığı benzer sonuçlar gös-termektedir (Sabancı-Çolak 2008). Ayrıca H. amphioxys’un sıcaklığa bağımlı büyüm denklemi Vollenwieider (1965)’in PP/I (birincil üre-tim/ışık) eğrisi ile parametreler hesaplanarak; Q10 verilerler daha iyi bir uyum içinde oluğu hesap-lanmıştır.
Kaynaklar
Dempster, T.D., Sommerfeld, M.R., (1998). Effects of environmental conditions on growth and lipid accumulation in Nitzschia communis (Bacillariophyceae), Journal of Phycology, 34: 712–21. doi:10.1046/j.1529-8817.1998.340712.x
Fabricius De Martinez, L.A., Maidana, N., Gomez, N., Sabater, S., (2003). Distribution patterns of benthic diatoms in a Pampean river exposed to seasonal floods; the Cuart River (Argentina), Bioversity and Conservation, 12: 2443-2454. doi:10.1023/A:1025857715437
Fouilland, E., Raymond, G.E.L., Ken, J., Slater, J., Calleja, I.A., (2000). The response of a planktonic microbial community to experimental simulations of sudden mixing conditions in temperate coastal water importance of light regime and nutrient enrichment, Journal of Experimental Marine Biology and Ecology, 35:211-225. doi:10.1016/j.jembe.2007.06.030
Gordon, R., Drum, R.W., 1994. The chemical basis of diatom morphogenesis, International Review of Cylology, 150: 243-372.
Guillard, R.R.L.,1973. Culture of phytoplankton for feeding marine invertebrates in: Smith,W.L. and M.H. Chanley (eds). Culture of Marine Invertebrate Animals, Plenum pres, NewYork, NY.
Joint, I., Gee, J.,and Warwick, R., 1982. Determination of fine-scale vertical distribution of microbes and meiofauna in an intertidal sediment, Marine Biology, 72: 157–64.
Mc Intire, D.C., (1978). The distribution of estuarine diatoms along environmental 250 gradients. A conical correlation, Estuarine and Coastal Marine Science, 6: 447-457.
Montani, S., Magni, P., Abe, N., (2003). Seasonal and interannual patterns of intertidal microphytobenthos in combination with laboratory and areal production estimates, Marine Ecology Progress Series, 249: 79-91. doi:10.3354/meps249079
Nelson, D.M., Trequer, P., Brzezinski, M.A., Leynaert, A., Queginer, B., (1995). Production and dissolution of biogenic silica in the ocean, Revised global estimates, comparison with regional data and relationship to biogenic sedimentation. Glo-bal Biogeochem, Cycles, 9: 359–372.
Norton, T.A., Melkonian, M., Andersen, R.A., (1996). Algal biodiversity, Phycologia, 35: 308-326. doi:10.2216/i0031-8884-35-4-308.1
Paterson, D.M., (1986). The migratory behaviour of diatom assemblages in a laboratory tidal micro ecosystem examined by low temperature scanning electron microscopy, Diatom Research, 1: 227–239.
Pinckney, J., Zingmark, R.G., (1991). Effects of tidal stage and sun angles on intertidal benthic microalgae productivity, Marine Ecology Progress Series, 76: 81-89
Round, F.E., Palmer, J.D., (1966). Persistent vertical migration rhythms in benthic micro flora, II. Field and laboratory studies on diatoms from the banks of river Avon, Journal of Marine Biology, 46: 191–214.
Sabancı-Çolak, F., (2008), Homa Dalyanı (izmir Körfezi, Ege Denizi) Intertidal zonunda Epipelik, epifitik ve epilitik diyatome kommunitelerinin taksnomik olarak araştı-rılması ve ortam faktörleriyle ilişkisi E.Ü. Fen Bilim. Ens. Doktora Tezi, İzmir, 211s.
Sakshaug, E., (1977). Limiting nütrients and maximum growth rates for diatoms in Narragansett Bay, Journal Experiment Marine Biology Ecology, 28: 109-123
Seaburg, G.K., Perker, B.C., Wharton, Jr., Simmons, M.G.J., (1981). Temperature-Growth responses of algal isolated from Antarctic Oases, Journal of Phycology, 17: 353–360. doi:10.1111/j.1529-8817.1981.tb00862.x
Serôdio, J., (2003). A chlorophyll fluorescence index to estimate short-term rates of photosynthesisi by intertidal microphyto-benthos, Journal of Phycology, 39: 33-46. doi:10.1046/j.1529-8817.2003.02043.x
Serodio, J., Catarino, F., (2000). Modelling the primary productivity of intertidal microphytobenthos: time scales of variability and effects of migratory rhythms, Marine Ecology Progress Series, 192: 13-30.
Shaffer, G.P., Onuf, C.P., (1985). Reducing the error in estimating annual production of benthic microflora: hourly to monthly rates, patchiness in space an time, Marine Ecology Progress Series, 26: 221–31.
Smayda, T.J., (1997). Harmful blooms: Their ecophysiology and general relevance to phytoplankton blooms in the sea, Limnology and Oceanography, 425: 1137-1153.
Smith, D.J., Underwood, G.J.C., (1998). Expolymer production by intertidal epipelic diatoms, Limnology and Oceanography, 43: 1578–91.
Thessen, A. E., Dortch, Q., Parsons, M. L., Mossion, S., (2005). Effects of salinity on Pseudo-nitzshia species (Bacillariophyceae) growth and distribution, Journal of Phycology, 41: 21-29. doi:10.1111/j.1529-8817.2005.04077.x
Thomas, J.H., (1975). Effects of temperature and illuminance on cell division rates of three species of tropical oceanic phytoplankton, Journal of Phycology, 11: 17-22. doi:10.1111/j.1529-8817.1975.tb04536.x
Vollenweider, R. A. (1965). Calculation models of photosynthesis-depth curves and some implications regarding day rate estimates in primary production measurements, Memorie dell’Istituto Italiano di Idrobiologia, 10: 425-457
Werner, D., (1977). Silicate metabolism, in werner, d.(ed.), The biology of Diatoms, Botanical Monograph, 13: 110–49.
839