Keywords
Frozen fish quality, different thawing methods, protein solubility, SDS-PAGE
Giriş
Su ürünlerinin dondurularak depolanması
en önemli muhafaza yöntemlerinden birisidir.
Ancak, dondurma ve çözündürme işlemleri
esnasında istenmeyen bir çok kalite kayıpları
meydana gelir. Dondurulmuş su ürünlerinde
kalite kaybına neden olan en önemli faktörler
arasında depolama sıcaklığı, dondurma-çözündürmenin
sayısı, sıcaklık dalgalanmaları ve
uygunsuz dondurma-çözündürme işlemleri
verilebilir (Sikorski ve ark., 1976).
Dondurulmuş balığın kas proteinlerinde
geri dönüşümü olmayan değişimler, balığın kas
proteinlerinin fonksiyonel özelliklerinin bozulmasına,
su tutma kapasitesinin azalmasına
ve balıkta sulu-yumuşak ya da kuru ve sert bir
kas dokusu oluşmasına neden olur. Protein
denatürasyonu olarak bilinen bu değişimler,
yapısal kas proteinlerinin özellikle de
myofibrillar proteinlerin çökelmesi/indirgenmesi
sonucu ortaya çıkar. Proteinlerin çökelmesi/
indirgenmesi, disülfit, hidrojen ve
hidrofobik bağlarla proteinlerde dicerler,
trimerler ve yüksek moleküler ağırlıklı polimerlerin
oluşması veya kısım-kısım çökelmesi
ile oluşur. Dondurulmuş balıklarda yapılan
çoğu çalışma, protein-protein kros-linklerle
olduğu gibi (Sikorksi, 1978; Del Mazo ve ark.,
1999; Jasra ve ark., 2001), protein-lipit
interaksiyonuyla da (Haard, 1992; Saeed ve
ark., 1999; Saeed ve Howell, 2002) balık kas
proteinlerinin polimerleştiğini veya bölündüğünü
göstermiştir. Kontraktil proteinler içerisinde
myosin ağır zinciri (MHC), M-protein,
tropomyosin ve Troponin I, C en fazla
denatürasyona uğrayan proteinler olduğu fakat
bu oluşumların balık türlerine bağlı olarak değiştiği
belirtilmektedir (Benjakul ve Bauer,
2000).
Genellikle, doğal kas yapısı hidrojen bağları,
dipole-dipole interaksiyonu, elektrostatik
interaksiyonlar ve disülfit linkleri içeren bir
çok kuvvet tarafından stabildirler. Proteinler,
kuvvetlerin stabilitesinin bozulması ile
denatüre olabilirler ve bu durum dondurma
çözündürme döngüsü gibi sıcaklığın uygunsuz
bir şekilde kullanılması ile artabilir (Wagner ve
Anon 1985; Benjakul ve Bauer, 2000). Çözündürme
genellikle dondurmadan çok daha yavaş oluşur ve dondurulmuş ürünün tekstürel yapısına
zarar verir (Nott ve ark., 1999; Zhu ve
ark., 2004). Çözündürme metotlarının duyusal
analiz kadar membran integresinde önemli rol
oynadığı ve hızlı çözündürmenin yavaş çözündürmeye
oranla daha iyi sonuç verdiği bulunmuştur
(Nilsson ve Ekstrand, 1994;1995).
Mol ve ark. (2004), farklı çözündürme
yöntemlerinin (su içerisinde, oda sıcaklığında
ve buzdolabı sıcaklığında) dondurulmuş uskumruların
(Scomber scombrus) kalitesini
önemli bir şekilde değiştirmediğini bulmuşlardır.
Yapılan araştırmalara göre en iyi çözündürme
ile ilgili genel ve geçerli bir bilgi verebilmenin
mümkün olmadığı belirtilmektedir
(Baygar ve ark., 2004). García-Arias ve ark.
(2003) taze ve dondurulmuş sardalyaların buzdolabında
+4°C’ de veya mikrodalgada çözündürdükten
sonra ızgara yapılması sonucu protein
kalitesinde meydana gelen değişimi incelemişler
ve bunun sonucunda buzdolabında
çözündürmenin protein çözünürlüğünü azalttığını
bulmuşlardır. Balıkların dondurulması,
dondurma-çözündürme döngüsüne ilişkin bir
çok çalışma olmasına rağmen farklı çözündürme
metotlarının balığın protein kalitesine
olan etkisi ile ilgili çok az çalışma bulunabilmiştir.
Bu çalışma ile, dondurarak depolanmış
alabalık ve sardalyada farklı çözündürme şekilleri
sonucu protein kalitesinde meydana
gelen değişimler incelenerek konuya ışık tutulmaya
çalışılmıştır..
Materyal ve Metod
Araştırmada, alabalık (Oncorhynchus
mykiss) ve sardalya (Sardina pilchardus) kullanılmıştır.
Lokal balıkçılardan satın alınan
balıklar buz içinde laboratuvara getirilerek 2
lota ayrılmıştır. Balıkların bir kısmı taze balıktaki
kimyasal parametrelerin belirlenmesi
için ayrılmış diğerleri ise hemen buzdolabı
poşetleri içinde -18°C’ de dondurularak 3 ay
boyunca depolanmıştır. Dondurulmuş balıkların
çözündürülmesinde en fazla uygulanan
çözündürme metotlarından mikrodalgada çözündürme
(180 W), akan su altında çözündürme
ve oda sıcaklığında (24°C) çözündürme
olmak üzere 3 farklı yöntem kullanılmıştır.
Çalışmada kimyasal analizler her bir lota 3
paralel olarak yapılmıştır.
Kimyasal analizler
Balığın başlangıç ve dondurmadan öncekisonraki
tazeliğini belirlemek için toplam uçucu
bazik azot (TVB-N, mg N /100 gr örnek) tayini
Antonocopoulus (1973)’ a göre ve pH
ölçümleri Santos (1981)’ a göre yapılmıştır.
Myofibriller proteinlerin çözünürlüğü Dyer
ve ark. (1950)’ nin yöntemine göre belirlenmiştir.
Bunun için 0.5 gr balık örneği 10 ml 0.6
M NaCl ve 50 mM sodyum fosfat buffer solüsyonunda
ultra-turax kullanılarak 1 dakika
buz içinde homojenize edilmiştir. Örneklerin
ekstraksiyon esnasında oksitlenmesini önlemek
için %0.1 oranında butil-hidroksi-toluen
(BHT) kullanılmıştır. Ekstrakte edilen örnekler
daha sonra 5000 rpm de ve 4 °C’ de 20 dakika
santrifüj edilmiştir. Örneklerdeki protein miktarı
Lowry ve ark. (1951) metoduna göre saptanmıştır.
Protein standardı olarak bovine serum
albümin kullanılmıştır.
Balıkların çözündürülmesi esnasındaki
proteinlerde meydana gelen denatürasyonu
incelemek için, BioRad marka mini vertikal
sodyum dodesil sülfat (SDS)- polyakrilamid jel
elektroforezi (PAGE) kullanılmıştır.
Elektroforez işlemi %10’ luk polyakrilamid jel
ile Laemmli (1970) metoduna göre yapılmıştır.
Jeller, % 0.025 Coomassie Blue R-250, %40
metanol ve %7 asetik asit ile boyanmıştır ve
fazla boya % 5 metanol ve% 7 asetik asit ile 24
saat bekletilerek alınmıştır. Proteinlerin moleküler
kütlesini belirlemek için, myosin (211,24
kDa), β-galaktosidaz (117,76 kDa), bovin serum
albumin (99,81 kDa) ve ovalalbumin
(49,78 kDa) içeren SDS-PAGE standardı
(BioRad-161-0309) kullanılmıştır.
Bulgular ve Tartışma
Farklı çözündürme metotları uygulanan
alabalık ve sardalyanın pH, toplam uçucu bazik
azot (TVB-N, mg/ 100 gr), myofibriller
proteinler ve protein çözünürlüğündeki değişimler
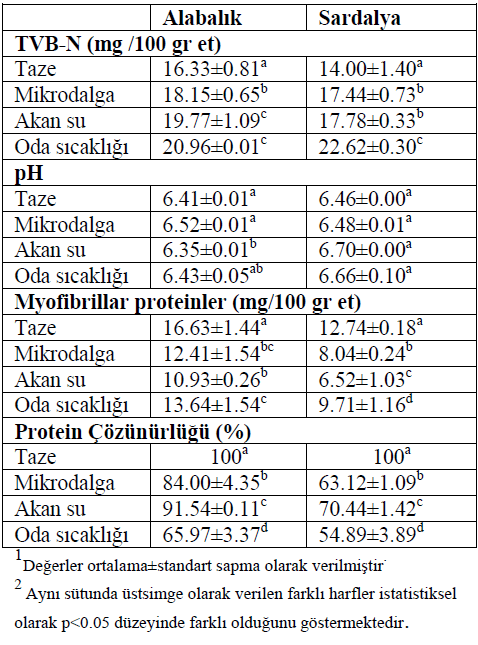
Tablo1 de verilmiştir.
Her iki balık türünde TVB-N düzeylerinin
dondurma-çözündürme işlemleri esnasında
yükseldiği görülmüştür. Oda sıcaklığında çözündürülmüş
alabalık ve sardalyaların TVB-N
düzeylerinin akan su ve mikrodalga ile çözündürülenlerden
daha yüksek olduğu bulunmuştur
(p<0.05). Benzer şekilde, Mol ve ark.
(2004) oda sıcaklığında çözdürülen dondurulmuş
ithal uskumru balıklarının TVB-N düzeylerinin
suda çözdürülenlere göre daha yüksek olduğunu bulmuşlardır. Balıkların TVB-N
düzeyleri taze balık için Avrupa Birliği Kriterlerine
göre belirtilen düzeylerin (35mg/100g
et) altında bulunmuştur (EC, 1995). Buna göre
balıkların dondurma ve çözündürme işlemleri
esnasında tüketilebilirlik sınırını aşamadığı
tespit edilmiştir. Elde edilen verilere göre,
TVB-N miktarının balık türlerine ve çözündürme
şekline göre değiştiği bulunmuştur. Balık
etinde tespit edilen TVB-N değerleri üzerine
başlıca balığın cinsi, avlama mevsimi,
avlama derinliği, avlanma bölgesi, balığın
beslenme durumu, olgunluk derecesi, cinsiyeti
ve yaşı oldukça etkilidir (Oehlenschläger,
1989). Araştırma sonucuna göre, TVB-N düzeyleri
bakımından sardalya için akan su ve
mikrodalga en uygun çözündürme işlemleri
olarak önerilebilir (p<0.05).
Tablo 1.: Farklı çözündürme metotları uygulanan
alabalık ve sardalyanın pH,
TVB-N, myofibriller protein ve protein
çözünürlüğündeki değişimleri1,2 (The changes of pH, TVB-N,
myofibrillar protein and protein
solubility of rainbow trout and
sardine thawed with different
methods).
Sardalya için farklı koşullarda çözündürmenin
pH üzerinde önemli bir etkisinin olmadığı bulunmuştur
(p>0.05). Benzer sonuçlar, dondurulmuş
ithal uskumru balıklarında da bulunmuştur
(Mol ve ark., 2004).
Alabalık ve sardalyada taze balığa göre dondurma
ve çözündürme işlemleri myofibriller
proteinlerin miktarında azalmaya neden olmuştur
(p<0.05). Genel olarak dondurma ve
çözündürme işlemi her iki balık türünde de
protein çözünürlüğünde önemli bir azalmaya
neden olurken (p<0.05), farklı çözündürme
işleminin protein çözünürlüğüne olan azaltıcı
etkisi alabalıkta daha az olmuştur. En yüksek
protein çözünürlüğü, akan su altında çözündürülme
ile sağlanmıştır. Benjakul ve Bauer
(2000), dondurma ve çözündürme işlemi sırasında
morinada meydana gelen protein çözünürlüğündeki
azalmanın proteinlerin denatüre
olmasından kaynaklandığını öne sürmektedirler.
Dondurma ve çözündürme işlemi sırasında
meydana gelen bu denatürasyonun balığın
tekstürel yapısında önemli değişimlere
neden olduğu belirtilmektedir (Ang ve
Hultin,1989; Ragnarrsson ve Regenstein,
1989). García-Arias ve ark. (2003) buzdolabında
çözündürülen sardalya filetolarının protein
çözünürlüğünün azaldığı fakat mikrodalgada
arttığını bulmuşlardır. Bu sonuca göre,
genel olarak farklı çözündürme işlemlerinin
balığın proteinlerinde çok önemli değişimlere
neden olmadığı vurgulanmaktadır. Buna rağmen,
Tejada ve ark. (1985) dondurulmuş
sardalya balığında protein çözünürlüğünde
önemli bir azalma meydana geldiğini ve bunun
nedeninin stabil kovalent bağların oluşmasından
kaynaklandığını belirtmektedirler.
Srinivasan ve ark. (1997) mikrodalganın daha
hızlı çözündürmeye neden olduğu fakat protein
denatürasyonuna sebep olduğu ve büyük karidesler
için arzu edilmeyen bir çözündürme
metodu olduğunu belirtmişlerdir.
Figure 1: Distribution of electrophoretic protein
profile of rainbow trout and sardine
thawed with different methods based on
molecular weights (MW; molecular
weight, kDa; kilo Dalton, Sa; sardine,
Al; trout).
Bu çalışmada, di-sulfit bağları indirgeyen
β-marcaptoethanol ile reaksiyona sokulan örneklerin
SDS-PAGE analizi ile özellikle proteinlerde
di-sulfit ve non-disulfit kovalent
bağlarla meydana gelen protein-protein
interaksiyonu saptanmaya çalışılmıştır (Şekil
1). Buna göre, alabalık ve sardalyanın kas
proteinlerinde farklı çözündürme metotlarının
dikkate değer bir değişim meydana getirmediği tespit edilmiştir. Sadece akan su altında ve oda
sıcaklığındaki bantların yoğunluğunda taze ve
mikrodalgaya göre çok zayıf bir azalma görülmektedir.
Taze balıkla tüm çözündürme
işlemleri karşılaştırıldığında dikkate değer bir
değişimin olmaması, çözündürme işleminin
balık proteinleri üzerine çok büyük bir değişime
neden olmadığını göstermektedir. Bantlarda
görülen azalma ise balıklarda belirli molekül
ağırlığına sahip proteinlerin non-disülfit
kovalent bağlarla denatüre olduğunu göstermektedir.
Proteinlerin sadece disülfit bağlarla
değil non-disülfit kovalent bağlarla bağlanarak
da yüksek moleküler ağırlıklı polymerler
oluşturduklarını ve çökelerek proteinlerin
denatürasyonuna yol açtıkları da söylenebilir
(Ragnarsson ve Regenstein, 1989). Ayrıca,
dondurarak depolama sırasında meydana gelen
protein denatürasyonunun protein çözünürlüğünü
azalttığı ve bunun nedeninin disülfit
bağlar ve protein molekülleri arasındaki iyonik
interaksiyonlar olduğu kadar intermoleküler
hidrojen veya hidrofobik bağlarla da oluşabileceği
belirtilmektedir (Matsumoto 1980;
Akahane 1982; Badii ve Howell 2002). Jiang
ve ark. (1987), dondurarak depolama esnasında
protein moleküllerinin –C=O ve –N-H gruplarıyla
olan hidrofilik interaksiyonlarının proteinlerin
denatürasyonuna ve çökelmesine neden
olabileceğini ve bununda protein çözünürlüğünü
ve Ca-ATPase aktivitesini azaltabileceğini
belirtmektedirler. Bunun yanında, proteinlerin
fonksiyonel gruplarının çok doymamış
yağ asitlerinin oksidasyon ürünleriyle olan
reaksiyonlarından da çökelme ve karşı-bağlanma
olabileceği belirtilmektedir (Saeed ve
Howell, 2002). Bu çalışmada, SDS-PAGE
analizi sonucunda protein çözünürlüğündeki
azalmanın disülfit kovalent bağlar sonucu
oluşmadığı, ancak diğer non-disülfit kovalent
bağla ve/veya diğer bağlar ve interaksiyonlarla
oluştuğu söylenebilir.
Sonuç
Farklı çözündürme işlemleri, protein çözünürlüğünde
önemli bir azalmaya neden olmuştur.
Fakat bu azalmanın balığın türüne ve
çözündürme işlemine bağlı olarak değiştiği
bulunmuştur. SDS-PAGE analizi, di-sulfide
kovalent bağlarla herhangi bir denatürasyonun
olmadığını göstermiştir. Bu çalışma sonucunda
elde edilen verilere göre, protein çözünürlüğündeki
azalmanın ancak non-disülfit
kovalent bağlarla veya proteinlerin diğer bileşiklerle
olan interaksiyonuyla oluşabileceği söylenebilir. Ancak, farklı çözündürme şekillerinin
sebep oluğu denatürasyonun tam olarak
tespiti için daha ayrıntılı çalışmalara gereksinim
vardır.
Kaynaklar
Akahane T. (1982). Freeze denaturation of fish muscle proteins [pHD thesis]. Tokyo: Sophia Univ.
Ang, J. F., Hultin, H. O. (1989). Denaturation of cod myosin during freezing after modifcation with formaldehyd. Journal of Food Science, 54: 814-818
Antonocopoulus, N. (1973). Bestimmung des flüchtigen basenstickstoofs, in: Ludorf, W., Meyer, V, (eds) Fische und Fischerzeugnisse, AuflageVerlag Paul Parey 224-225, Berlin und Hamburg
Badii, F, Howell, N.K. (2002). A comparison of biochemical changes in cod (Gadus morhua) and haddock (Melanogrammus aeglefinus) fillets during frozen storage.
Journal of the Science of Food and Agriculture, 82(1): 87–97.
Baygar, T., Özden, Ö., Üçok, D. (2004). Dondurma ve çözündürme işleminin balık kalitesi üzerine etkisi. Turkish Journal of Veterinary Animal Science, 28: 173-178
Benjakul, S., Bauer, F. (2000). Physicochemical and enzymatic changes of cod muscle proteins subjected to different freze ±thaw cycles. Journal of the Science
of Food and Agriculture, 80: 1143-1150
Del Mazo, M., Torrejon, P., Careche, M., Tejeda, M. (1999). Characteristics of the Salt Soluble Fraction of Hake Fillets Stored at –20 and –300C. Journal of Agricultural and Food Chemistry, 47: 1372-1377
Dyer, W.J., Fench, H.V., Snow, J.M. (1950).Proteins in fish muscle. 1. Extraction of protein fraction in fresh fish. Journal ofFisheries Research Board of Canada, 7:585.
EC (1995). Directive 95/149/EC, Commission decision of 8 March, 1995, fixing the total volatile base nitrogen (TVB-N) limit values for certain categories of fishery products and specifying the analysis methods to be used. Official Journal L 097, 29/04/1995, 0084–0087.M
García-Arias, M.T., Álvarez, E.P., García- Linares, M.C., García-Fernándeza, M.C., Sánchez-Muniz., F.J. (2003). Grilling of sardine fillets. Effects of frozen and thawed modality on their protein quality. Lebensmittel- Wissenschaft und Technologie, 36: 763–769
Haard, N.F. (1992). Biochemical Reactions in Fish Muscle during Frozen Storage, in: E.G. Bligh (Eds), Seafood Science and Tehcnology, Fishing News Boks 176-209, Oxford, UK.
Jasra, S.K., Jasra, P.K., Talesara, C.L. (2001). Myofibrillar protein degradation of carp(Labeo rohita (Hamilton)) muscle after post-mortem unfrozen and frozen storage. Journal of the Science of Food and Agriculture, 1(5): 519-524.
Jiang, S., Hwang,B., Tsao,C. (1987). Effect of adenosine-nucleotides and their derivates on the denaturation of myofibrillar proteins in vitro during frozen storage at -200C. Journal of Food Science, 52(1): 117-123.
Nott, K.P., Evans, S. D. and Hall, L.D., (1999). The effect of freeze-thawing on the magnetic resonance ımaging parameters of cod and mackerel. Lebensmittel-
Wissenschaft und Technologie, 32: 261-268.
Laemmli, U.K., (1970). Cleavage of stuctural proteins during the assembly of the head of bacteriophage T4. Nature, 277: 680-685.
Lowry, O.H., Rosebrough, N.J., Farr, A.L.,Randall, R.J. (1951). Protein measurement with the folin phenol reagent. Journal of Biological Chemistry, 193: 265-275.
Matsumoto, J.J. (1980). Chemical deterioration of muscle proteins during frozen storage,in: Whitaker JR, Fujimoto M, (Eds.), Chemical deterioration of proteins, ACS Symposium Series 123, Washington, D.C
Mol, S., Özden, Ö., Erkan, N., Baygar, T. (2004). İthal uskumruların değişik çözülme koşullarındaki kalite parametrelerinin belirlenmesi. Journal of Veterinary Animal Science, 28: 1071-1077.
Nilsson, K., Ekstrand, B. (1994). Enzyme leakage in muscle tissue of rainbow trout (Oncorhynchus mykiss) related to various thawing treatments. Z. Lebensmittel
Untersuch und Forschung, 198: 253-257.
Nilsson, K., Ekstrand, B., (1995).Frozen storage and thawing methods affect biochemical and sensory attributes of rainbow trout. Journal of Food Science, 60: 627-630.
Nott, K.P., Evans, S. D., Hall, L.D. (1999). The effect of freeze-thawing on the magnetic resonance ımaging parameters of cod and mackerel. Lebensmittel-
Wissenschaft und Technologie, 32: 261-268
Oehlenschläger, J. (1989). Die Gehalte an Flüchtigen Aminen und Trimethylaminoxid in Fangfrischen Rotbarschen aus Verschiedenen Fanggebieten des Nordatlantiks. Archiv für Lebensmittelhygiene, 40: 55-58.
Ragnarrsson, K., Regenstein, J. M. (1989).Changes in electrophoretic patterns of gadoid and non-gadoid muscle during frozen storage. Journal of Food Science,
54: 819-823.
Saeed, S., Fawthrop, S.A., & Howell, N.K. (1999). Electron spin resonance (ESR) study on free radical transfer in fish-protein interaction. Journal of the Science of Food and Agriculture, 79: 1809-1816.
Saeed, S., Howell, N.K. (2002). Effect of lipid oxidation and frozen storage on muscle proteins of Atlantic mackerel (Scomber scombrus). Journal of the Science of Food and Agriculture, 579-586.
Santos, C.L.D., James, D., Teutscher, F. (1981). Guidelines for chilled fish storage experiments. FAO. Fish Tech. Paper 210s.
Sikorski, Z., Olley, J., Kostuch, S. (1976). Protein changes in frozen fish.CRC. Critical Reviews in Food Science and Nutrition, 8: 97–129.
Sikorski, Z.E. (1978). Protein changes in muscle foods due to freezing and frozen storage. International Journal of Refrigeration, 1(3): 173-180.
Srinivasan, S., Xiong, Y.L., Blanchard, S.P. (1997). Effects of freezing and thawing methods and storage time on thermal properties of freshwater prawns (Macrobrachium rosenbergii). Journal of the Science of Food and Agriculture, 75: 37-44.
Tejada, M., Moral, A., Borderias, A. J. (1985). Preservation of sardine mince in the frozen state: mince obtained from whole, headed and eviscerated fish. International Journal of Refrigeration, 8(5): 294–304.
Wagner, J. R., Anon, M. C. (1985). Effect of freezing rate on the denaturation of myofibrillar proteins. Journal of Food Technology, 20: 735-744.
Zhu, S., Ramaswamy, H.S., Simpson, B.K. (2004). Effect of high-pressure versus conventional thawing on color, drip loss and texture of Atlantic salmon frozen by different methods. Lebensmittel- Wissenschaft und Technologie, 37: 291-299.
1674