Keywords
Fish, Formaldehyde, Haematological parameter, Antioxidant parameter
Giriş
Balıklar yaşadıkları ortam nedeniyle doğal olarak birçok enfeksiyonla karşı karşıya kalmak-tadır. Entansif yetiştiricilik yapılan yerlerde ba-lıkların yoğun stoklanması enfeksiyöz hastalıkla-rın büyük bir tehlike oluşturmasına neden olmak-tadır. Bir balıkta başlayan hastalık çok kısa za-manda diğerlerine bulaşmakta ve yayılmaktadır (Ellis, 1988). Bu hastalıklar oluştuktan sonra onu tedavi etmek çok zor olup, uzun ve yorucu bir ça-lışmayı gerektirmektedir. Bu nedenle kültür ba-lıkçılığında hastalıkların çıkmasını ve yayılması-nı önlemek için çeşitli hijyenik ve profilaktif ted-birler alınmakta, farklı dezenfektanlar kullanıl-maktadır. Formaldehit su ürünleri yetiştiriciliğin-de yaygın olarak kullanılan kimyasal bir dezen-fektandır (Tokşen 2004; Balta ve diğ., 2008; Ka-yis ve diğ., 2009; Bulut ve diğ., 2012).
Balıklarda her türlü stres faktörleri, su kalite-sindeki değişimler, kirlilik faktörleri, toksik mad-deler, hastalıklar, beslenme yetersizliği gibi ne-denler balığın direk fizyolojik durumunu etkile-mektedir. Kan, bu konuda iyi bir belirleyici fak-tördür ve organizmada meydana gelen fiziksel ve kimyasal değişiklikleri doğru ve tam olarak yan-sıtmaktadır (Kocabatmaz ve Ekingen, 1982; Cengizler ve Azizoğlu, 2000).
Diğer yüksek omurgalı canlılarda olduğu gibi balıklarda da lipid peroksidasyonun bir ürünü olan malondialdehit (MDA), doymamış yağ asit-lerinin oksidasyonu sonucu oluşur ve hücresel bileşenlerde meydana gelen oksidatif stresin en önemli göstergelerinden biridir (Morales ve diğ., 2004). Bütün aerobik organizmalar gibi balıklar-da da oksidatif stresi ve bunların meydana getir-diği hasarı önlemek için vücutta birçok savunma mekanizmaları mevcuttur. Bunlar antioksidan sa-vunma sistemleri olarak bilinirler ve enzimatik karakterdeki süperoksid dismutaz (SOD), katalaz (CAT), glutatyon peroksidaz (GSH-Px), glutat-yon-S-transferaz (GST) ile enzimatik olmayan redükte glutatyon (GSH), A, E ve C vitamini gibi maddelerdir (Dautremepuits ve diğ., 2003; Tren-zado ve diğ., 2006).
Bu çalışmada, balık hastalıklarının tedavisin-de ve dezenfektan olarak yaygın bir şekilde kul-lanılan formaldehitin gökkuşağı alabalığında bazı hematolojik ve antioksidan parametrelere etkile-rinin ortaya çıkarılması amaçlanmıştır.
Materyal ve Metot
Çalışmada, Elazığ ili Keban ilçesindeki yerel bir işletmeden satın alınan, ortalama ağırlığı 180.35 ± 20.10 g ve ortalama boyu 21.15 ± 1.35 cm olan 72 adet alabalık kullanıldı. Balıklar her bir tekrar için 3, toplamda 9 adet 80 x 75 x 90 cm ebatlarında 540 litrelik fiberglas tanklara eşit sa-yıda stoklandı. Deneysel çalışmaya başlamadan önce balıklar hazırlanmış olan bu tanklara 10 gün süreyle adapte edildi. Adaptasyon süresince ba-lıklara günde iki kere alabildikleri kadar ticari alabalık yemi verildi. Çalışma üç tekrarlı olarak yürütüldü (her bir tekrar için 24, toplamda 72 ba-lık). Çalışma süresince ortalama su sıcaklığı, ok-sijen düzeyi ve pH sırasıyla 14.9oC, 8.1 mg/L ve 7.6 olarak ölçüldü.
Balıklara formaldehit (CH2O) uygulaması için 40 ve 120 ppm formaldehit içeren 80 x 30 x 25 ebatlarında 6 farklı akvaryum hazırlandı. Bu ak-varyumlarda, 40 ve 120 ppm konsantrasyonların-daki formaldehit balıklara 4 gün boyunca 30 da-kika süreyle banyo yöntemiyle uygulandı. Kon-santrasyonlar her formaldehit uygulamasından önce yenilendi. Akvaryumlarda formaldehit uy-gulanan balıklar tekrar fiberglas tanklara aktarıl-dı. Kontrol grubu balıklarına ise herhangi bir uy-gulama yapılmadı. Formaldehit uygulaması için doz ve süre seçimi Treves-Brown (2000)' a göre yapıldı.
Son formaldehit uygulamasından 24 saat son-ra kontrol ve deneme grubu balıkları benzokain kullanılarak anestezi edildi. Anestezi edilen ba-lıkların kuyruk kısımları kaudal pedünkül bölge-sinden kesilerek EDTA' lı tüplere kan örnekleri alındı. Bunu takiben otopsisi yapılan balıkların karaciğer, böbrek ve solungaçları çıkartılarak folyolara sarıldı ve - 40oC' de derin dondurucuda saklandı. Kan örnekleri aynı gün, dokular ise 15 gün içerisinde işlendi.
EDTA' lı tüplere alınan kan örneklerinde he-matokrit (Ht) değer (Konuk, 1981), hemoglobin (Hb) düzeyi (Drabkin, 1946), eritrosit (RBC) ve lökosit (WBC) sayıları (Natt and Herrick, 1952) ile eritrosit indeksleri; ortalama alyuvar hacmi (MCV), ortalama alyuvar hemoglobini (MCH) ve ortalama alyuvar hemoglobin derişimi (MCHC) (Konuk, 1981) belirlendi. Antioksidan parametre-lerin belirlenmesi için ise karaciğer, böbrek ve solungaç örneklerinden doku homojenatları ha-zırlandı. Bunun için doku örnekleri serum fizyo-lojik (% 0,09 NaCl) ile yıkandı. Doku örnekleri-nin iki süzgeç kağıdı arasında suyu alındı ve daha sonra bu örnekler %1.15’lik KCl içinde 1:10 ora-nında sulandırılarak homojenize edildi. Elde edi-len doku homojenatları 50 mL’lik propilen tüp-lerde soğutmalı santrifüjde 3200 rpm’de +4°C’de 10 dakika santrifüj edildikten sonra süpernatant-lar alındı ve malondialdehit (MDA) düzeyi (Pla-cer ve diğ., 1966), glutatyon peroksidaz (GSH-Px) aktivitesi (Beutler, 1975), glutatyon S-transferaz (GST) aktivitesi (Habig ve diğ., 1974) ile redükte glutatyon (GSH) düzeyi (Ellman, 1959) belirlendi. Protein tayini ise Lowry ve diğ. (1951)’nin bildirdiği metoda göre yapıldı.
Denemede elde edilen sonuçların istatistiksel analizleri SPSS 10 paket istatistik programı kul-lanılarak gerçekleştirildi. Kontrol ve deneme grubu balıklarının incelenen parametrelerinde meydana gelen değişimler p<0.05 düzeyinde tek yönlü varyans analizi (ONEWAY–ANOVA) ile test edildi.
Bulgular ve Tartışma
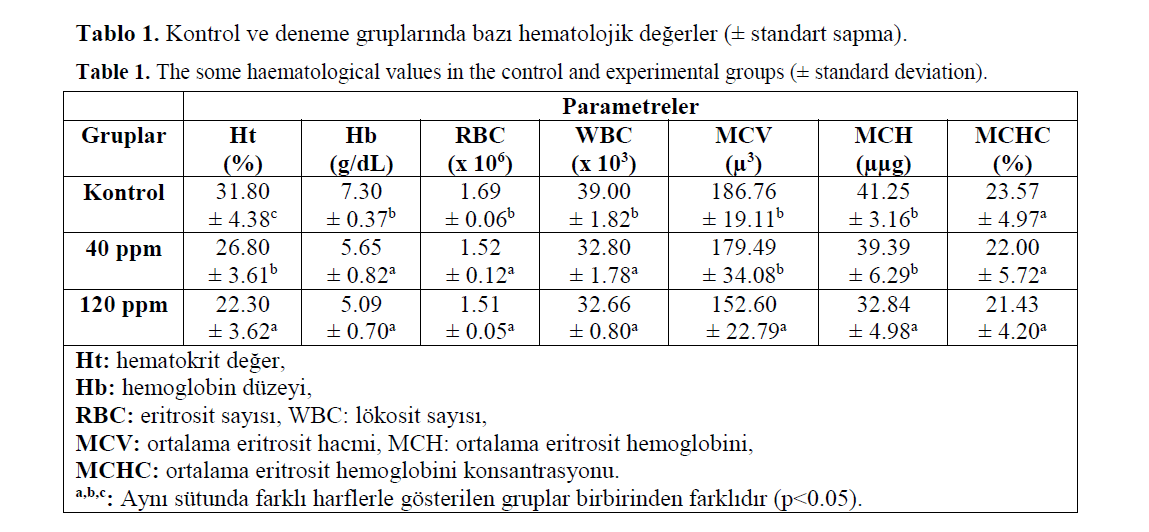
Formaldehitin her iki konsantrasyonunun uy-gulandığı deneme gruplarında kontrol grubuna göre incelenen hematolojik parametrelerin tama-mının azaldığı belirlendi (Tablo 1). Bu azalma tüm parametreler için istatistiksel olarak önemli bulunurken (p<0.05), MCHC değeri için önemsiz bulundu (p>0.05). MCV ve MCH değerlerine gö-re 120 ppm konsantrasyonunda formaldehit uy-gulanan grupta mikrositer hipokrom tipte anemi belirlendi.
Tablo 1. Kontrol ve deneme gruplarında bazı hematolojik değerler (± standart sapma).
Table 1. The some haematological values in the control and experimental groups (± standard deviation).
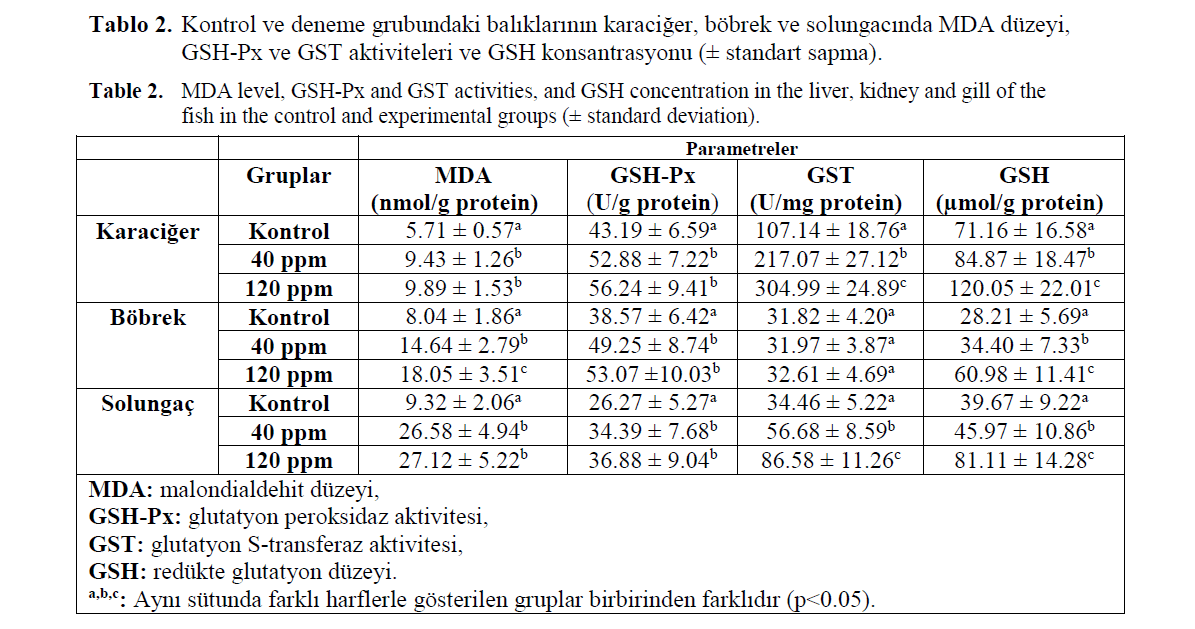
Kontrol grubuna göre formaldehit uygulanan gruplardaki balıkların incelenen tüm dokularında MDA düzeyinin arttığı saptandı (Tablo 2, p<0.05). Karaciğer, böbrek ve solungaç GSH-Px ve GST enzim aktiviteleri ile GSH düzeyinin kontrol grubuna göre deneme gruplarında arttığı belirlenirken, bu artış yalnızca böbrek GST akti-vitesinde istatistiksel olarak önemsiz bulundu (Tablo 2, p>0.05).
Tablo 2. Kontrol ve deneme grubundaki balıklarının karaciğer, böbrek ve solungacında MDA düzeyi, GSH-Px ve GST aktiviteleri ve GSH konsantrasyonu (± standart sapma).
Table 2. MDA level, GSH-Px and GST activities, and GSH concentration in the liver, kidney and gill of the fish in the control and experimental groups (± standard deviation).
Balıklarda hematolojik incelemeler, hastalık-ları tanılamada yardımcı olmaktadır. Diğer taraf-tan kan analizleri balıkların fizyolojik durumları-nın değerlendirilmesinde, beslenme ve çevresel faktörlerin etkilerinin saptanmasında yaralı ol-maktadır (Kocabatmaz ve Ekingen, 1982). Bu ça-lışmada da balıklara formaldehit uygulamasıyla hematolojik değerlerde önemli değişimler elde edilmiştir. Yapılan bir araştırmada, (Bulut, 2010) 60 dakika süreyle 250 mL/L ve 45 dakika süreyle 500 ml/L formaldehit uygulanan gökkuşağı ala-balığında hematokrit ve hemoglobin düzeyleri, eritrosit sayısı ile MCV ve MCHC değerlerinin kontrol grubuna göre istatistiksel olarak önemli düzeyde arttığı belirlenmiş, lökosit sayısı ile ilgili herhangi bir sonuç elde edilememiştir. Diğer bir çalışmada 2.5, 5.0, 7.5, 10.0 ve 12.5 mg/250L' lik formaldehit konsantrasyonları alabalıklara uygu-lanmış, 0., 4., 8., 12., 24. ve 48. saatlerde balık-lardan alınan kan örneklerinde hematokrit düzeyi, hemoglobin miktarı ve retikulosit oranı belirlen-miştir. Sonuçta formaldehit uygulamasıyla hema-tokrit düzeyi ile hemoglobin miktarının doz ve süreye bağlı olarak arttığı saptanmıştır (Bayram, 2008). Deneme grubu balıklarına 40 ve 120 ppm konsantrasyonlarında 48 saat süreyle formaldehit uygulanan bu çalışmada ise kontrol grubuna göre hematokrit ve hemoglobin düzeyleri, eritrosit ve lökosit sayıları ile eritrosit indekslerinde istatis-tiksel olarak önemli azalmalar saptanmıştır. So-nuçlar arasındaki bu farklılık formaldehitin uygu-lanan doz ve süreleriyle açıklanabilir.
Oksidatif stres, oksidan ve antioksidan denge arasındaki değişiklikler sonucunda meydana gelmekte ve reaktif oksijen türleri lehindeki artış-lar oksidatif hasar olarak tanımlanmaktadır. Ser-best radikaller yüksek aktivitelerinden dolayı hücre zarında bulunan doymamış yağ asitleri ile etkileşerek lipit peroksidasyonu başlatabilmekte-dir. Oluşan lipit peroksitler kolaylıkla yıkımlana-rak başta MDA olmak üzere birçok sekonder ürün meydana getirebilmektedir (Bird and Dra-per, 1984; Jain, 1988; Bandyopadhyay ve diğ., 1999). Bu çalışmada kontrol grubuna göre, for-maldehit uygulanan balıkların karaciğer, böbrek ve solungaç dokusunda MDA düzeyinin önemli oranda arttığı tespit edilmiştir. Bu sonuç güçlü bir dezenfektan olan ve yaygın bir şekilde kullanılan kloramin-T' nin gökkuşağı alabalığında MDA düzeyini arttırarak oksidatif strese sebep olduğu-nu belirleyen Tkachenko ve diğ., (2013)' in bul-gularıyla paralel bulunmuştur.
GSH, serbest radikaller ve peroksitlerle reak-siyona girerek hücreleri oksidatif hasara karşı ko-ruyan, endojen ve enzimatik olmayan, çok önem-li tripeptit karakterinde bir antioksidandır. Ayrıca protein yapısındaki sülfhidril gruplarını indir-genmiş halde tutarak pek çok proteinin ve enzi-min inaktivasyonunu engellemektedir (Hayes and McLellan, 1999). GSH-Px, sitozolde yerleşik bir enzim olup tetramer yapıda 4 selenyum atomu içerir ve hidrojen peroksit ile inorganik hidrope-roksitlerin indirgenmesini sağlar (Piner, 2009). GST, GSH ile elektrofilik gruplar taşıyan bileşik-ler arasındaki konjugasyonu katalizleyen, birçok farklı ksenobiyotik ve endojen bileşiklerin detok-sifikasyonu ve biyotransformasyonunda rol oy-nayan, çok fonksiyonlu faz II enzim ailesinin üyeleridir (Hamed ve diğ., 2003). Yonar ve Mişe Yonar (2010), önemli bir dezenfektan olan ve geniş bir şekilde kullanılan malaşit yeşilinin gök-kuşağı alabalığında kan, karaciğer, böbrek, dalak ve solungaç dokusunda CAT aktivitesi ve GSH düzeyini azalttığını bulmuşlardır. Singh ve diğ. (2012) yetiştiricilikte yaygın kullanılan bakır sül-fatın Channa punctatus türü balıkların karaciğer, böbrek ve solungacında CAT enzim aktivitesini önemli düzeyde inhibe ettiğini tespit etmişlerdir. Bu çalışmada ise iki farklı konsantrasyonda for-maldehit uygulanan gökkuşağı alabalığının kara-ciğer, böbrek ve solungaç dokusundaki antioksi-dan parametrelerde artış belirlenmiştir. Bu artış formaldehitin neden olduğu stresi elimine etmek için antioksidanların yüksek aktivite göstermesiy-le açıklanabilir. Diğer taraftan böbrek GST enzim aktivitesinin kontrol grubundan herhangi bir fark-lılık göstermemesi formaldehitin vücuttan tam olarak atılamadığını göstermektedir.
Sonuç
Bu çalışma sonuçlarına göre, formaldehit uy-gulanan balıkların hematokrit seviyesi, eritrosit ve lökosit sayısı, hemoglobin düzeyi, eritrosit in-deksleri gibi bazı kan parametrelerinde önemli azalmalar tespit edilmiştir. Ayrıca formaldehitin balıklarda oksidatif strese neden olduğu belir-lenmiştir. Fakat GSH-Px ve GST enzim aktivite-leri ile GSH düzeyinin artması oksidatif stresin vücut tarafından bertaraf edilmeye çalışıldığının bir işaretidir. Bununla birlikte özellikle böbrek GST enzim aktivitesinde herhangi bir artışın ol-maması formaldehitin vücuttan tam olarak detok-sifiye edilemediğini göstermektedir. Buna bağlı olarak hematolojik parametrelerdeki azalmanın nedeni de balıklar için primer lenfoid organ olan böbrekteki bu detoksifikasyon eksikliği olabilir. Bu sonuç formaldehitin hematopoetik dokuda bi-rikim yaparak etkilediğinin bir işaretidir. Ancak bu değişimlere rağmen deneme süresince balık-larda ölüm gözlenmemiştir. Bu bulgu formaldehi-tin olumsuz etkilerine rağmen dezenfektan olarak ve paraziter hastalıkların tedavisinde güvenle kul-lanılabileceğini göstermektedir.
Kaynaklar
Balta, F., Kayis, S., Altinok, I., (2008). External protozoan parasites in three trout species in the Eastern Black Sea region of the Turkey: intensity, seasonality, and their treatments,
Bulletin of Europen Association Fish Patho-logist,
28(4): 157-162.
Bandyopadhyay, U., Das, D., Banerjee, R.K., (1999). Reactive oxygen species: oxidative damage and pathogenesis,
Current Science,
77: 658-666.
Bayram, H., (2008). GÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâökkusagi Alabaligi’ na (
oncorhynchus mykiss) Uygulanan Formal-dehit Banyosunun Bazi Hematolojik KanParametreleri ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬Åzerine Etkisi. YÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâüksek Lisans Tezi, AtatÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâütÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâürk ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬Åniversitesi Fen Bilimleri EnstitÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâüsÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâü Su ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬ÅrÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâünleri Anabilim Dali, Erzu-rum, 32s.
Beutler, E., (1975). Red cell metabolism. In: A manual of biochemical methods, New York: Grune Strottan, pp. 67-69.
Bird, R.P., Draper, H.H., (1984). Comparative studies of different methods of malondialde-hyde determination,
Methods in Enzymolo-gy,
105: 299-305.
doi: 10.1016/S0076-6879(84)05038-2
Bulut, C., (2010). Bakir SÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâülfat (CuSo4.5H2O) ve formaldehit (CH2O)’ in GÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâökkusagi Ala-baliklarinda (
Oncorhynchus mykiss) His-topatolojik ve Hematolojik Etkilerinin arastirilmasi. YÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâüksek Lisans Tezi, SÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâüleyman Demirel ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬Åniversitesi Fen Bilimleri EnstitÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâüsÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâü Su ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬ÅrÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâünleri Yetistiriciligi Anabilim Dali, Isparta, 95s.
Bulut, C., Kubilay, A., AkÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâçimen, U., Ceylan, M., (2012). Formaldehit (CH2O)’in Farkli Kon-santrasyonlarinin GÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâökkusagi Alabaliklarinda (
Oncorhynchus mykiss) Kortizol, Serum Glikoz ve Lizozim Aktivitesi ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬Åzerine Etkileri,
Journal of FisheriesSciences.com,
6(4): 321-330.
doi: 10.3153/jfscom.akdeniz006
Cengizler, I., Azizoglu, A.S. (2000). Seyhan Ba-raj GÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâölÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâü ve Seyhan nehrinde yasayan aynali sazan (
cyprinus carpio, linnaeus, 1758)’larda bazi kan parametrelerinin belir-lenmesi,
Turkish Journal of Veterinary and Animal Science,
24: 205-214.
Dautremepuits, C., Betoulle, S., Vernet, G., (2003). Stimulation of antioxidant enzymes levels in carp (
Cyprinus carpio L.) infected by
Ptychobothrium sp. (Cestoda),
Fish and Shellfish Immunology,
15: 467-471.
doi: 10.1016/S1050-4648(03)00007-X
Drabkin, D.L., (1946). The crystallographic and optical properties of the hemoglobin of man in comparison with those of other species,
Journal of Biological Chemistry,
64: 703ÃÆÃâÃââÃÆââ¬Å¡Ã¢ââ¬Å¡Ã¬ÃÆââ¬Å¡Ã¢ââ¬Ã
â723.
Ellis, A.E., (1988). General Principles of Fish Vaccination. In: Ellis, A.E. (Ed), Fish Vac-cination. Academic Press Lmt., New York, pp. 1-19.
Ellman, G.L., (1959). Tissue sulphydryl groups,
Archives Biochemistry and Biophysics,
82: 70-77.
doi: 10.1016/0003-9861(59)90090-6
Habig, W.H., Pabst, M.J., Jakoby, W.B., (1974). Glutathione S-transferases. The first enzy-matic step in mercapturic acid formation,
Journal of Biological Chemistry,
249: 7130-7139.
Hamed, R.R., Farid, N.M., Elowa, S.H.F., Abdalla, A.M., (2003). Glutathione related enzyme levels of freshwater fish as bioindi-cators of pollution,
The Environmentalist,
23: 313-322.
doi: 10.1023/B:ENVR.0000031409.09024.cc
Hayes, J.D., McLellan, L.I., (1999). Glutathione and glutathione-dependent enzymes repre-sent a coordinately regulated defence against oxidative stress,
Free Radical Research, 31: 273-300.
doi: 10.1080/10715769900300851
Jain, S.K., (1988). Evidence for membrane lipid peroxidation during the in vivo aging of hu-man erthrocytes,
Biochimica et Biophysica,
937: 205-210.
doi: 10.1016/0005-2736(88)90242-8
Kayis, S., Ozcelep, T., Capkin, E., Altinok, I., (2009). Protozoan and Metazoan Parasites of Cultured Fish in Turkey and their Applied Treatments,
The Israeli Journal of Aquacul-ture ÃÆÃâÃââÃÆââ¬Å¡Ã¢ââ¬Å¡Ã¬ÃÆââ¬Å¡Ã¢ââ¬Ã
â Bamidgeh, 61(2): 93-102.
Kocabatmaz, M., Ekingen, G., (1982). Degisik TÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâür Baliklardan Kan ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ã¢ââ‰â¬Årnegi Alinmasi ve Hematolojik Metotlarin Standardizasyonu. TÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬ÅBITAK Projesi, Proje No: VHAG-557, 72s.
Konuk, T., (1981). Pratik Fizyoloji. Ankara ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬Ån-iversitesi Veteriner FakÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâültesi Yayinlari, No: 314.
Lowry, O.H., Rosenberough, N.J., Farr, A.L., Randal, R.J., (1951). Protein measurement with folinphenol reagent,
Journal of Bio-chemistry,
193: 265-275.
Morales, A.E., PÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâèrez-JimÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâènez, A., Hidalgo, M.C., AbellÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâán, E. and Gabriel C.G., (2004). Oxi-dative stres and antioxidant defenses after prolonged starvation in
Dentex dentex liver,
Comporative Biochemistry and Physiology Part C,
139: 153-161.
doi: 10.1016/j.cca.2004.10.008
Natt, M.P., Herrick, C.A., (1952). New blood diluents for counting the erythrocytes and leukocytes of the chicken,
Poultry Science,
31: 735-738.
doi: 10.3382/ps.0310735
Piner, P., (2009). Lambda-cyhalothrinin
Oreo-chromis niloticus’da Karacigerde Piperonil BÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâütoksit modÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâülatÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâörlÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâügÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâünde Oksidatif Stres Potansiyelinin Belirlenmesi, Stres Pro-teinleri ve Apoptozis ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬Åzerine etkileri. Doktora Tezi, ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ã¢ââ¬Ã¡ukurova ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬Åniversitesi Fen Bilimleri EnstitÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâüsÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâü Biyoloji Anabilim Dali, Adana, 102s.
Placer, Z.A., Cushman, L., Johnson, B.C., (1966). Estimation of products of lipid pe-roxidation (Malonyl dialdehyde) in biologi-cal fluids,
Analytical Biochemistry,
16: 359-364.
doi: 10.1016/0003-2697(66)90167-9
Singh, D., Katiyar, S., Verma, A., (2012). Role of Copper Sulphate on Oxidative and Metabol-ic Enzymes of Freshwater Fish; Channa Punctatus.
Journal of Environmental & Ana-lytical Toxicology, 2(1): 1-5.
doi: 10.4172/2161-0525.1000121
Tkachenko, H., Kurhaluk, N., Grudniewska, J., (2013). Effect of chloramine T exposure on oxidative stress biomarkers and liver bio-chemistry of rainbow trout,
Oncorhynchus mykiss (Walbaum), brown trout,
Salmo salar (L.) and garliyng,
Thymallus thymallus (L.),
Archives of Polish Fisheries,
21: 41-51.
doi: 10.2478/aopf-2013-0005
Toksen, E., (2004). ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ã¢ââ¬Ã¡ipura Yavrularinda (
Sparus aurata L., 1758) GÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡ÃâörÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâülen
Trichodina spp. Enfeksiyonlarina Formaldehit Banyolarinin Etkisi,
Ege ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬Åniversitesi Su ÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâ¦Ã¢â¬ÅrÃÆÃâÃâ ââ¬â¢ÃÆââ¬Å¡Ãâünleri Dergisi,
21(1-2): 31-33.
Trenzado, C., Carmen H.M., Gallego, M.G., Mo-rales, A.E., Furne, M., Domezain, A., Domezain, J. Sanz, A., (2006). Antioxidant enzymes and lipid peroxidation in sturgeon
Acipencer naccarii and trout
Oncorhynchus mykiss. A comparative study,
Aquaculture,
254: 758-767.
doi: 10.1016/j.aquaculture.2005.11.020
Treves-Brown, K.M., (2000). Applied Fish Pharmacology. Kluwer Academic Publisher, London.
doi: 10.1007/978-94-017-0761-9
Yonar, M.E., Mise Yonar, S., (2010). Changes in selected immunological parameters and an-tioxidant status of rainbow trout exposed to malachite green (
Oncorhynchus mykiss, Walbaum, 1792),
Pesticide Biochemistry and Physiology,
97: 19-23.
doi: 10.1016/j.pestbp.2009.11.00950