Key words
Trichinella, Trichinellosis, T. spiralis
Introducción
Las Zoonosis son enfermedades transmisibles entre los animales y el hombre,
cuyo origen conceptual se le atribuye a Rudolf Virchow. [1,2] La triquinelosis fue descrita
por Owen (1835), [3] es una enfermedad parasitaria causada por el nematodo
Trichinella spiralis, infecta el músculo de prácticamente todos los mamíferos, se ha
reportado en casi todo el mundo, su prevalencia es alta en Europa y Asia. La
enfermedad en el ser humano se transmite por la ingesta de carne infectada y sus
productos crudos o mal cocidos, sobre todo de cerdo. [4]
La larva infectante (LI) de T. spiralis se encuentra en mamíferos incluyendo al
hombre, su ciclo biológico incluye 3 estadios; adultos, larva recién nacida (LRN) y larva
infectante (LI). [4,5]
Estudio de La Trichinellosis
El estudio de la triquinelosis es de capital importancia a nivel mundial tanto en
investigación clínica como básica, ya que los hallazgos contribuyen a un mejor
diagnostico y sobretodo, conocer los mecanismos que participan en la inducción y
permanencia de la enfermedad causada por éste nematodo.
Existen un número importante de técnicas de diagnostico y modelos de estudio
animal utilizados para conocer los mecanismos de infección de la trichinellosis. Dentro
de los modelos de estudio animal están el cerdo (principal vector de infección al
humano por el consumo de su carne), gato domestico, conejos Nueva Zelanda, ratas
Long Evans, ratones Balb/c, perro domestico, Hámster, entre otros. El presente trabajo
muestra un panorama de los modelos de estudio y pruebas de laboratorio en el
diagnostico de T. spiralis.
Diagnostico
El diagnóstico de la triquinelosis se apoya en diferentes datos clínicos y pruebas
de laboratorio. [6]
La identificación directa o indirecta del parásito permite la confirmación del
diagnóstico clínico, y se apoya en diferentes técnicas como son: La triquinoscopia
(compresión), la digestión artificial, el xenodiagnóstico, análisis histopatológico,
estudio parasitoscópico (coproparasitoscópicos), intradermorreacción de Bachman,
reacción de floculación con bentonita, ELISA, Western blot, inmunofluorescencia
indirecta, la inmunodifusión doble, entre otras. [7,8,9,10,11]
En la presente trabajo se hace la descripción de algunas técnicas utilizadas con
fines de diagnostico y de investigación clínica-básica y sus resultados. Como modelo de
estudio animal hemos utilizado a la rata.
Metodología en el diagnóstico de t. Spiralis
Modelo animal y método de infección. Se utilizaron ratas Long Evans hembras con
una edad promedio de dos meses y medio, con un peso aproximado de 250 gramos.
Cada animal fue infectado con 500 LI de T. spiralis por vía oral (trozo de carne
infectada)( Xenodiagnóstico).
Determinación del ciclo biológico de T. spiralis en rata. Las ratas infectadas con
T. spiralis se sacrificaron desde el primer día hasta el 30 post-infección. Se obtuvo
suero, tejido intestinal (duodeno, yeyuno e íleon) y muscular (pierna, masetero,
lengua, diafragma). El suero se obtuvo para llevar a cabo la determinación de la
respuesta inmune del huésped durante el ciclo biológico de T. spiralis. Del día 1 al 16
se realizaron cortes de tejido intestinal, así como de los días 1 al 40 los cortes
correspondieron a tejido muscular. Una parte del tejido se utilizo para la técnica de
Western blot (5 mg), otro para compresión en placa (50 mg de tejido entre 2
portaobjetos), otro para digestión artificial (60 gr.) y otro para inclusión en Tissue-Tek
(Sakura, O.C.T. 4583). A los tejidos musculares incluidos en Tissue-Tek, se realizaron
cortes para analizar la presencia de nematodos por inmunofluorescencia y otros para
tinción con hematoxilina-eosina.
Análisis histopatológico (Tinción con hematoxilina-eosina). El tejido en los
portaobjetos fue introducido 5 minutos en xileno., 3 minutos en alcohol etílico
absoluto., 3 minutos en alcohol etílico de 96°, agua potable y agua destilada (de
manera rápida), hematoxilina de Harris (por unos segundos), agua potable, alcohol
ácido 1% (de manera rápida), agua potable, solución saturada de carbonato de litio 2
minutos., agua potable, eosina (por unos segundos), agua potable, 2 cambios de
alcohol etílico de 96°, tres cambios de alcohol etílico absoluto, xileno (todos los pasos
anteriores fueron de 1 min.). Las preparaciones fueron montadas con resina sintética
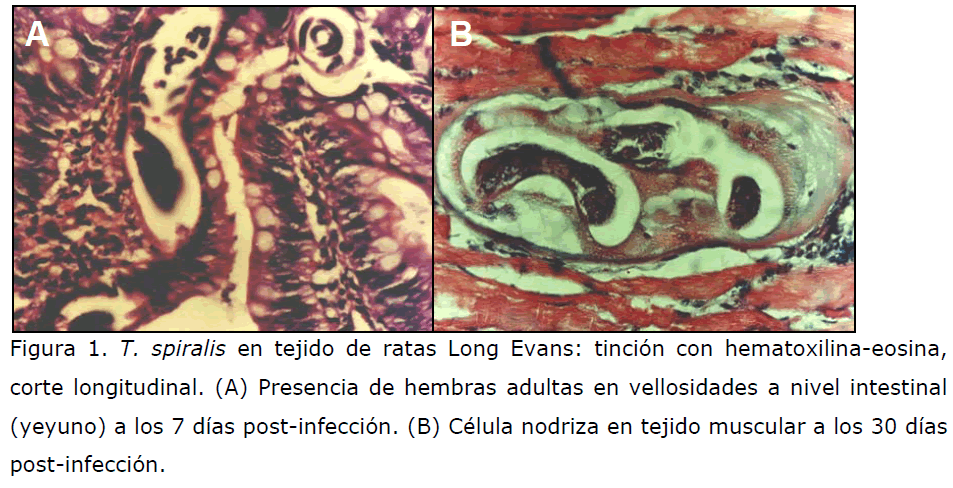
(Sigma) quedando listas para su análisis al microscopio (Figura 1). [12,13]
Figura 1. T. spiralis en tejido de ratas Long Evans: tinción con hematoxilina-eosina,
corte longitudinal. (A) Presencia de hembras adultas en vellosidades a nivel intestinal
(yeyuno) a los 7 días post-infección. (B) Célula nodriza en tejido muscular a los 30 días
post-infección.
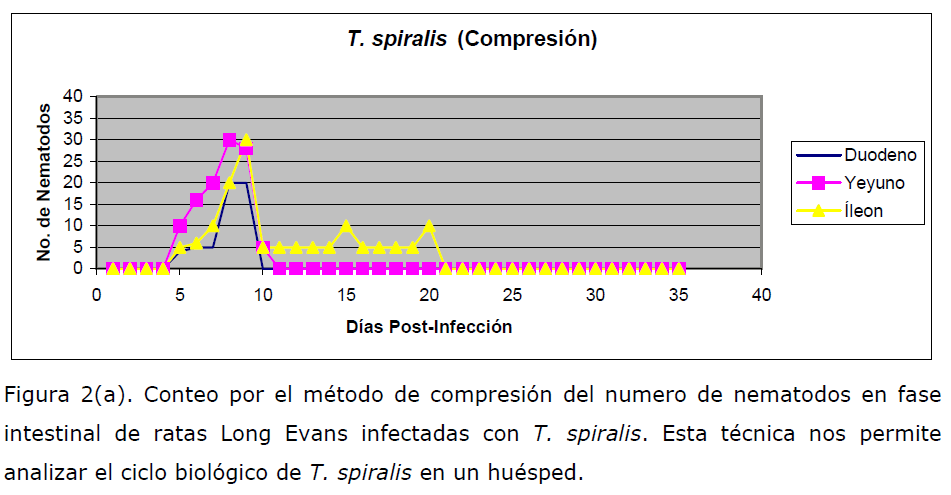
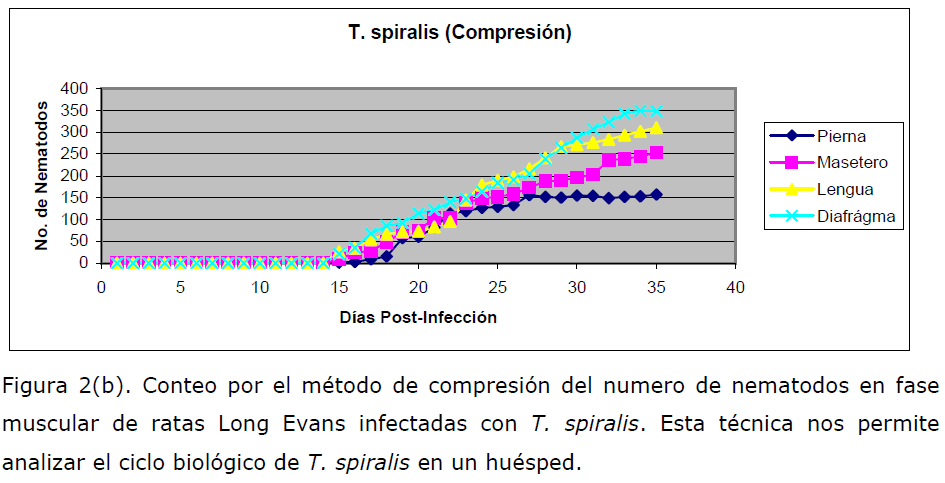
Triquinoscopia (compresión). El trozo de carne infectada (50 mg de tejido) se
colocó entre dos portaobjetos fuertemente unidos para después observar al
microscopio. Si es positivo, se ven los quistes con larvas en su interior o éstos pueden
estar calcificados si corresponden a la fase clínica de un estado mayor de 24 meses
(Figura 2a y 2b).
Figura 2(a). Conteo por el método de compresión del numero de nematodos en fase
intestinal de ratas Long Evans infectadas con T. spiralis. Esta técnica nos permite
analizar el ciclo biológico de T. spiralis en un huésped.
Figura 2(b). Conteo por el método de compresión del numero de nematodos en fase
muscular de ratas Long Evans infectadas con T. spiralis. Esta técnica nos permite
analizar el ciclo biológico de T. spiralis en un huésped.
Xenodiagnóstico. A partir de biopsias musculares infectadas, se da a comer a una
rata joven sana de laboratorio y al cabo de 3 a 4 semanas se examina mediante una
biopsia por compresión, digestión artificial o tinción con hematoxilina-eosina para
detectar larvas en los músculos.
Obtención de LI de tejido infectado por la Técnica de Digestión Artificial. Las LI
viables se obtuvieron del músculo de ratas Long Evans infectadas con T. spiralis por
seis semanas, las cuales al sacrificarlas, se obtuvo el tejido muscular (pierna,
macetero, lengua, diafragma e intercostales) que fue molido. Se pesaron 60 gramos de
carne y se colocaron en un costal de tela de tul, el cual se introdujo en un embudo de
separación para ser sometida a digestión con jugo gástrico artificial, preparado con 1
litro de agua destilada conteniendo pepsina a una concentración de 10,000 UL, 3% de
HCL 0.2 N (pepsina 3.5 grs. más 7 ml de HCL), manteniéndolo en incubación por 24
horas a 37 ºC. Una vez digerido el músculo, se toma una muestra del fondo, mismo
que es resuspendido en una solución de fosfatos (PBS) (Gibco BRL, Grand Island NY)
que se coloca en un portaobjetos y se analiza al microscopio. [14] Si es positivo, se
observan larvas moviéndose activamente (Figura 3).
Figura 3. Procedimiento de colocación de la carne infectada en un embudo de
separación conteniendo jugo gástrico artificial (Panel izquierdo). Después de 24 horas
se obtienen las larvas infectantes (Panel derecho).
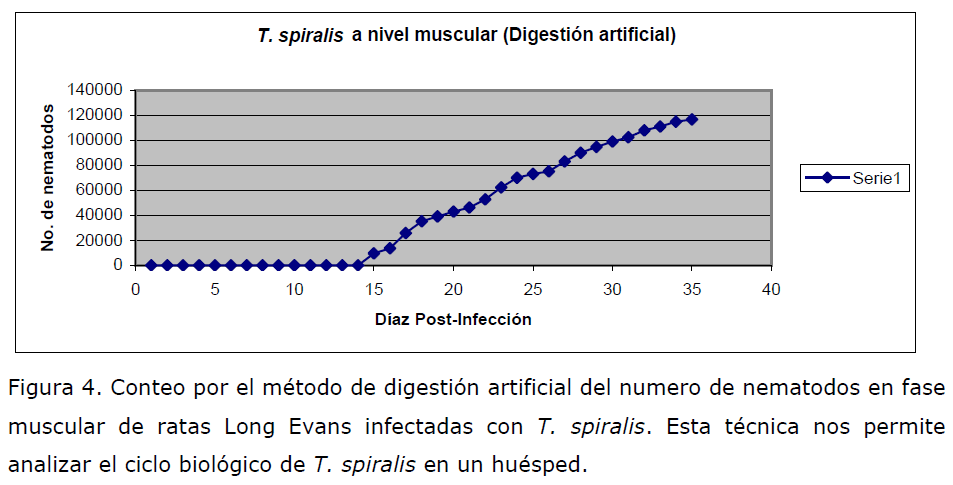
Ciclo Biológico de T. spiralis. Es conocido que el ciclo biológico de T. spiralis incluye
tres fases, la intestinal, sistémica y muscular. Para corroborar la infección de las ratas
con T. spiralis, se analizo el establecimiento de las larvas por medio de la técnica de
digestión artificial en la fase muscular. Los hallazgos se presentan en la Figura 4.
Figura 4. Conteo por el método de digestión artificial del numero de nematodos en fase
muscular de ratas Long Evans infectadas con T. spiralis. Esta técnica nos permite
analizar el ciclo biológico de T. spiralis en un huésped.
Obtención del antígeno soluble (AS). A partir de LI obtenidas por digestión
artificial de músculo estriado de rata infectada con T. spiralis, el paquete larvario se lavó 3 veces con solución de fosfatos salinos (PBS; pH de 7.2)(Gibco BRL, Grand Island
NY, USA, 21300-058), se le añadió una 1ml de solución de lisis que contiene: Triton X-
100 al 1%, NaCl 140 mM, EDTA 1 mM, Tris-HCl 10 mM pH 7.6 e inhibidor de proteasas
1 mM, PMSF (Sigma Chemical Co, St Louis MO, USA, P-7626). En frió, las larvas con
el buffer de lisis se homogenizaron. El lisado se centrifugó por 10 minutos a 1600 g y
el sobrenadante fue recuperado. [15] A los extractos solubles obtenidos se le determinó
la concentración de proteínas mediante la técnica descrita por Bradford (1976). [16]
Este extracto sirve como antígeno para probar la respuesta inmune del huésped por las
técnicas de inmunodifusión, ELISA y Wester blot.
Electroforesis en geles de poliacrilamida (PAGE-SDS). Del antígeno soluble
obtenido, 25 �g de proteína se caracterizaron por electroforesis en geles de
poliacrilamida (PAGE-SDS al 10%) de acuerdo a la técnica descrita por Laemmli
(1970). [17]
Western Blot e inmunodetección. Las proteínas en los geles de poliacrilamida-SDS
fueron transferidas a papel de nitrocelulosa (Amersham Laboratories,
Buckinghamshire, England, RPN303C), como describió Towbin (1979). [18] Después,
para identificar los antígenos contra los que están dirigidos los anticuerpos producidos
por el huésped, el blot fue tratado con el suero de ratas infectadas con T. spiralis con
una dilución 1:1000. Después, un anticuerpo anti-IgG de rata conjugado a peroxidasa
(Sigma Chemical Co, St Louis MO, USA, A-9044) dilución 1:1500 es usado como
segundo anticuerpo, seguido por un sistema de detección quimioluminiscente (ECL,
RPN2106, Amersham, Little Chalfont, Buckinghamshire, England), que fue detectado
en una película radiográfica BioMax (Eastman Kodak Co, Rochester, NY, USA, 870-
1302) en un tiempo de 1 minuto.
Esta técnica es de gran utilidad para evaluar la respuesta inmune de las ratas
infectadas o individuos infectados con T. spralis. A través de esta técnica se encuentra
un reconocimiento de los determinantes antigénicos a partir del día quinto (antígeno
de 67 Kd correspondiente a cutícula), mismo que correlaciona con el establecimiento
de las larvas a nivel intestinal. Este reconocimiento conforme pasan los días postinfección
va en aumento, detectándose con mayor claridad los antígenos de 48, 45,
42 y 32 Kd, correspondiente a la cavidad celómica del nematodo (Figura 5).
Figura 5. Respuesta inmune a la infección con T. spiralis en ratas Long Evans. Se
encontró una respuesta a partir del día séptimo (67 Kd, correspondiente a cutícula y
48, 45, 42 y 32 Kd, correspondiente a cavidad celómica), con un incremento en el
reconocimiento antigénico en el vigésimo día. Técnica de PAGE-SDS
Inmunofluorescencia: Los tejidos obtenidos de rata infectada colocados en los
portaobjetos fueron lavados con PBS, bloqueados con suero fetal bovino (SFB) al 3%
en PBS por 30 minutos e incubados por 1 hora con el suero de ratas infectadas con T.
spiralis, diluido 1:500 en 3% de SFB-PBS. Después del lavado, la incubación del primer
anticuerpo es seguido por el segundo anticuerpo (1:100, F-9137: FITC sheep anti-rata
(Sigma Chemical Co., St Louis MO.) por 1 hora a temperatura ambiente. Después de 5
lavados con PBS, los cubreobjetos fueron montados con una mezcla de PBS-Glicerol y
analizados por microscopia confocal (Carl Zeiss, Axiovert 200M).
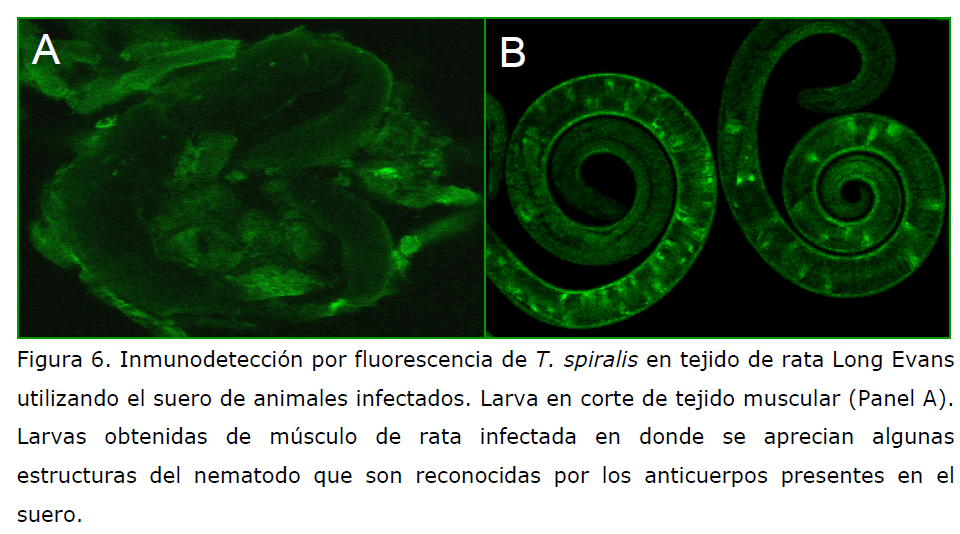
Esta técnica nos permite analizar a T. spiralis en los cortes de biopsias de
individuos infectados. Los nematodos van a ser fluorescentes ya que reaccionan con
los anticuerpos que genera el huésped contra estos nematodos (Figura 6).
Figura 6. Inmunodetección por fluorescencia de T. spiralis en tejido de rata Long Evans
utilizando el suero de animales infectados. Larva en corte de tejido muscular (Panel A).
Larvas obtenidas de músculo de rata infectada en donde se aprecian algunas
estructuras del nematodo que son reconocidas por los anticuerpos presentes en el
suero.
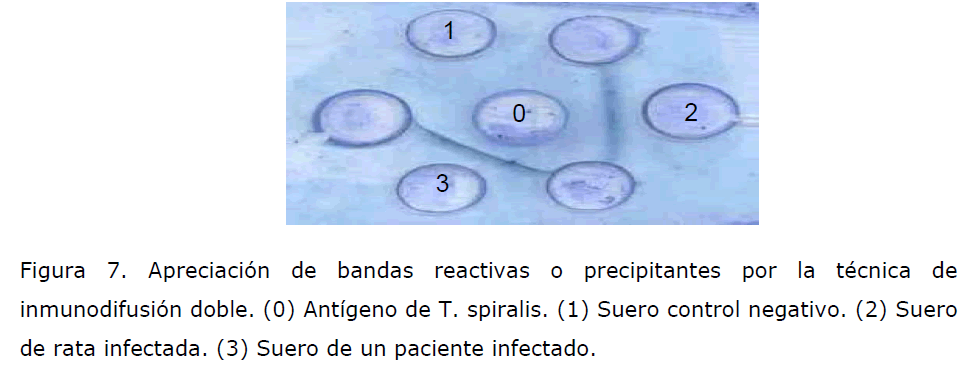
Inmunodifusión doble. Esta técnica nos permite de manera rápida detectar la
presencia de anticuerpos contra T. spiralis. Procedimiento: se preparan placas de
agarosa al 0.9%, se le hacen perforaciones en forma de roseta, en los pozos se coloca
al centro el antígeno obtenido de larvas de T. spiralis y en los periféricos los suero de
los paciente en estudio (Figura 7).
Figura 7. Apreciación de bandas reactivas o precipitantes por la técnica de
inmunodifusión doble. (0) Antígeno de T. spiralis. (1) Suero control negativo. (2) Suero
de rata infectada. (3) Suero de un paciente infectado.
Conclusión. Existe un numero amplio de técnicas de diagnostico así como de
modelos animales para el estudio de la triquinelosis. Su utilización depende de la
frecuencia con que se presenta esta enfermedad, así como de un buen diagnostico que
acompañado con este tipo de pruebas confirmen la presencia de esta enfermedad.
Bibliografía
- Schwalbe CW. Medicina veterinaria y salud pública. México, DF: Editorial Novaro. 1969.
- Martínez-Conde J. Guía del inspector veterinario titular. 2-Epizootiología y zoonosis. Barcelona: Biblioteca Veterinaria Aedos. 1975.
- Owen R. description of a microscopic entozoan infesting the muscle of the human body. Trans. Zool. Soc. 1835;1:315-324.
- Despommier D, Gwadz WR, Hotez JP. Parasitic disease. Springer Verlag. Third edition. 1994. pp. 32 – 40.
- Despomier D. Trichinella spiralis. Apple Trees Productions., New York, 2004.
- De la Rosa, JL. y Gómez A. “Trichinella y triquinosis”. Ed. Mc. Graw Hill, México. 2004.
- Bachman GW. An intradermal reaction in experimental trichiniasis. J. Prev. Med. 1928;2:513
- Bachman GW. A precipitin test in experimental trichiniasis. J. Prev. med. 1928;2:35.
- Ouchterlony O. Diffusion in Gel Methods for Immunological Analysis in: Progress Allergy. Vol. V. Ed. Gallio P Basel and New York, Krager, New York. USA. 1958. pp. 1 – 78.
- Tizard I. Inmunología Veterinaria. Editorial Interamericana. 4ta edición. México. 1992. pp 285.
- Gododezky LC, Escobar GA. 1994. Manual de técnicas de laboratorio. Micología parasitología e inmunología. INDRE, SSA. 1994. pp. 45 – 52.
- Manual of Histology and special staining technical. Armed Forces, Institute of Pathology. Washington, D.C. Chapter 4. 1957. pp. 29-38
- Reveles RG, Villalobos R, Saldivar S, Moreno MA. (1997) Implante histológico de Trichinella spiralis. Parasitología al Día. 21:114-118.
- Del Río A, Herrera RM, Herrera R. Triquinosis experimental extracción de antígenos y procedimientos para detectar Anticuerpos. Archivo de investigación Medica 1986;17:359 – 367.
- Harlow E, Lane D. Antibodies a laboratory manual. Cold Spring Harbor Laboratory. Cold Spring Harbord, N.Y. 1998.
- Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical. Biochemistry. 1976;72:248-254.
- Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature (London). 1970;227:680.
- Towbin H, Staehelin T. and Gordon J. Electrophoretic transfer of protein from polyacrilamide gels nitrocellulose sheets: procedure and applications. Proc. Natl. Acad. Sci. USA. 1979;76:4350-54.
1265