Ferran Losa Gaspà1*, Carmen Balañá Quintero2, Gemma Soler González3, Claudio Ballestín Carcavilla4, Laia Bernet Vegué5, Antonio Casado Herráez6, Anabel Enguita Valls4, Anna Estival González2, Alejandra Giménez Ortiz7, Ana González-Piñeiro8, Ricardo Hitt9, Lara Iglesias Docampo10, Martín Lázaro Quintela11, Aránzazu Manzano Fernández6, Eva Musulén Paletl12, Roberto Pazo Cid13, Esperanza Torres Sánchez14, and Xavier Matías-Guiu Guía15
1 Servicio de Oncología Médica, Hospital Sant Joan Despí-Moisés Broggi. ICO l’Hospitalet, Barcelona, España
2 Servicio de Oncología Médica, Hospital Germans Trías i Pujol. ICO Badalona, Barcelona, España
3 Servicio de Oncología Médica, Hospital Duran i Reynals. ICO L’Hospitalet, Barcelona, España
4 Servicio de Patología, Hospital Universitario 12 de Octubre, Madrid, España
5 Servicio de Patología y Oncología Diagnóstica, Hospital Lluís Alcanyís, Xátiva, Valencia, España
6 Servicio de Oncología Médica, Hospital Universitario San Carlos, Madrid, España
7 Servicio de Oncología Médica, Hospital Universitario La Fe, Valencia, España
8 Servicio de Anatomía Patológica, Hospital Álvaro Cunqueiro, Vigo, España
9 Servicio de Oncología Médica, Hospital de Leganés, Madrid, España
10 Servicio de Oncología Médica, Hospital Universitario 12 de Octubre, Madrid, España
11 Servicio de Oncología Médica, Hospital Álvaro Cunqueiro, Vigo, España
12 Servicio de Anatomía Patológica, Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona, España
13 Servicio de Oncología Médica, Hospital Miguel Servet, Zaragoza, España
14 Servicio de Oncología Médica, Hospital Universitario Virgen de la Victoria, Málaga, España
15 Servicio de Anatomía Patológica, Hospital Arnau de Vilanova, Lleida y Hospital de Bellvitge, Hospitalet, Barcelona, España
- *Corresponding Author:
- Ferran Losa Gaspà
Servicio de Oncología Médica,
Hospital Sant Joan Despí-Moisés Broggi. ICO l’Hospitalet, Barcelona, España
Email : ferran.losa@sanitatintegral.org
Received Date: January 17, 2019 Accepted Date: March 20, 2019, Published Date: March 27, 2019
Palabras clave:
Neoplasia; Neoplasia primaria desconocida; Biopsia; Técnicas de diagnóstico molecular; Inmunohistoquímica
Introducción
El Cáncer de Origen Desconocido (COD) constituye el 10º tumor más frecuente a nivel global, con una incidencia del 2-7% [1,2], y la cuarta causa más frecuente de muerte por cáncer tanto en hombres como en mujeres. En España, la incidencia se sitúa en torno al 3% [3]. Por grupos de edad, la incidencia mayor de COD se sitúa entre los 60 y los 75 años [4]. Parece que hay un cambio en la incidencia del COD asociado a la implementación de nuevas tecnologías diagnósticas [5].
El COD es un grupo de tumores heterogéneo que se define por la presencia de un cáncer metastático confirmado histológicamente, cuyo lugar de origen primario se desconoce, a pesar de realizar un estudio diagnóstico pormenorizado y estandarizado [6]. La entidad COD se suele reservar específicamente para neoplasias epiteliales, excluyendo otros tipos de cánceres no epiteliales (sarcoma, linfoma y melanoma), ya que estos suelen ser identificados fácilmente mediante anatomía patológica descriptiva e inmunohistoquímica (IHQ) básica y son susceptibles de recibir un tratamiento específico.
Por otro lado, a pesar de que algunos patrones de diseminación metastásica pueden sugerir el origen tumoral, en muchas ocasiones no sirven de guía [7], ya que en el COD el patrón de diseminación es atípico y con frecuencia es muy diferente al considerado clásico para el resto tumores conocidos.
Finalmente, la falta de acuerdo en la definición de COD crea confusión sobre quién debe ser el especialista responsable del paciente dado que la sospecha del origen del tumor en un órgano concreto no implica que se trate de un tumor originado en dicho órgano.
El desarrollo de una revisión de las recomendaciones existentes sobre el diagnóstico y tratamiento del COD se justifica debido a que los tumores considerados pertenecientes a esta entidad han ido variando a lo largo del tiempo debido a la evolución en la tecnología diagnóstica, y en cierta manera también, la rentabilidad, extensión y complejidad del proceso diagnóstico, así como el avance en el propio tratamiento de la enfermedad [8,9].
Metodología
El presente trabajo es el resultado de una revisión sistemática de la literatura en relación al cáncer de origen desconocido. Se realizó una búsqueda de artículos que trataran sobre el proceso de diagnóstico, el diagnóstico patológico, el tratamiento, el uso de plataformas moleculares y recomendaciones sobre el uso de plataformas moleculares, en pacientes con COD. La búsqueda se realizó en las bases de datos Pubmed, ScienceDirect, Cochrane library y Web of Science. Los artículos incluidos en la revisión fueron tanto artículos originales como estudios retrospectivos, de metaanálisis y de revisión y guías de práctica clínica. Se incluyeron artículos en español e inglés, y se consideraron todos los trabajos encontrados anteriores al año 2017. No se incluyeron estudios no publicados, informes técnicos, actas de conferencias o disertaciones que, si bien podría representar un sesgo en la información recopilada, no han pasado por un proceso de revisión por pares y por lo tanto su contenido no siempre ha podido ser validado.
Resultados y discussion
Proceso diagnóstico en el Cáncer de Origen Desconocido
El objetivo principal del diagnóstico de COD es identificar los subgrupos de pacientes que pueden beneficiarse de tratamiento específico. Un exceso de exploraciones complementarias puede retrasar la instauración terapéutica y puede comprometer la realización de pruebas esenciales para el diagnóstico como la biopsia, y en muchos casos perderse la oportunidad de ofrecer a tiempo un tratamiento oncoespecífico por el propio deterioro del paciente. Por ello la biopsia debe situarse en una fase precoz del estudio diagnóstico.
Obtención de muestra
La muestra debe ser representativa y contener la cantidad suficiente de tumor para poder realizar todos los estudios complementarios necesarios. La muestra debe ser elegida de la zona o localización más accesible y rentable posible. Se debe evitar obtenerla de tejido óseo en caso de que haya otras localizaciones disponibles y evitar también las lesiones necróticas. Las biopsias deben ser obtenidas con aguja gruesa y no con punción-aspiración con aguja fina (PAAF) para facilitar los posteriores estudios anatomopatológicos específicos o la utilización de plataformas moleculares (PM).
Evaluación inicial
En pacientes sin tumor primario clínicamente evidente es habitual la diseminación precoz, con un comportamiento más agresivo y con un patrón de diseminación metastásica no predecible. Las principales exploraciones que deben realizarse están resumidas en la Tabla 1.
| Primer Nivel-segundo Nivel |
| Datos clínicos y anamnesis: |
| - Historia médica detallada: hábitos tóxicos, antecedentes patológicos médicos y quirúrgicos, neoplasias previas, historia familiar. |
| - Examen físico completo por aparatos, incluyendo todas las áreas ganglionares periféricas, exploración mamaria, revisión de la piel y exploración pélvico-genital y rectal. |
| Pruebas básicas para todos los pacientes: |
| - Hemograma completo |
| - Bioquímica completa: función hepática y renal, electrolitos incluyendo calcio y LDH. |
| - Tomografía axial Computarizada de tórax, abdomen y pelvis. |
| - Biopsia (no PAAFs). Cáncer metastásico histológicamente confirmado. |
| Tercer Nivel |
| Estudios adicionales para un grupo de pacientes seleccionados (existencia de signos o síntomas diana) según los hallazgos previos: |
| - Resonancia Magnética nuclear (RMN) de mama. |
| - Ecografía testicular /ecografía de tiroides. |
| - Mamografía (para todas las mujeres-a valorar caso a caso) *, **. |
| - Concentración serológica de PSA (para todos los hombres). |
| - Concentración serológica de CA-125 y CA 15-3. |
| - Endoscopia. |
| - Test de sangre oculta en heces. |
| - Tomografía por emisión de positrones (PET-TAC) [17] en presentaciones en forma de metástasis única o adenopatías supraclaviculares o laterocervicales. |
| - Concentración serológica de α-fetoproteina y gonadotropina coriónica β humana (β - HCG) en tumores indiferenciados en pacientes menores de 50 años, o afectación metastática predominantemente ganglionar afectando la línea media. |
| - Laringoscopia en casos de afectación ganglionar cervical. |
| - Broncoscopia en casos de síntomas pulmonares o hallazgos radiológicos como adenopatías hiliares o mediastínicas. |
| - Ecografía ginecológica ante metástasis pélvicas o peritoneales CK7+. |
| Datos anatomopatológicos: |
| - Revisión histopatológica con un estudio IHQ específico. |
* las guías recomiendan su realización a todas las mujeres con COD. Sin embargo, algunos centros optan por realizarlas sólo después de disponer de los resultados histológicos ya que, en caso de sarcoma confirmado histológicamente, no es necesaria. ** la mamografía se completará con RMN mamaria si existiera alta sospecha de tumor mamario, por presencia de metástasis ganglionares axilares de adenocarcinoma con mamografía negativa [18].
Tabla 1 Algoritmo para la confirmación de la existencia de COD.
Existen tres niveles de pruebas diagnósticas:
1. Nivel clínico patológico (estudio clínico, forma de presentación, diagnóstico anatomopatológico y biopsia del tejido del paciente).
2. Nivel de estudios analíticos y pruebas de imagen básicas (especialmente radiografía de tórax y TAC).
3. Nivel de pruebas diagnósticas específicas para pacientes seleccionados.
La mayoría de las guías sólo suelen recoger los dos primeros niveles. El tercer nivel depende del tipo y sexo del paciente, así como de su forma de presentación.
Los estudios complementarios pueden permitir la identificación del tumor primario en un 30% de los casos. Sin embargo, la extensión del estudio diagnóstico más allá de las recomendaciones básicas solo mejora la rentabilidad diagnóstica en un 8-15% de los pacientes y, por el contrario, solamente en un número muy reducido de ellos existirá un tratamiento específico con un impacto significativo en la supervivencia para esos pacientes. Así, por ejemplo, no se recomendaría la endoscopia como prueba diagnóstica si el paciente está asintomático.
Existe cierta controversia sobre la realización de pruebas como la ultrasonografía testicular en hombres, la tomografía por emisión de positrones (PET) y la determinación de marcadores tumorales como alfa-fetoproteína, PSA, CEA, CA-125 y CA15-3. En relación con el PET, este contribuye de forma clara al estudio diagnóstico de pacientes con afectación ganglionar cervical, donde puede localizar el tumor primario hasta en un tercio de los casos, con una sensibilidad del 88% y una capacidad de casi un 30% de detectar metástasis regionales o a distancia desconocidas [10- 12]. Se debe realizar también en aquellos pacientes en los que se puede realizar un tratamiento radical no loco regional (no sólo en pacientes que presenten una única metástasis), para poder planificar una estrategia local [13-15]. En el resto de las situaciones el PET no estaría indicado debido a la falta de estudios prospectivos. Un metaanálisis y revisión sistemática sobre el uso del PET en pacientes con COD concluyó que el PET complementado con el TAC pudo encontrar el tumor primario en el 37% de casos de 433 pacientes, con una sensibilidad y especificidad del 84%. El pulmón fue la localización más habitual del primario con un 50% [16].
El diagnóstico patológico
Existen tres normas básicas para mejorar la rentabilidad diagnóstica histopatológica:
- Conocer la historia clínica y el resultado de los estudios de laboratorio y de imagen.
- Disponer de una muestra representativa del tumor: tamaño y calidad óptima, sin tejido necrótico. La biopsia debe permitir estudios posteriores (incluidos los moleculares).
- Disponer de recursos de inmunohistoquímica, estudios moleculares, genéticos para dianas terapéuticas y/o microscopía electronic a [17,18].
Proceso del diagnóstico anatomopatológico de un COD
Delante de un caso sospechoso de COD, el estudio anatomopatológico de búsqueda del tumor primario ha de seguir un proceso de diferentes fases:
1.Estudio histológico: obtención de cortes representativos de la muestra fijada en formol tamponado al 10%, incluidas en parafina y teñidas con hematoxilina-eosina
2.Estudios inmunohistoquímicos: suelen ser necesarias baterías de anticuerpos para una mejor aproximación al diagnóstico. Debe procederse en tres niveles que van de más genéricos a más específicos [19]:
- Primer nivel o nivel celular: orientado a la tipificación de la estirpe tumoral o línea celular (Tabla 2).
| Linfoma |
Melanoma |
Carcinoma |
Sarcoma |
| CD45 |
S100 |
Citoqueratina AE1-AE3 |
Vimentina |
| CD38 |
HMB45 |
EMA |
| Melan A |
CAM5.2 |
Tabla 2 Tipificación de la estirpe tumoral o línea celular.
- Segundo nivel o análisis de citoqueratinas: en neoplasias con diferenciación epitelial, existen dos anticuerpos fundamentales, la citoqueratina 7 (CK7) y la citoqueratina 20 (CK20), que usados en paralelo permiten orientar los orígenes más probables para un amplio abanico de casos de COD [20] (Tabla 3).
|
|
CK20 +
|
CK20 -
|
|
CK7 +
|
Gástrico Ovario Mucinoso Páncreas Tracto biliar Urotelio
|
NSCLC Mama Ovario seroso Endometrio Páncreas Tracto biliar Mesotelioma Tumor neuroendocrino Tumor Germinal
|
|
CK 7 -
|
Colorrectal Carcinoma de células de Merkel Gástrico Ovario Mucinoso
|
Diferenciación escamosa Próstata Riñón Hepatocarcinoma
|
Tabla 3 Esquema de la positividad y negatividad del análisis de CK para el diagnóstico del COD.
- Tercer nivel o nivel específico/ampliado: batería de anticuerpos amplia para confirmar el origen del COD para cada tipo de tumor posible [21] (Tabla 4). Llegado este punto, es importante gestionar óptimamente la muestra para no agotarla con solo la IHQ, dejando suficiente material en caso de que sean necesarias otras técnicas como las plataformas moleculares.
| Tipo de cáncer de sospecha |
Marcador IHQ |
| Origen urotelial |
P63, Trombomodulina, Uroplakina |
| Ovario mucinoso |
WT1 |
| Ovario Seroso |
WT1, BerEp4, Ca125, RE, mesotelina, PAX8, MUC5AC |
| Adenocarcinoma pulmonar |
TTF1, napsin A, surfactante A y B |
| Pulmón (No adenocarcinoma) |
CK7, TTF1, P63, CK5/6, napsin A |
| SCLC |
CD56, sinaptofisina, cromogranina, TTF1, Ki 67 |
| Mama |
Mamaglobina, GcdFP15, RE, RP, Her2neu, P53, Ki 67 |
| Endometrio |
Vimentina, RE |
| Mesotelioma |
Calretinina, WT1, mesotelina, CK5/6, D2-40, trombomodulina, antimesotelio |
| Tumores germinales |
AFP, betaHCG, CD30, OCT4 |
| Tiroides |
TTF1, Tiroglobulina, PAX9 |
| Próstata |
PSA, PAP |
| Riñón (no urotelial) |
CD10, RCCM, Vimentina, EMA |
| Colorrectal |
CEA, CDX2 |
| Carcinoma hepatocelular |
pCEA, antihepatocitario |
| Páncreas/vía Biliar |
CDX2, CK7, Ca19.9 |
| Neuroendocrinos |
CD56, sinaptofisina, cromogranina, PGP9 |
| Adrenal |
Alfa-inhibina, melan A |
Tabla 4 Principales marcadores en el análisis IHQ extendido.
Mediante el estudio de resultados de los tests de IHQ puede aplicarse el algoritmo detallado en la Figura 1, para obtener el diagnóstico de probabilidad de origen más seguro.
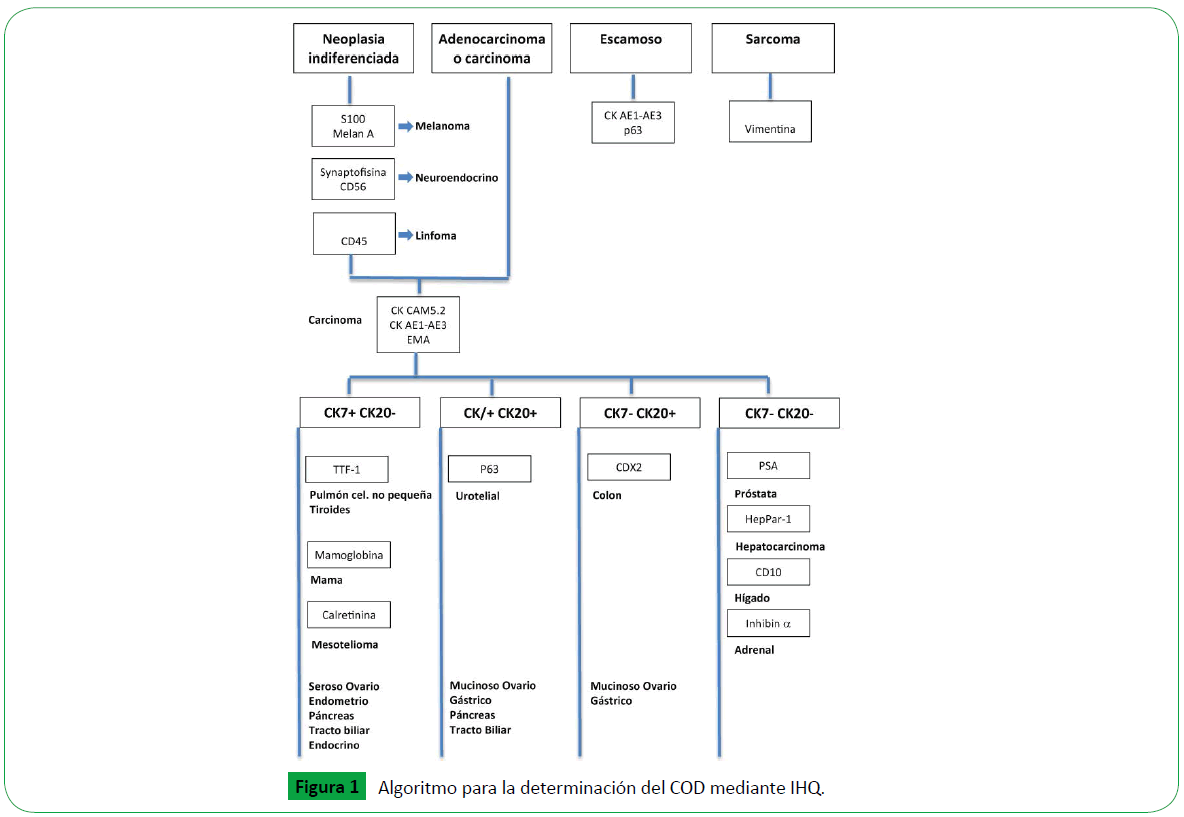
Figure 1: Algoritmo para la determinación del COD mediante IHQ.
El tratamiento
Hay una gran heterogeneidad en los COD, sin embargo, estos se pueden clasificar en cuatro subtipos histopatológicos principales: adenocarcinomas bien o moderadamente diferenciados (50%), adenocarcinomas o carcinomas no diferenciados o pobremente diferenciados (30%), carcinomas de células escamosas (15%) y neoplasias no diferenciadas (5%). Además, se ha observado que algunos pacientes tienen mejor respuesta a algunos tratamientos específicos que otros. En base a las características histológicas, clínicas, terapéuticas y de pronóstico los pacientes con COD se pueden clasificar en dos tipos. Los pacientes con cuadros clínicos que por consenso tienen tratamiento específico homologable a ciertos tumores conocidos y que tienen un pronóstico favorable, y los pacientes que no pueden encuadrase en ninguno de estos cuadros clínicos y que deben tratarse de forma empírica con quimioterapia (COD desfavorables). La supervivencia en pacientes con COD favorable es superior a la de los pacientes con COD desfavorable puramente clínicos (Figura 2). La mediana de supervivencia en pacientes con COD disminuye inversamente a la edad, aspecto relevante teniendo en cuenta que la mediana de edad de aparición del COD es aproximadamente 60 años.
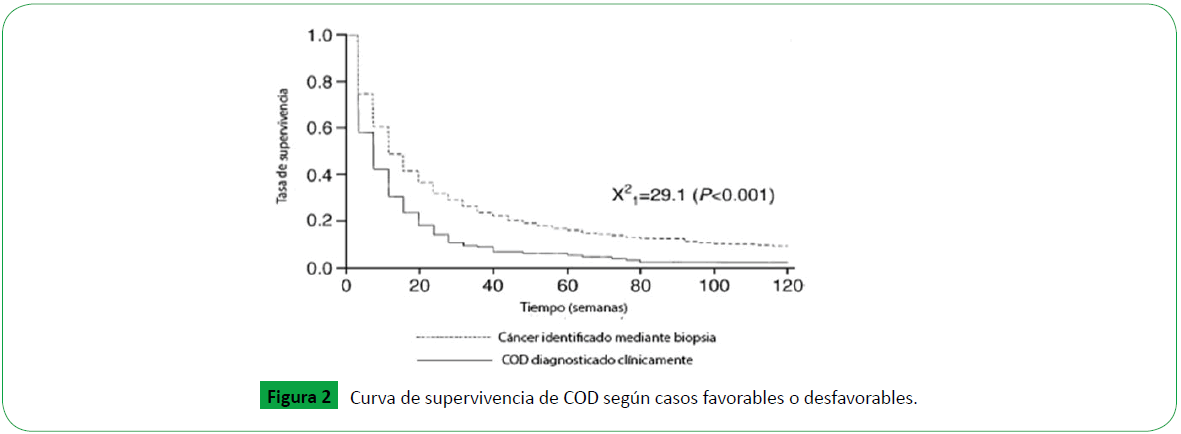
Figure 2: Curva de supervivencia de COD según casos favorables o desfavorables.
COD favorables y con tratamiento específico
Los subtipos de COD con pronóstico favorable son: i) mujeres con adenopatías axilares sin otras lesiones; ii) mujeres con carcinomatosis peritoneal; iii) hombres con adenopatías en la línea media; iv) adenopatías cervicales de histología escamosa; v) hombres con metástasis óseas y elevación de PSA; vi) pacientes con metástasis única (Tabla 5) [22].
| Subtipo COD |
Tratamiento propuesto |
Tumor equivalente |
| Carcinoma pobremente diferenciado |
QT combinada basada en platino |
Tumor extragonadal germinal |
| Carcinoma neuroendocrino pobremente diferenciado |
QT combinada con platino y etopósido |
Cáncer de pulmón de células pequeñas |
| Adenocarcinomatosis peritoneal de histología serosa-papilar en mujeres |
Resección quirúrgica seguido de QT basado en carboplatino y taxanos |
Cáncer de ovario |
| Metástasis en adenopatías axilares en mujeres |
Escisión quirúrgica de los ganglios, Mastectomía o RT de mama y Quimio-hormonoterapia adyuvante |
Cáncer de mama |
| Carcinoma escamoso con afectación de los ganglios cervicales no supraclaviculares |
Cirugía de cuello y/o radiación bilateral del cuello y del eje cabeza-cuello. Para estadios avanzados, QT de inducción con combinación basada en platino o QRT |
Cáncer de cabeza y cuello |
| Metástasis óseas con histología de adenocarcinoma en varón con elevación de PSA |
Terapia hormonal con agonistas de LHRH y/o antiandrógenos |
Cáncer de próstata |
COD: Cáncer de Origen Desconocido; LHRH: Hormona Liberadora de la Hormona Luteinizante; PSA: Antígeno Específico de Próstata; QT: Quimioterapia; RT: Radioterapia.
Tabla 5 Abordaje óptimo de los pacientes en pacientes COD.
i) Mujer con adenopatías axilares sin otras lesiones: la causa más frecuente es el cáncer de mama (CM) [23]. Su forma de presentación e historia natural es similar a un CM en estadio II. Su incidencia oscila entre el 0.12-0.67% de todos los tumores malignos diagnosticados, presentando el 52% de las pacientes enfermedad ganglionar N2 o N3. El tratamiento varía en función de la afectación: en enfermedad N1 se debe tratar como un CM estadio II (linfadenectomía axilar, mastectomía y radioterapia [RT]), mientras que en enfermedad N2, como CM estadio III (quimioterapia [QT] neoadyuvante seguida de la práctica convencional para CM estadio III). La mastectomía permite un diagnóstico certero y evita la necesidad de seguimientos por mamografía, con recurrencias locorregionales del 5-15%. La irradiación de todo el tejido mamario puede ser una alternativa a la mastectomía en casos seleccionados, con recurrencias locorregionales del 15-25%. La mediana de supervivencia a 5 y 10 años es del 75% y 60%, respectivamente [24].
ii) Mujer con carcinomatosis peritoneal: presenta una manifestación clínica muy similar al cáncer de ovario (CO). Con menor frecuencia, podría corresponder a un tumor mamario o gastrointestinal. La enfermedad puede extenderse al peritoneo abdominal y pélvico. La histología más frecuentemente es de adenocarcinoma seroso papilar o pobremente diferenciado. Deben ser tratados como un ovario estadio III-IV. En casos irresecables al diagnóstico, se planteará la neoadyuvancia con combinación de platino y taxanos, sin embargo, este tratamiento no es eficaz en adenocarcinomas que tengan un origen distinto del ginecológico. La introducción de la terapia antiangiogénica (bevacizumab) y el inhibidor de la PARP olaparib (no debe descartarse la realización de un estudio de BRCA-1/BRCA-2 en este grupo de enfermas) podrían mejorar el pronóstico.
iii) Varón con adenopatías en línea media: se comporta y responde similar a un tumor de línea germinal (síndrome de tumor germinal de tipo extragonadal). Se trata de un carcinoma no diferenciado o pobremente diferenciado. La inmunohistoquímica (PLAP, CD117, AFP y β-HCG) es clave para diferenciar los subtipos principales (seminomas y no seminomas) y realizar un correcto manejo y predicción pronóstica. El tratamiento sistémico consiste en dobletes con platino, con tasas de respuesta del 45- 65% y tasas de respuesta completa del 20-25% [25]. La mediana de supervivencia es cercana a 12 meses con sólo un 10% de pacientes que sobreviven a largo plazo [26-28]. Por otro lado, los principales factores predictivos para una mayor supervivencia son una baja carga tumoral, la condición física del paciente, ser de sexo femenino, la histología carcinomatosa y la ausencia de metástasis viscerales.
iv) Adenopatías cervicales de histología escamosa: constituye un 5% de los cánceres de cabeza y cuello, con una incidencia anual de 0.34 casos por 100,000 personas [29]. La terapia combinada es similar a la de cáncer de cabeza y cuello localmente avanzado: cirugía (escisión de los ganglios linfáticos) con o sin RT postoperatoria, RT sola o QT con RT seguido de cirugía. En pacientes con afectación cervical pN1 sin extensión extracapsular no se recomienda solo la cirugía: se debe irradiar ambos lados del cuello en el eje faríngeo completo y de la mucosa. El manejo locorregional ofrece una tasa de control a largo plazo del 50-60%. En pacientes con estadios más avanzados (N2 y N3) la terapia combinada con RT y cirugía es el abordaje preferencial. Así mismo, se ha observado que la administración combinada de QT y RT presenta un beneficio significativo.
v) Varón con metástasis óseas y elevación de PSA: en todo paciente con metástasis óseas con histología de adenocarcinoma debe realizarse un análisis del nivel de PSA. Los casos con elevación de este marcador se deben considerar como un carcinoma de próstata metastásico y deben recibir terapia endocrina/hormonal como la usada en el tratamiento del cáncer de próstata [1]. Cuando la enfermedad deviene resistente a la castración, los pacientes deberán ser tratados con QT [30].
vi) Pacientes con metástasis única: existe una elevada probabilidad que se trate de un tumor primario inusual que mimetice una neoplasia metastásica, siendo candidatos a un estudio con PET [31] y descartar otras afectaciones antes de plantearse la cirugía. El tratamiento en este tipo de pacientes debería ser local y con intención radical, basado en la administración de cirugía y/o RT. En general, estos pacientes con metástasis de COD solitarias son candidatos a un manejo radical, que permite una supervivencia libre de progresión larga e, incluso, supervivencias globales más allá de los 5 años.
Factores pronósticos
Los principales factores pronósticos [32], tanto favorables como desfavorables, están resumidos en la Tabla 6.
| Factores favorables |
Factores desfavorables |
| Sexo femenino Karnofsky >70 Afección metastásica única No fumador LDH normal Histología de carcinoma escasamente diferenciado, escamoso o diferenciación neuroendocrina Afección retroperitoneal o ganglionar Periférica |
Sexo masculino Karnofsky<70 Metástasis hepáticas o supraclaviculares Fumador LDH elevada Histología de adenocarcinoma |
Tabla 6 Factores pronósticos.
Los pacientes con COD y metástasis hepática representan un subgrupo de pacientes de pronóstico desfavorable. En un estudio de revisión publicado en 2008 se analizaron los resultados de 5 estudios con tratamiento de QT combinado basado en platino y no platino: se observó que la tasa de respuesta fue inferior al 20%, con una tasa de respuestas completas del 0-4.7% y una mediana de supervivencia de 8-9 meses [33].
COD sin perfil favorable
La QT empírica es el tratamiento de elección en los pacientes que no se pueden situar en ninguno de los subgrupos anteriormente detallados. Sin embargo, no existe actualmente un estándar de tratamiento recomendado y hay múltiples propuestas:
- Paclitaxel y carboplatino en combinación o no con etopósido [34]. Asociado con una baja toxicidad y una mediana de supervivencia de 7-10 meses.
- Carboplatino en combinación con docetaxel.
- Cisplatino en combinación con gemcitabina. Ha mostrado una eficacia mayor que la terapia con cisplatino e irinotecán, con una mediana de supervivencia de 8 meses [35].
- Gemcitabina en combinación con docetaxel. Presenta una buena tolerabilidad y está asociado con una mediana de supervivencia de 10 meses.
- Capecitabina o 5-FU en combinación con oxaliplatino. Presenta una buena tolerabilidad y está asociada con una supervivencia de 9.7 meses [36].
- Otros tratamientos: Se han publicado varios estudios de fase II sin platino como bevacizumab y erlotinib. La combinación de ambos fármacos presenta una actividad favorable y una mediana de supervivencia superior a la reportada con la QT de segunda línea (7-4 meses, con un 33% de los pacientes vivos al cabo de un año) [37]. Bevacizumab de primera línea podría no ser administrado en todas las personas que experimenten COD de origen en ovario, pulmón, mama o colorrectal. Sin embargo, podría ser utilizado específicamente para pacientes seleccionados.
Las plataformas moleculares
La capacidad de diagnosticar el cáncer primario oculto en COD ha mejorado gracias a la introducción y uso de los paneles de IHQ y plataformas o perfiles moleculares, aumentando el número de pacientes que puede beneficiarse de las innovaciones que van siendo introducidas [38]. La correcta determinación del subgrupo al cual pertenece cada paciente va a permitir optimizar el tratamiento y mejorar su supervivencia.
Importancia de la obtención del material: la gran limitación de las técnicas moleculares es la escasez de tejido disponible dado que durante su manipulación puede quedar una escasa cantidad de material genético, o este puede que sea de calidad insuficiente tras su extracción de la muestra tumoral (daño en la calidad de las biomoléculas durante el proceso de fijación de la muestra…).
Existen básicamente dos tipos de estrategias a la hora de plantear la utilización de una plataforma de estudio molecular en los pacientes diagnosticado de COD:
1. Plataformas moleculares diagnósticas orientadas a la identificación del tumor primario.
2. Plataformas de secuenciación para la caracterización del perfil mutacional del tumor.
1. Plataformas moleculares diagnósticas orientadas a la identificación del tumor primario
Estas plataformas basan sus resultados en la realización de un escore de similitud con las características genéticas o epigenéticas de tumores primarios ya conocidos. El procedimiento se basa en que, una vez obtenido el perfil molecular del tumor, éste se compara con los resultados de las bases de datos de casos de un número variable de localizaciones y tipos histológicos. Se valora la similitud del perfil molecular del tumor evaluado con estos patrones y se da un diagnóstico que ofrece una (o varias localizaciones), estimando las probabilidades de cada una (score de similitud).
Existen varios tipos de plataformas con este planteamiento, las cuales determinan bien la expresión génica del DNA o del perfil de microRNA, o bien la determinación del patrón de metilación del DNA de un determinado número de genes asociados a tumores conocidos [39]. En este sentido, disponemos de plataformas que permiten la clasificación de hasta 39 tipos distintos de tumores basándose en el análisis de 92 genes [40], presentando una tasa de correcta clasificación del 87% para 30 tipos de tumores y del 82-85% para 30 subtipos tumorales [41]. Tanto el análisis de los tumores metastásicos como los tumores de grado alto, así como los casos en los que no se dispone de mucho material biológico, presentan una eficacia óptima sin ninguna reducción en el rendimiento a la hora de su clasificación.
Por otro lado, resultan muy interesantes las propuestas basadas en una técnica epigenética basada en el perfil de metilación del DNA diferencial entre la muestra a estudio y una base de datos compuesta por más de 2,790 muestras provenientes de 38 tipos distintos de tumores [42]. Según el grado de similitud de la muestra problema con cada uno de los 38 tipos tumorales, es posible identificar el tumor de origen en pacientes con metástasis de origen desconocido, presentando una sensibilidad global del 97.7% y una especificidad global del 99.6%, así como un 88.6% de valor predictivo positivo y 99.9% de valor predictivo negativo. En su validación se utilizó un conjunto independiente de 7,691 muestras de esos mismos tipos tumorales que incluyeron 534 metástasis. En total, se incluyeron más de 10,000 muestras tumorales en el desarrollo y validación del test. Esta técnica permite el procesado de muestras fijadas en formol e incluidas en parafina, así como muestras congeladas.
El impacto del perfil genómico en la gestión del COD se empezó a poner claramente de manifiesto a partir de 2012 en el Congreso de la ASCO, donde Hainsworth y Greco presentaron un estudio en COD con un número amplio de pacientes (n=300) en la que un grupo pequeño de éstos no recibieron terapia biológica dirigida, sino empírica, mientras que el resto de los pacientes recibió terapia específica en función del tejido de origen según los estudios de perfil molecular [43,44]. Los resultados indicaron que en los pacientes con tumores poco diferenciados que fueron catalogados como neoplasias favorables, la terapia dirigida alcanzó una supervivencia de unos 13 meses, superior a la reportada en los anteriores estudios de fase II con terapia empírica. En este mismo sentido, se ha publicado recientemente otro estudio utilizando la epigenética aplicado a 216 casos de COD bien caracterizados de forma retrospectiva, validando a posteriori la exactitud de sus predicciones. El test predijo el tejido de origen primario en el 87% de estos pacientes. Los pacientes con diagnóstico de tumor primario por análisis de metilación que recibieron una terapia específica del tipo de tumor (acorde al test, análisis retrospectivo) mostraron una mejoría de la supervivencia global (SG) en comparación con los pacientes que recibieron tratamiento empírico (HR=3.24, p=0.0051; 95% CI=1.42-7.38; log-rank test, p=0.0029). Como conclusión, se pudo objetivar que un tratamiento específico confirió una SG de 13.6 meses (IC 95%: 4.1-55.4 meses) en comparación con los 6 meses (IC 95%: 0.3-57.4 meses) de una terapia empírica no específica. Por tanto, estos resultados sugieren que los pacientes con COD pueden presentar una ventaja en la supervivencia cuando reciben terapia específica para el sitio de origen en función de los ensayos moleculares.
2. Plataformas de secuenciación para la caracterización del perfil mutacional del tumor:
La secuenciación con paneles de genes utilizando técnicas de Next Generation Sequencing (NGS) permite identificar mutaciones que, en un porcentaje más o menos importante de casos, podrían estas asociados a un beneficio con la utilización de fármacos dirigidos hacia estas mismas mutaciones.
El beneficio potencial de este planteamiento basado en la ultraselección de tratamientos oncoespecíficos basados en el perfil molecular puede beneficiar hasta un 87% de los pacientes afectos de COD [45-47]. La principal objeción proviene de si el potencial de respuesta de un fármaco a una mutación determinada está condicionado por el tipo de tumor en el que la mutación se encuentra. Es decir, el contexto de tipo histológico y la localización del tumor pueden condicionar la respuesta al fármaco, y no sólo el perfil mutacional.
Las plataformas que realizan un perfil genómico completo mediante secuenciación genómica masiva en la región codificante de un número predeterminado de genes relacionados con cáncer permiten la detección de alteraciones genómicas como las sustituciones de bases, inserciones/deleciones de fragmentos de DNA, variaciones en el número de copias y recombinaciones de genes. Permiten además la evaluación de los genes reparadores (estudio de la inestabilidad de microsatélites) y la determinación de la tasa de la carga mutacional tumoral (tumor mutational burden (TMB)) de capital importancia para la indicación de tratamientos diana y/o inmunoterápicos [46,47].
Características de los pacientes candidatos a estudios genéticos
Los pacientes candidatos a PM deben mostrar ausencia de criterios clínicos claros para un tumor primario conocido, así como una ausencia de correlación clínico-inmunohistoquímica.
Los pacientes que más se benefician de las PM suelen ser varones con un estado funcional ECOG 0-1, con adenopatías cervicales e histología de carcinoma epidermoide. Por el contrario, los pacientes que menos se benefician son varones con un estado funcional ECOG 1-2, con derrame pleural e histología de adenocarcinoma con fenotipo epitelial glandular.
Algoritmo sugerido para el uso de plataformas moleculares
Inicialmente se debe realizar una evaluación morfológica mediante hematoxilina y eosina y una batería inmunohistoquímica lo más dirigida posible, asegurando que, tras la IHQ, haya la suficiente cantidad de tejido para realizar un análisis mediante una PM. Si no hay resultados claros con la IHQ inicial, se debería proceder al uso de la PM, antes que seguir haciendo técnicas de IHQ. Si a pesar de la utilización de la PM, todavía no disponemos de resultados claros, se podría plantear el uso de técnicas de secuenciación masiva para obtener más información sobre la entidad y origen de esta tumoración.
Asimismo, si se confirma o hay algún dato interesante derivado del hallazgo molecular, se debe hacer una investigación IHQ más dirigida en concordancia con los datos moleculares.
En conclusión, la IHQ predice el sitio de origen con una sensibilidad del 60-80% [48] pero las técnicas moleculares permiten aumentarla hasta el 75-95%. En carcinomas pobremente diferenciados las técnicas moleculares se muestran más eficientes. La IHQ continúa siendo la herramienta principal para la identificación de los COD, pero las nuevas plataformas moleculares permiten identificar el tumor primario en un número sustancial de pacientes cuando las técnicas de IHQ no son concluyentes y nos permiten diseñar una estrategia terapéutica más dirigida.
Las recomendaciones de la utilización de plataformas moleculares (NICE, ESMO, NCCN)
Las principales guías actualizadas (NICE, ESMO, NCCN) no dedican especial atención a las Plataformas Moleculares. Según la guía ESMO, el impacto de las PM sobre el beneficio terapéutico al permitir un tratamiento más específico es cuestionable y no se ha demostrado un claro beneficio en ningún estudio aleatorizado [49]. El nivel de evidencia para esta afirmación es bajo (IV: estudios con cohortes retrospectivos o estudios caso-control) y el nivel de recomendación es C ante la falta de estudios más importantes (la ausencia de evidencia para la eficacia o beneficio no excede el riesgo o desventajas). La guía NICE no especifica el nivel de precisión que las PM pueden conferir en cuanto al diagnóstico de un posible tumor primario, y se limita a afirmar que son necesarios estudios prospectivos para poder ofrecer la confirmación de si la QT recomendada según el perfil de expresión genética puede ser beneficiosa en pacientes con COD y, en todo caso, superior a la QT convencional [50].
Según NICE, la selección de la QT óptima para los pacientes con cáncer se basa en un profundo conocimiento del órgano de origen del tumor. La guía NCCN aporta una descripción más detallada de los ensayos clínicos en su justificación, así como una descripción general de los distintos métodos de PM, el número de genes implicados en cada PM y los estudios de validación de estas, y también el interesante planteamiento de identificar biomarcadores genéticos asociados a tratamientos diana basados en el estudio de la secuenciación masiva del DNA (NGS). Sin embargo, tampoco profundiza mucho en el aspecto específico de las PM y su utilización [51].
La NCCN concluye que, con los datos disponibles y los resultados que tenemos, no es posible dar una suficiente recomendación para aplicar las plataformas moleculares a gran escala. No comenta nada de a pequeña escala o con pacientes seleccionados.
En resumen, todas las guías destacan la importancia de conocer el tumor primario oculto y las PM se presentan, en todo caso, como una opción útil para conocer el tumor primario con un alto grado de precisión superior al 80-95%. Destacan que el impacto en beneficio clínico para un tratamiento dirigido basado en el resultado de un estudio molecular todavía es controvertido y el nivel de evidencia y grado de recomendación es bajo, pero reclaman la necesidad de realizar estudios aleatorizados de fase III para demostrar que es superior un tratamiento específico de quimioterapia dirigido según el resultado del estudio de expresión génica. Existe la controversia sobre si realmente estos estudios de fase III con una población heterogénea de pacientes, solucionarán la cuestión. Sería mejor centrar los estudios en subpoblaciones de pacientes donde se pudiera seleccionar mejor la posibilidad de identificar tumores en los que se disponga de tratamientos más oncoespecíficos o que, en cualquier caso, no reciban tratamientos absolutamente inadecuados. La secuenciación masiva es una técnica muy interesante, aunque en la actualidad se recomienda su uso en contextos de ensayo clínico. Finalmente, desde el punto de vista del consenso español, se considera que uno de los puntos importantes es identificar qué pacientes se pueden beneficiar del uso de las PM y, por tanto, seleccionar los pacientes que podrían ser los auténticos beneficiados del tratamiento específico.
Conclusión
El COD es, por definición, una enfermedad metastásica compleja y heterogénea, incurable en la mayoría de los casos, por lo que se plantea la necesidad de unidades de COD para un mejor manejo diagnóstico/terapéutico de estos pacientes. Sin embargo, un diagnóstico preciso y un tratamiento correctamente seleccionado pueden lograr mejorar significativamente la supervivencia de los pacientes. Las pruebas diagnósticas a realizar comprenden algunas, pocas, esenciales a todos los casos y otras electivas, de utilidad limitada a ciertas presentaciones clínicas de la enfermedad. El patrón de metástasis y otros parámetros clínicos (ECOG, niveles de LDH) pueden ser una forma sencilla de clasificación pronóstica de los pacientes. La obtención precoz de material de biopsia de calidad y la realización de técnicas de IHQ continúan siendo el eje diagnóstico fundamental para orientar el tratamiento.
Las nuevas plataformas de diagnóstico molecular pueden permitir afinar el diagnóstico del posible origen de algunos casos de COD en los que las técnicas histológicas encuentran sus límites, permitiendo así la administración de una terapia específica a los pacientes y evitando toxicidades. Finalmente, se abre el debate si serían recomendables auténticas unidades de COD para un mejor manejo diagnóstico/terapéutico de estos pacientes.
24494
References
- Pavlidis N, Briasoulis E, Hainsoworth J, Greco FA (2003) Diagnostic and therapeutic management of cancer of an unknown primary. Eur J Cancer 39: 1990-2005.
- Pavlidis N, Fizazi K (2005) Cancer of unknown primary (CUP). Crit Rev Oncol Hematol 54: 243-250.
- Fernández Cotarelo MJ, Guerra Valesa JM, González Paz C, Colina Ruizdelgado F (2009) Estudio de los tumores de origen desconocido diagnosticados en el período 1999-2003. Bol Oncol 26: 1-7.
- Levi F, Te VC, Erler G, Randimbison L, La Vecchia C (2002) Epidemiology of unknown primary tumors. Eur J Cancer 38: 1810-1812.
- Brewster DH, Lang J, Bhatti LA, Thomson CS, Oien KA (2014) Descriptive epidemiology of cancer of unknown primary site in Scotland, 1961-2010. Cancer Epidemiol 38: 227-234.
- Natoli C, Ramazzotti V, Nappi O, Giacomini P, Palmeri S, et al. (2011) Unknown primary cancer. Biochim Biophys Acta 1816: 13-24.
- Hainsworth JD, Greco FA (1993) Treatment of patients with cancer of an unknown primary site. N Engl J Med 329: 257-263.
- Pejčić I, Vrbić S, Todorović M, Petković I, Balić M, et al. (2014) Cancer of unknown primary site syndrome‐CUP syndrome ‐ Diagnostic and therapeutical dillemas. Sci J Fac Med Niš 31: 87-94.
- Kim KW, Krajewski K, Jagannathan JP, Nishino M, Shinagare AB, et al. (2013) Cancer of unknown primary sites: what radiologists need to know and what oncologists want to know. Am J Roentgenol 200: 484-492.
- Zhu L, Wang N (2013) 18F-fluorodeoxyglucose positron emission computed tomography as a diagnostic tool in patients with cervical nodal metastases of unknown primary site: A meta-analysis. Surg Oncol 22: 190-194.
- Gutzelt A, Antoch G, Kühl H, Egelhof T, Fischer M, et al. (2005) Unknown primary tumors: Detection with dual-modality PET/CT-initial experience. Radiol 234: 227-234.
- Cantos Sánchez de Ibargüen B, Sánchez Ruiz A, Maximiano Alonso C, Hurtado Nuño A, Sánchez Yuste MR (2006) Carcinoma de origen desconocido: diagnóstico y manejo terapéutico. Oncología 29: 95-106.
- Delgado-Bolton RC, Fernández-Pérez C, González-Maté A, Carreras JL (2003) Meta-analysis of the performance of 18F-FDG PET in primary tumor detection in unknown primary tumors. J Nucl Med 44: 1301-1314.
- Sève P, Billotey C, Broussolle C, Dumontet C, Mackey JR (2007) The role of 2-deoxy-2-(F-18) fluoro-D-glucose positron emission tomography in disseminated carcinoma of unknown primary site. Cancer 109: 292-299.
- Pelosi E, Pennone M, Deandreis D, Douroukas A, Mancini M, et al. (2006) Role of whole body positron emission tomography/computed tomography scan with 18F-fluorodeoxyglucose in patients with biopsy proven tumor metastases from unknown primary site. Q J Nucl Med Mol Imaging 50: 15-22.
- Kwee TC, Kwee RM (2009) Combined FDG-PET/CT for the detection of unknown primary tumors: Systematic review and meta-analysis. Eur Radiol 19: 731-744.
- Roh JL, Kim JS, Lee JH, Cho KJ, Choi SH, et al. (2009) Utility of combined (18)F-fluorodeoxyglucose-positron emission tomography and computed tomography in patients with cervical metastases from unknown primary tumors. Oral Oncol 45: 218-224.
- Olson JA Jr, Morris EA, Van Zee KJ, Linehan DC, Borgen PI (2000) Magnetic resonance imaging facilitates breast conservation for occult breast cancer. Ann Surg Oncol 7: 411-415.
- Pavlidis N, Khaled H, Gaafar R (2015) A mini review on cancer of unknown primary site: A clinical puzzle for the oncologist. J Adv Res 6: 375-382.
- Fizazi K, Greco FA, Pavlidis N, Pentheroudakis G, ESMO Guidelines Working Group (2011) Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 22: vi64-68.
- Hammond ME, Hayes DF, Dowsett M, Allred DC, Hagerty KL, et al. (2010) American Society of Clinical Oncology/College of American Pathologists Guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer. Arch Pathol Lab Med 134: e48-e72.
- Pavlidis N, Pentheroudakis G (2010) Cancer of unknown primary site: 20 questions to be answered. Ann Oncol 21: vii303-307.
- Pavlidis N, Pentheroudakis G (2012) Cancer of unknown primary site. Lancet 379: 1428-1435.
- Pentheroudakis G, Lazaridis G, Pavlidis N (2010) Axillary nodal metastases from carcinoma of unknown primary (CUPAx): a systematic review of published evidence. Breast Cancer Res Treat 119: 1-11.
- Pentheroudakis G, Stoyianni A, Pavlidis N (2011) Cancer of unknown primary patients with midline nodal distribution: Midway between poor and favourable prognosis? Cancer Treat Rev 37: 120-126.
- Greco FA, Vaughn WK, Hainsworth JD (1986) Advanced poorly differentiated carcinoma of unknown primary site: recognition of a treatable syndrome. Ann Intern Med 104: 547-553.
- Van der Gaast, Verweij J, Henzen-Logmans SC, Rodenburg CJ, Stoter G (1990) Carcinoma of unknown primary: Identification of a treatable subset? Ann Oncol 1: 119-122.
- Penteroudakis G, Briasoulis E, Karavassilis V, Fountzilas G, Xeros N, et al. (2005) Chemotherapy for patients with two favourable subsets of unknown primary carcinomas: active, but how effective? Acta Oncol 44: 155-160.
- Jereczek-Fossa BA, Jassem J, Orecchia R (2004) Cervical lymph node metastases of squamous cell carcinoma from an unknown primary. Cancer Treat Rev 30: 153-164.
- Hainsworth JD, Fizazi K (2009) Treatment for patients with unknown primary cancer and favourable prognostic factors. Semin Oncol 36: 44-51.
- Alberini JL, Belhocine T, Hustinx R, Daenen F, Rigo P (2003) Whole-body positron emission tomography using fluorodeoxyglucose in patients with metastases of unknown primary tumours (CUP syndrome). Nucl Med Commun 24: 1081-1086.
- Toscas Vigara JI, Verdaguer Fransoy E, Caro Gallarin M, Fernánde Ibiza J, Casado Meléndez A, et al. (2002) Carcinoma de origen desconocido. Med Integr 39: 391-398.
- Lazaridis G, Pentheroudakis G, Fountzilas G, Pavlidis N (2008) Liver metastases from cancer of unknown primary (CUPL): A retrospective analysis of presentation, management and prognosis in 49 patients and systematic review of the literature. Cancer Treat Rev 34: 693-700.
- Hainsworth JD, Spigel DR, Clark BL, Shipley D, Thompson DS, et al. (2010) Paclitaxel/carboplatin/etoposide versus gemcitabine/irinotecan in the first-line treatment of patients with carcinoma of unknown primary site: A randomized, phase III Sarah Cannon Research Consortium Trial. Cancer J 16: 70-75.
- Culine S, Lortholary A, Voigt JJ, Bugat R, Théodore C, et al. (2003) Cisplatin in combination with either gemcitabine or irinotecan in carcinomas of unknown primary site: Results of a randomized phase II study—Trial for the French Study Group on Carcinomas of Unknown Primary (GEFCAPI 01). J Clin Oncol 21: 3479-3482.
- Varadhachary GR, Raber MN, Matamoros A, Abbruzzese JL (2008) Carcinoma of unknown primary with colon-cancer profile-changing paradigm and emerging definitions. Lancet Oncol 9: 596-569.
- Hainsworth JD, Spiegel DR, Farley C, Thompson DS, Shipley DL, et al. (2007) Phase II trial of bevacizumab and erlotinib in carcinomas of unknown primary site: The Minnie Pearl Cancer Research Network. J Clin Oncol 25: 1747-1752.
- Varadhachary GR, Raber MN (2014) Cancer of unknown primary site. N Engl J Med 371: 757-765.
- Economopoulou P, Mountzios G, Pavlidis N, Pentheroudakis G (2015) Cancer of unknown primary origin in the genomic era: Elucidating the dark box of cancer. Cancer Treat Rev 41: 598-604.
- Kerr SE, Schnabel CA, Sullivan PS, Zhang Y, Singh V, et al. (2012) Multisite validation study to determine performance characteristics of a 92-gene molecular cancer classifier. Clin Cancer Res 18: 3952-3960.
- Elander MG, Ma XJ, Kesty NC, Bao L, Salunga R, et al. (2011) Performance and clinical evaluation of the 92-gene real-time PCR assay for tumor classification. J Mol Diagn 13: 493-503.
- Moran S, Martínez-Cardús A, Sayols S, Musulén E, Balañá C, et al. (2016) Epigenetic profiling to classify cancer of unknown primary: A multicentre, retrospective analysis. Lancet Oncol 17: 1386-1395.
- Hainsworth JD, Greco FA (2014) Gene expression profiling in patients with carcinoma of unknown primary site: From translational research to standard of care. Virchows Arch 464: 393-402.
- Hainsworth JD, Rubin MS, Spigel DR, Boccia RV, Raby S, et al. (2013) Molecular gene expression profiling to predict the tissue of origin and direct site-specific therapy in patients with carcinoma of unknown primary site: A prospective trial of the Sarah Cannon research institute. J Clin Oncol 31: 217-223.
- Clynick B, Dessauvagie B, Strerrett G, Harvey N, Subrramanian S, et al. (2017) Detection of Therapeutic Targets in Carcinomas of Unknown Primary. ESMO 2017 # 1705-PD. Ann Oncol 28: v595-v604.
- Gatalica Z, Millis SZ, Vranic S, Bender R, Basu GD, Voss A, et al. (2014) Comprehensive tumor profiling identifies numerous biomarkers of drug response in cancers of unknown primary site: Analysis of 1806 cases. Oncotarget 5: 12440-12447.
- Ross JS, Wang K, Gay L, Otto GA, White E, et al. (2015) Comprehensive genomic profiling of carcinoma of unknown primary site: New routes to targeted therapies. JAMA Oncol 1: 40-49.
- Oien KA, Dennis JL (2012) Diagnostic work-up of carcinoma of unknown primary: from inmunohistochemistry to molecular profiling. Ann Oncol 23: x271-277.
- Fizazi K, Greco FA, Pavlidis N, Dougaard G, Oien K, et al. (2015) ESMO Guidelines Committee. Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 26: v133-138.
- National Institute for Health and Care Excellence (2010) Metastatic malignant disease of unknown primary origin. Diagnosis and management of metastatic malignant disease of unknown primary origin. Clinical guidelines CG104.
- NCCN Clinical Practice Guidelines in Oncology (2019) Occult Primary (Cancer of Unknown Primary [CUP]).







