Keywords
Hypercholesterolemia; Intestinal microbiota; Probiotic bacteria
Introduction
La Organizacón Mundial de la Salud (OMS) ha pronosticado que para el año 2030, las enfermedades cardiovasculares se convertirán en la principal causa de muerte, afectando aproximadamente a 23,6 millones personas a nivel mundial. La hipercolesterolemia es de las principales causas del desarrollo de las enfermedades cardiovasculares, siendo responsable de más de un 45% de los casos de ataques al corazón en Europa occidental [1]. Se ha calculado que el riesgo de sufrir ataques al corazón es tres veces mayor en los pacientes con hipercolesterolemia. Por lo tanto, es importante reducir los niveles de colesterol en sangre, y una manera es modificando la conducta alimentaria, hacer ejercicio con regularidad, y de ser necesaria tomar terapia con fármacos. Los agentes farmacológicos reducen eficazmente éstos niveles; sin embargo, son costosos y tienen efectos secundarios considerables [2,3].
Debido a la baja eficacia de las estrategias actuales para la disminución del colesterol, se han buscado nuevos tratamiento dentro de los cuales se encuentra el consumo de los probióticos o bacterias que conforman la microbióta intestinal (MI).
Microbiota Intestinal
La MI se compone por más de 1000 géneros/especies de bacterias, levaduras, virus y fagos. Los principales filos bacterianos que Ia conforman son los Firmicutes y los Bacteroidetes que representan alrededor del 90% del total de las bacterias del intestino. Se estima que alrededor de 1014 microorganismos están albergados en el tubo digestivo, principalmente en el colon [4]. Así, la homeostasis del ecosistema digestivo está determinada por el equilibrio entre la microbiota, la permeabilidad intestinal y la inmunidad local. Cualquier factor o evento que afecte uno de estos componentes repercute sobre los demás e impacta negativamente al organismo, causando alteraciones en la MI a lo que se denomina “disbiosis”. Por lo tanto la MI varía de un sujeto a otro y forma con su huésped una estrecha relación positiva denominada “simbiosis”, la cual ejerce funciones metabólicas, nutricionales y de defensa que benefician al hospedero.
Probióticos
La OMS y la Organización de las Naciones Unidas para la Agricultura y Alimentación (FAO) definen a los probióticos como “organismos vivos que al ser administrados en raciones adecuadas confieren un beneficio a la salud del huésped”. Los probióticos son benéficos para la salud debido a que modulan la MI, existiendo competencia por los nutrimentos y sitios de adherencia a las paredes intestinales entre los probióticos y los patógenos presentes, lo que impide la colonización de patógenos y refuerza los mecanismos de defensa del sistema inmune [4].
Disminución de los Niveles de Colesterol por Probióticos
Otra interesante propiedad de los probióticos es la capacidad de reducción de los niveles de colesterol en sangre. A principios del siglo XIX, Metchnikov propusó que las leches de fermentación por bacterias ácido lácticas "Previenen la putrefacción intestinal" y "Ayudan a mantener las fuerzas del cuerpo" [5]. En un estudio realizado en Tribus Maasai de África, se encontró que esta tribu come una gran cantidad de carne y consume regularmente 4-5 litros de leche entera fermentada por día. Estas personas tienen bajos niveles de colesterol en sangre y raramente experimentan enfermedades coronarias [6]. Además, pacientes que recibieron leche fermentada con L. Acidophilus presentaron una disminución significativa (2,4%) en el colesterol en la sangre [7]. Esto sugiere que la leche fermentada es una buena opción para disminuir el colesterol sanguíneo. En 26 voluntarios, se encontró que grandes cantidades de yogur reducen los niveles de colesterol por disminuir la conversión de acetato a colesterol [8]. En un ensayo clinico controlado, doble ciego y aleatorizado, se observó que consumo de probióticos redujo significativamente (11.6%) los niveles séricos de triglicéridos (TG) [9]. Otros estudios clínicos encontraron que la cepa E. faecium y Bifidobacterium longum disminuyen el colesterol [10]. Por su parte Jones et al. observaron que la formulación de yogur que contiene actividad de hidrolasa de sales biliares (HSB) con Lactobacillus reuteri NCIMB 30242 es eficaz y segura para disminuir las lipoproteínas de baja densidad (LDL), el colesterol, la apoB-100, y las no lipoproteína de alta densidad no-(HDL) en sujetos hipercolesterolémicos [11]. Lin et al. observaron que el colesterol en sangre se redujo significativamente en voluntarios que recibieron diariamente tabletas de L. bulgaricus y L. Acidophilus por 16 semanas [12]. También pacientes que se les administró L. sporogenes durante 90 días mostraron una disminución de los niveles de HDL y colesterol total en un 35% y un 32%, respectivamente [13]. Por otro lado, en modelos animales, la leche fermentada con L. Acidophilus y con Bifidobacterium redujeron significativamente el colesterol [14] y mejoró el perfil lipídico en ratas [15], resultados similares se obtuvieron cuando las ratas fueron alimentadas con yogur preparado con B. lactis [16]. En ratones, L. reuteri disminuyo los niveles de TG en sangre en un 38% y colesterol en un 40%, mientras que aumentó la relación HDL/LDL en un 20% [17].
Mecanismos de Acción para la Reducción del Colesterol
Disminución de la absorción del colesterol
Gilliland et al. mostraron que algunas cepas de Lactobacillus acidophilus disminuyen la absorción de colesterol por unirlo al lumen intestinal [18]. Tahri et al. observó que Bifidobacterium elimina el colesterol del medio de cultivo por precipitarlo [19]. También se ha sugerido que la hipocolesterolemia observada en vivo puede ser debido a la asimilación del colesterol como lo hace L. acidophilus o por la unión a la superficie de las células como en el caso de L. acidophilus [20].
Las sales biliares son excretadas en el duodeno en forma de compuestos N–acil conjugados con glicina o taurina, e inducen la emulsificación de los lípidos que facilita la absorción de los mismos; la excreción de bilis es la principal ruta de eliminación de colesterol, así como una de las principales vías del metabolismo del mismo [21]. Cuando las sales biliares conjugadas son hidrolizadas en el intestino, proceso conocido como desconjugación, su solubilidad y capacidad de emulsificación disminuye, lo que ocasiona que sean menos solubles y absorbidas por el intestino que las conjugadas. De está forma las sales biliares son menos absorbidas, y por lo tanto, el colesterol coprecipitan a valores de pH menores de 5.5, así se une a las células bacterianas y fibra dietética, lo que facilita su excreción en las heces [22]. Por su parte, las bacterias ácido lácticas (BAL) con actividad HSB reducen los niveles de colesterol a través de la interacción con la bilis del huésped. Los lactobacilos con actividad HSB, por su capacidad de hidrolizar las sales biliares, tienen la ventaja de sobrevivir y colonizar el intestino delgado inferior donde tiene lugar el ciclo enterohepático, y por lo tanto la HSB puede considerarse como un importante factor de colonización [23]. Así algunos investigadores han propuesto que ciertos lactobacilos probióticos y bifidobacterias con actividad de HSB pueden disminuir los niveles de colesterol en sangre al desconjugar enzimáticamente los ácidos biliares, aumentando sus tasas de excreción, y con ello disminuyendo la solubilización y absorción de los lípidos en el intestino. Esto es debido a que las sales biliares desconjugadas son menos eficientes para formar micelas, por lo que se ha asumido que es la causa de la disminución de la solubilidad del colesterol. La enzima HSB en algunas bacterias probióticas, incrementa la hidrolisis de las sales biliares conjugadas con los aminoácidos glicina o taurina a sales biliares libres, con ello aumenta la excreción de colesterol. Lo anterior resulta en una menor cantidad de colesterol disponible para ser absorbido y metabolizado, disminuyendo los niveles de colesterol sanguíneo. Este mecanismo de accion se miestra en la Figura 1. Algunas bacterias con potencial para disminuir el colesterol debido a que muestran HSB, son las siguientes: Bifidobacerium adolescentis, B. animalis, B. breve, B. infantis, B. longum, Bifidobacterium sp, Lactobacillus acidophilus, L. casei, L. fermentum, L gasseri, L. helveticus, L. paracasei, L. Rhamnosus y L. plantarum. Además, algunos exopolisácaridos producidos por bacterias lácticas pueden actuar como prebióticos, estimulando el aumento de la eliminación de las sales biliares en las heces, con la consecuente reducción de los niveles de colesterol sérico [24].
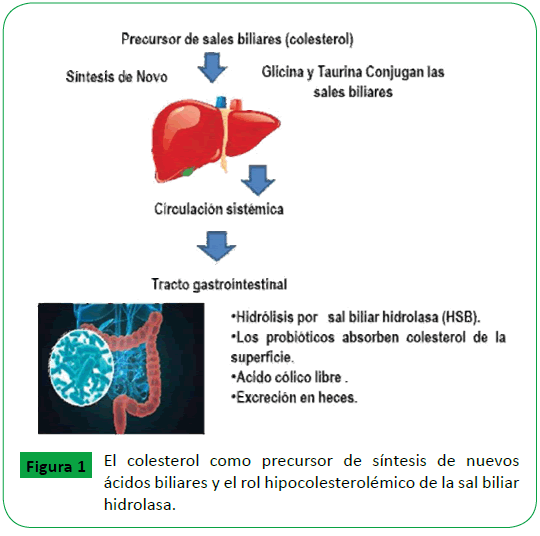
Figura 1: El colesterol como precursor de síntesis de nuevos ácidos biliares y el rol hipocolesterolémico de la sal biliar hidrolasa.
Unión del colesterol a la membrana bacteriana
Diversos estudios in vitro demostraron que el colesterol no es degradado metabólicamente, si no que se incorpora a las membranas de las células probióticos de origen lactobacilos. La bacteria es más resistente a la lisis por sonicación, lo que sugiere una alteración de la pared celular debida a la incorporación del colesterol a ésta [25]. Mediante microscopia de barrido (SEM) se observo que las bacterias no incorporan el colesterol a sus estructuras, si no que gracias a las propiedades físicas y estructurales de los aminoácidos que forman los peptidoglicanos, éste es unido a la bacteriana. Los aminoácidos de los peptidoglicanos son capaces de unir el colesterol tras la fermentación y de esta forma inhibir la absorción intestinal [25].
Conversión de colesterol a coprostanol
También se puede evitar la absorción del colesterol por metabolismo del mismo. Es decir, el colesterol a nivel del intestino puede ser transformado en una serie de metabolitos microbianos, siendo el coprostanol el más abundante. Se han analizado diversas cepas del género lactobacilos donde se les midió su capacidad de reducción del colesterol a coprostanol en presencia de sales biliares (oxgall, ácido cólico y ácido taurocólico). Se observó mayor concentración de coprostanol en el medio que contenía oxgall, siendo la menor concentración observada en el medio que contenía ácido cólico [26]. Interesantemente se encontró que la edad de las personas afecta la conversión del colesterol a coprostanol, encontrando que en pacientes >50 años tienen mayor tasa de conversión (>40%). También reportaron que hay un mayor porcentaje de mujeres que tienen mayor capacidad de conversión en comparación con los hombres, sobre todo en los grupos <36 años (76% vs. 62%) [27].
Inhibición de la formación de micelas
Las saponinas procedentes de plantas forman complejos insolubles con esteroles, entre ellos el colesterol y ácidos biliares, esto se debe a que la parte hidrofóbica de la saponina se asocia con la porción hidrofóbica del núcleo del esterol mediante una unión lipofílica en una asociación micelar apilada. Las saponinas se unen al colesterol en la bilis del intestino previniendo su reabsorción, al afectar la permeabilidad de las células intestinales por la formación de estos complejos y ser las saponinas anfipáticos, influyen en la emulsificación y formación de sustancias solubles en grasa, incluyendo la formación de micelas [28]. Se han estudiado cepas pertenecientes al género lactobacillus que inducen aumento de la actividad de la enzima 7 α-hidrolasa en el hígado, además efecto inhibidor contra la absorción en las micelas a nivel de intestinal [29].
Fermentación selectiva de ciertos alimentos por la microbiota intestinal
La fermentación selectiva de ciertos alimentos por la MI da como resultado la producción de ácidos grasos de cadena corta (AGCC) y por consiguiente la reducción de los niveles de colesterol en el plasma [30]. La microbiota del colon fermenta material orgánico que no puede ser digerido de otro modo por el huésped en el intestino superior, siendo los principales productos acetato, propionato y butirato, aunque también se pueden producir lactato, succinato y etanol. El acetato es el principal AGCC producido en el colon, el cual es usado para la lipogénesis una vez que entra en la circulación sistemática, además de que es el principal sustrato para la síntesis de colesterol y TG, así como para la gluconeogenesis. Por su parte, el propionato inhibe la síntesis de colesterol en tejido hepático, siendo relevante la proporción propionato:acetato en el colon, ya que a mayor sea la proporción, se reduce la síntesis de colesterol procedente del acetato [31].
Conclusión
La necesidad por mejorar los tratamientos para la reducción de la hipercolesterolemia y con ello prevenir el desarrollo de enfermedades cardiovasculares ha propiciado utilizar a los probióticos como alternativa contra la hipercolesterolemia. Al respecto, los resultados obtenidos de estudios in vitro, en modelos animales y ensayos clínicos muestran que las bacterias probióticas pueden ser utilizadas para disminuir la hipercolesterolemia. Los posibles mecanismos que utilizan para reducir el colesterol incluyen la desconjugación de la bilis por la presencia de la HSB, la coprecipitación de colesterol, la fijación del colesterol a las membranas del intestino y a la pared bacteriana, la conversión de colesterol a diferentes metabolitos como el coprostanol, inhibición de la formación de miscelas y la fermentación de diversos alimentos por las bacterias. Todos estos mecanismos se suman para reducir los niveles de colesterol en sangre, lo cual puede prevenir el desarrollo de enfermedades cardiovasculares. Debido a la gran diversidad de las bacterias probióticas, es importante la búsqueda y asilamiento de cepas con mayor capacidad de reducción de colesterol.
Agradecimientos
Al CONACYT-México por el apoyo otorgado a Joel Ramírez- Emiliano y la beca otorgada a Fátima Airam Márquez-Villalobos (355968); al PRODEP por el apoyo otorgado a Hilda Lissette López-Lemus.
References
- WHO (2003) Diet, nutrition and the prevention of chronic diseases. Geneva.
- FEdC Informe de la salud cardiovascular en españa en el contexto europeo (2008) Sociedad Española de Cardiología.
- Yusuf S, Hawken S, Ôunpuu S, Dans T, Avezum A, et al. (2004) Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): Case-control study. The Lancet 364: 937-952.
- Gotteland MP (2013) El papel de la microbiota intestinal en el desarrollo de la obesidad y de la diabetes de tipo-2. Rev chil endocrinol diabetes 4: 155-162.
- St-Onge MFE, Jones P (2000) Consumption of fermented and nonfermented dairy products: Effects on cholesterol concentrations and metabolism. American Journal of Clinical Nutrition 3: 674-681.
- Mann GV (1974) Studies of a surfactant and cholesteremia in the Maasai. Am J Nutr 27: 464-469.
- Gilliland FD, Mahler R, Hunt WC, Davis SM (1999) Preventive health care among rural American Indians in New Mexico. Prev Med 2: 194-202.
- Mann GV (1974) A Factor in yogurt wich lowers cholesteremia in man. Atherosclerosis 26: 335-340.
- Klein A, Friedrich U, Vogelsang H, Jahreis G (1999) Lactobacillus acidophilus 74-2 and Bifidobacterium animalis subsp lactis DGCC 420 modulate unspecific celular immune response in healthy adults. Prev Med 2: 194-202.
- Xiao JZ, Kondo S, Takahashi N, Miyaji K, Oshida K, et al. (2003) Effects of milk lipids in rats and healthy adult male volunteers. J Dairy Sci 7: 2452-2461.
- Jones M, Martoni CJ, Parent M, Prakash S (2011) Cholesterol-lowering efficacy of a microencapsulated bile salt hydrolase-active Lactobacillus reuteri NCIMB 30242 yoghurt formulation in hypercholesterolaemic adults. Br J Nutr 9: 1-9.
- Lin SY, Ayres JW, Winkler W, Sandine WE (1989) Lactobacillus effects on cholesterol: in vitro and in vivo results. J Dairy Sci 11: 2885-2899.
- Mohan JC, Arora R, Khalilullah M (1990) Preliminary observations on effect of Lactobacillus sporogenes on serum lipid levels in hypercholesterolemic patients. Indian J Med Res 1: 431.
- Grunewald KK (1982) Serum cholesterol levels in rats fed skim milk fermented by Lactobacillus acidophilus. J Food Sci 1: 2078-2079.
- Xiao J KS, Takahashi N, Miyaji K, Oshida K, Hiramatsu A, et al. (2003) Effects of milk products fermented by bifidobacterium longum on blood lipids in rats and healthy adult male volunteers. J Dairy Sci 7: 2452-2461.
- El-Gawad IA, El-Sayed EM, Hafez SA, El-Zeini HM, Saleh FA (2005) The hypocholesterolaemic effect of milk yoghurt and soy-yoghurt containing bifidobacteria in rats fed on a cholesterol-enriched diet. Int Dairy J 1: 33-44.
- Taranto M, Medici M, Perdigon G, Ruiz A, Valdez G (1998) Evidence for hypocholesterolemic effect of Lactobacillus reuteri in hypercholesterolemic mice. J Dairy Sci 1: 2336-1240.
- Gilligand S NC, Maxwell C (1985) Assimilation of cholesterol by Lactobacillus acidophilust. Appl Environ Microbiol 2: 377-381.
- Khalid T, Grill JP, Francois S (1996) Bifidobacteria Strain Behavior Toward Cholesterol: Coprecipitation with Bile Salts and Assimilation. Curr Microbiol 33: 187-193.
- Lin S, Ayres JW, Winkler W, Sandine E (1989) Lactobacillus effects on cholesterol: in vitro and in vivo results. J Dairy Sci 11: 2885-2899.
- Jones ML, Chen H, Ouyang W, Metz T, Prakash S (2004) Microencapsulated genetically engineered Lactobacillus plantarum 80 (pCBH1) for bile acid deconjugation and its implication in lowering cholesterol. J Biomed Biotechnol 1: 61-69.
- TSai CC, Pei-Pei H, You-Miin Z, Zi-yi W, Hui-Ching H, et al. (2014) Cholesterol-Lowering potentials of lactic acid bacteria based on bile-salt hydrolase activity and effect of potent strains on cholesterol metabolismin vitroand in vivo. Sci World J 2014: 1-10.
- Begley MH, Gahan CGM, Hill C (2006) Bile salt hydrolase activity in probiotics. Appl Environ Microbiol 72: 1729-1738.
- Reyes C, Margolles A, Ruas P, Noriega L (2002) Modificación de propiedades probióticas en microorganismos del género Bifido consecuencia de la adquisición de resis. Agrocsic.
- Lye HS, Rahmat-Ali GR, Liong MT (2010) Mechanisms of cholesterol removal by lactobacilli under conditions that mimic the human gastrointestinal tract. Int Dairy J 3: 169-175.
- Lye H RG, Liong M (2010) Removal of cholesterol by Lactobacilli via incorporation and coversion to coprostanol. J Dairy Sci 93: 1383-1392.
- Benno MP, Alam K, Collinder M, Norin E, Midtvedt E, et al. (2005) Examination of intestinal conversion of cholesterol to coprostanol in 633 healthy subjects reveals an age- and sex-dependent pattern. Microbial Ecol Health Dis 17: 200-204.
- Cheeke PR (2000) Actual and potential applications of Yucca schidigera and Quillaja saponaria saponins in human and animal nutrition. InSaponins in food, feedstuffs and medicinal plants pp: 241-254.
- Susuki Y, Kaizu H, Yamauchi Y (1991) Effect of cultured milk on serum cholesterol concentrations in rats which fed high-cholesterol diets. Animal Sci Tech 2: 565-571.
- Elke AR, Helmut F (1998) Dietary inulin lowers plasma cholesterol and triacylglycerol and alters biliary bile acid profile in hamsters. J Nutr 128: 1937-1943.
- Huazano-Garcia AG, Mercedes GL (2013) Metabolism of short chain fatty acids in the colon and faeces of mice after a supplementation of diets with agave fructans. InTech.
21536
References
- WHO (2003) Diet, nutrition and the prevention of chronic diseases. Geneva.
- FEdC Informe de la salud cardiovascular en españa en el contexto europeo (2008) Sociedad Española de Cardiología.
- Yusuf S, Hawken S, Ôunpuu S, Dans T, Avezum A, et al. (2004) Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): Case-control study. The Lancet 364: 937-952.
- Gotteland MP (2013) El papel de la microbiota intestinal en el desarrollo de la obesidad y de la diabetes de tipo-2. Rev chil endocrinol diabetes 4: 155-162.
- St-Onge MFE, Jones P (2000) Consumption of fermented and nonfermented dairy products: Effects on cholesterol concentrations and metabolism. American Journal of Clinical Nutrition 3: 674-681.
- Mann GV (1974) Studies of a surfactant and cholesteremia in the Maasai. Am J Nutr 27: 464-469.
- Gilliland FD, Mahler R, Hunt WC, Davis SM (1999) Preventive health care among rural American Indians in New Mexico. Prev Med 2: 194-202.
- Mann GV (1974) A Factor in yogurt wich lowers cholesteremia in man. Atherosclerosis 26: 335-340.
- Klein A, Friedrich U, Vogelsang H, Jahreis G (1999) Lactobacillus acidophilus 74-2 and Bifidobacterium animalis subsp lactis DGCC 420 modulate unspecific celular immune response in healthy adults. Prev Med 2: 194-202.
- Xiao JZ, Kondo S, Takahashi N, Miyaji K, Oshida K, et al. (2003) Effects of milk lipids in rats and healthy adult male volunteers. J Dairy Sci 7: 2452-2461.
- Jones M, Martoni CJ, Parent M, Prakash S (2011) Cholesterol-lowering efficacy of a microencapsulated bile salt hydrolase-active Lactobacillus reuteri NCIMB 30242 yoghurt formulation in hypercholesterolaemic adults. Br J Nutr 9: 1-9.
- Lin SY, Ayres JW, Winkler W, Sandine WE (1989) Lactobacillus effects on cholesterol: in vitro and in vivo results. J Dairy Sci 11: 2885-2899.
- Mohan JC, Arora R, Khalilullah M (1990) Preliminary observations on effect of Lactobacillus sporogenes on serum lipid levels in hypercholesterolemic patients. Indian J Med Res 1: 431.
- Grunewald KK (1982) Serum cholesterol levels in rats fed skim milk fermented by Lactobacillus acidophilus. J Food Sci 1: 2078-2079.
- Xiao J KS, Takahashi N, Miyaji K, Oshida K, Hiramatsu A, et al. (2003) Effects of milk products fermented by bifidobacterium longum on blood lipids in rats and healthy adult male volunteers. J Dairy Sci 7: 2452-2461.
- El-Gawad IA, El-Sayed EM, Hafez SA, El-Zeini HM, Saleh FA (2005) The hypocholesterolaemic effect of milk yoghurt and soy-yoghurt containing bifidobacteria in rats fed on a cholesterol-enriched diet. Int Dairy J 1: 33-44.
- Taranto M, Medici M, Perdigon G, Ruiz A, Valdez G (1998) Evidence for hypocholesterolemic effect of Lactobacillus reuteri in hypercholesterolemic mice. J Dairy Sci 1: 2336-1240.
- Gilligand S NC, Maxwell C (1985) Assimilation of cholesterol by Lactobacillus acidophilust. Appl Environ Microbiol 2: 377-381.
- Khalid T, Grill JP, Francois S (1996) Bifidobacteria Strain Behavior Toward Cholesterol: Coprecipitation with Bile Salts and Assimilation. Curr Microbiol 33: 187-193.
- Lin S, Ayres JW, Winkler W, Sandine E (1989) Lactobacillus effects on cholesterol: in vitro and in vivo results. J Dairy Sci 11: 2885-2899.
- Jones ML, Chen H, Ouyang W, Metz T, Prakash S (2004) Microencapsulated genetically engineered Lactobacillus plantarum 80 (pCBH1) for bile acid deconjugation and its implication in lowering cholesterol. J Biomed Biotechnol 1: 61-69.
- TSai CC, Pei-Pei H, You-Miin Z, Zi-yi W, Hui-Ching H, et al. (2014) Cholesterol-Lowering potentials of lactic acid bacteria based on bile-salt hydrolase activity and effect of potent strains on cholesterol metabolismin vitroand in vivo. Sci World J 2014: 1-10.
- Begley MH, Gahan CGM, Hill C (2006) Bile salt hydrolase activity in probiotics. Appl Environ Microbiol 72: 1729-1738.
- Reyes C, Margolles A, Ruas P, Noriega L (2002) Modificación de propiedades probióticas en microorganismos del género Bifido consecuencia de la adquisición de resis. Agrocsic.
- Lye HS, Rahmat-Ali GR, Liong MT (2010) Mechanisms of cholesterol removal by lactobacilli under conditions that mimic the human gastrointestinal tract. Int Dairy J 3: 169-175.
- Lye H RG, Liong M (2010) Removal of cholesterol by Lactobacilli via incorporation and coversion to coprostanol. J Dairy Sci 93: 1383-1392.
- Benno MP, Alam K, Collinder M, Norin E, Midtvedt E, et al. (2005) Examination of intestinal conversion of cholesterol to coprostanol in 633 healthy subjects reveals an age- and sex-dependent pattern. Microbial Ecol Health Dis 17: 200-204.
- Cheeke PR (2000) Actual and potential applications of Yucca schidigera and Quillaja saponaria saponins in human and animal nutrition. InSaponins in food, feedstuffs and medicinal plants pp: 241-254.
- Susuki Y, Kaizu H, Yamauchi Y (1991) Effect of cultured milk on serum cholesterol concentrations in rats which fed high-cholesterol diets. Animal Sci Tech 2: 565-571.
- Elke AR, Helmut F (1998) Dietary inulin lowers plasma cholesterol and triacylglycerol and alters biliary bile acid profile in hamsters. J Nutr 128: 1937-1943.
- Huazano-Garcia AG, Mercedes GL (2013) Metabolism of short chain fatty acids in the colon and faeces of mice after a supplementation of diets with agave fructans. InTech.






